- Details
- Zugriffe: 15862
Kapitel 02: Einteilung chemischer Reaktionen

Echtes Gold?
Die ersten Chemiker (Alchemisten) sollten in den vergangenen Jahrhunderten Gold herstellen.
Es ist ihnen aber nie gelungen. In dieser Lektion lernst Du warum :-)
Die Vereinigung (=Synthese)
1) Die Trennung von Eisen und Schwefel
Oft sind in der Natur und auch im Haushalt Stoffe nicht rein, sondern vermischt. Aber kann man das wieder rückgängig machen? Kann man ein Gemisch wieder in seine Bestandteile trennen?
Wenn Du kurz überlegst, fallen Dir sicherlich viele Methoden zum Trennen ein.
Eisen
grau, pulvrig
höhere Dichte als Wasser
magnetisch
Schwefel
zitronengelb, pulvrig
geringere Dichte als Wasser
wasserunlöslich
Eisen-Schwefel-Gemisch:
graugrünes Pulver
z.T. magnetisch, z.T. nicht magnetisch,
Trennung durch Wasser
oder Magneten möglich
Es gibt drei Methoden, mit denen sich Eisen- und Schwefelpulver trennen lassen:
a) Trennung durch einen Magneten unter einem Blatt Papier
b) Trennung durch unterschiedliche Schwimmeigenschaften in Wasser.
(Siehe Bild - ist aber etwas schwierig, weil Schwefel zwar hauptsächlich
schwimmt, aber mit Eisen „zusammengebappt“ auch untergehen kann!)
c) Sortieren, nach Farbe, Körnchengröße und Struktur

Beschrifte die beiden Striche!
Gemische kann man (durch geeignete Hilfsmittel) voneinander trennen.
Dabei macht man sich zunutze, dass sich zwei Stoffe in mindestens
einer ihrer Eigenschaften unterscheiden.
2) Abwandlung des Experiments: Reaktion von Eisen mit Schwefel
V: Entzündung des Schwefel-Eisengemisches mit einem glühendem Nagel oder einer glühenden Stricknadel
B: Selbstständiges Durchglühen, es bildet sich ein schwarzes, festes Produkt
Test auf weitere Eigenschaften:
=> höhere Dichte als Wasser
=> das Produkt ist nicht mehr magnetisch
S: Die neuen Eigenschaften zeigen, dass ein völlig neuer Stoff entstanden ist. Dieser Stoff ist nicht Eisen und nicht Schwefel, sondern komplett neu! Er wird nach seinen Ausgangsstoffen benannt: „Eisenschwefel“ oder auch Eisensulfid. Sulfid ist der Name von Schwefel, den er in einer Verbindung hat. So kann man ihn leichter vom ungebundenen Schwefel unterscheiden.
Der neue Stoff war vorher nicht dort, er ist erst durch die Reaktion entstanden. Eisen und Schwefel sind nicht mehr vorhanden!
Reaktionsgleichung: Eisen + Schwefel --> Eisenschwefel + Energie
Entsteht aus mindestens zwei verschiedenen Reinstoffen ein völlig neuer Reinstoff, so spricht man von einer Vereinigung. Dieser neue Reinstoff wird auch „Verbindung“ genannt.
Aufgaben
1. Beschreibe die Bilder und erkläre, wie es zu den Unterschieden kommt.
2. Wo findet eine chemische Reaktion statt?
3. Was sind die Merkmale einer chemischen Reaktion?
4. Betrachte die Bilder: Welcher Stoff lag im Überschuss vor?
Schwefel:
Eisenpulver:

Schwefel vermischt mit Eisen:
Eisensulfid am Nagel:

Eisensulfidhaufen mit rost-rotem Eisenrest:

Praktische Tipps zur Trennung von Eisen und Schwefel
- Trennung mit Wasser geht nur recht bescheiden, da ein Teil des schwimmenden Schwefels auch Eisen mitschwimmen lässt und ein Teil des Schwefels untergeht... Also, nicht so geeignet, da man kaum eine gute Trennung hinbekommt. Das Eisen kann auch schnell rosten
- Trennungen aufgrund der Korngröße gehen nur, wenn sie wirklich sehr unterschiedlich sind, also meist auch nicht!
- am besten geht die Trennung von Eisen und Schwefel mit einem zweiten Blatt Papier und einem Magneten. Achte darauf, dass immer Papier zwischen Magnet und Gemisch ist, sonst verschmutzt der Magnet stark. Wenn Du nun für ca. 5-10min die Gemische gut trennst, hast Du im Eisen noch Schwefelreste, die je nach Geduld immer weniger werden.
Vielleicht würde ganz am Ende, wenn das Eisen schon fast ganz rein ist, eine Wassertrennung sogar funktionieren und das Ergebnis noch verbessern!
Hier ist ein Video zum Versuch: https://www.youtube.com/watch?v=wJs9W-MkGZo
Vereinigung von Kupfer mit Schwefel
V: Kupfer soll mit Schwefel zur Reaktion gebracht werden:
1. Gib zuerst zwei Spatelspitzen Schwefel in ein Reagenzglas und spanne das Reagenzglas fast waagerecht ein. Schiebe einen 1cm · 5cm langen Kupferstreifen bis zur Mitte in das Reagenzglas und verschließe es, wenn vorhanden locker mit etwas Glaswolle.
2. Erhitze zuerst das Kupferblech und bringe dann den Schwefel zum Sieden, so dass der Schwefeldampf über das heiße Kupferblech streicht. Dadurch sollte die Reaktion starten.
3. Untersuche nun die entstandene Substanz. Notiere Beobachtung und Schlussfolgerung im Heft.
B: Das Kupferblech glüht durch
Das Endprodukt ist ein blau-grauer, brüchiger Stoff.
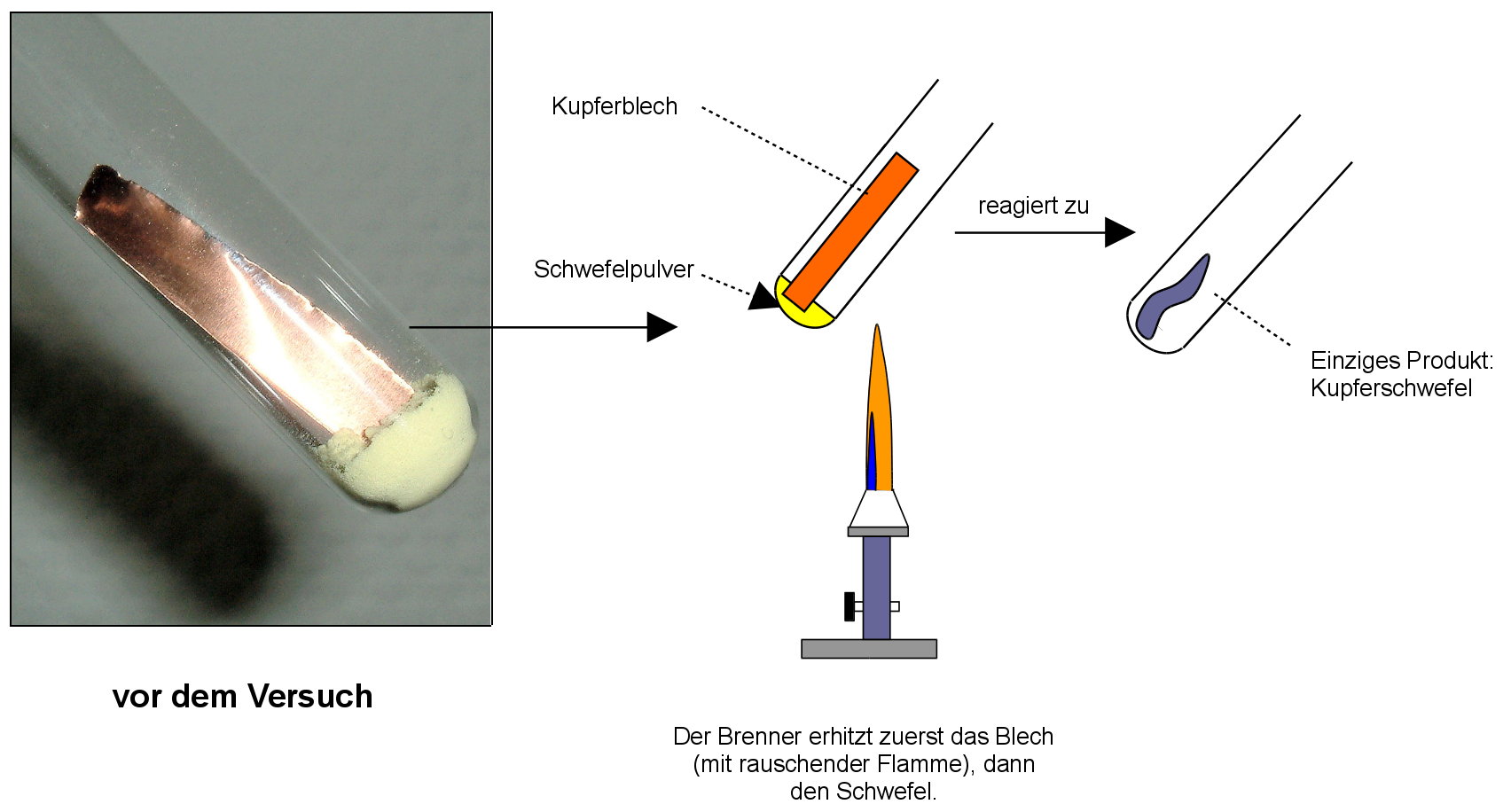
S: Es findet eine Reaktion statt. Energie wird frei. Ein neuer Stoff entsteht. Kupfer und Schwefel haben sich zu einem neuen Stoff, Kupfersulfid (=Kupferschwefel) vereinigt. Die Verbindung „Kupfersulfid“ ist ein blaugrauer, spröder und brüchiger Stoff.
Reaktionsgleichung: Kupfer + Schwefel --> Kupfersulfid + Energie
Aufgaben:
1. Wenn Du einen Steckbrief von Kupfersulfid erstellen sollst, welche seiner Eigenschaften sollten unbedingt darin auftauchen?
2. Ist im Kupfersulfid noch Schwefel oder Kupfer vorhanden? Untersuche den Stoff und stelle Vermutungen dazu an.
3. Vervollständige:
a) Wenn man bei Versuchsbeginn zu wenig Schwefel zufügt, dann...
b) Wenn man bei Versuchsbeginn zu viel Schwefel zufügt, dann...
4. Eine kreative Lösung ist gesucht: Wie könnte man die Reaktion ablaufen lassen, so dass keiner der beiden Stoffe im Überschuss vorhanden ist und keine Reste bleiben?
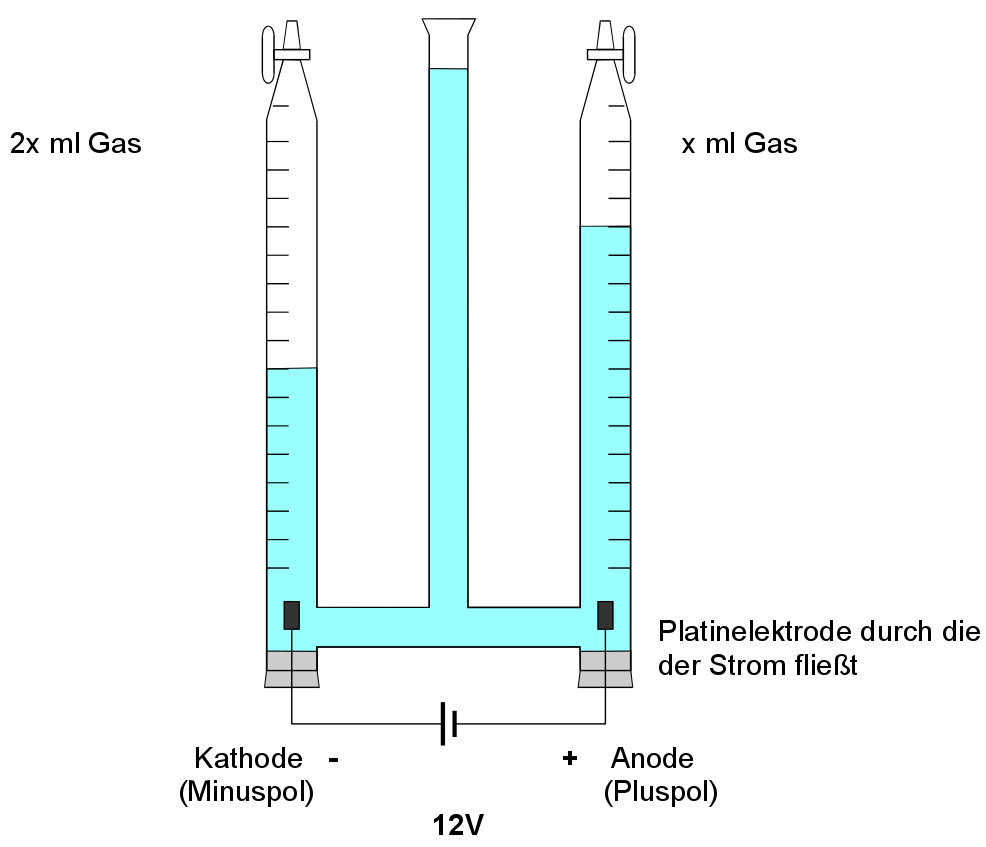
Zersetzung von Wasser (=Analyse von Wasser)
V: Im „Hoffmanschen Zersetzungsapparat“ (= Dreischenkel Gerät) wird Wasser unter ca. 12V Spannung gesetzt und die Produkte werden untersucht.
|
B |
S |
|
Zwei Gase entstehen im Verhältnis 1:2 |
=> Aus dem Wasser bilden sich zwei neue Stoffe |
|
Die Menge des Wassers nimmt ab |
=> Das Wasser ist der Ausgangsstoff der Reaktion, der in Gas umgewandelt wird |
|
Gas 1 zeigt eine positive Knallgasprobe |
=> Es ist Wasserstoff entstanden |
|
Gas 2 zeigt eine positive Glimmspanprobe, |
=> Es ist Sauerstoff entstanden |
|
Wird der Strom ausgeschaltet, findet keine Reaktion mehr statt |
=> Die Reaktion benötigt Energie zum Ablaufen |
Wasser + E --> Sauerstoff + Wasserstoff
Der Reinstoff Wasser (eine Verbindung) wurde in zwei Reinstoffe zersetzt.
Dieser Vorgang läuft nur solange ab, wie elektrische Energie zugefügt wird.
Wenn man als Schüler Probleme hat, sich unter den Begriff Zersetzung etwas vorzustellen, dann ist es vielleicht hilfreich sich eine Spaltung des Ausgangsstoffes vorzustellen vorstellen.
Zusatzinformationen:
Vielleicht hast Du schon mal die chemische Formel H2O gehört. Sie ist die Formel von Wasser. In einem späteren Kapitel wirst Du mehr darüber lernen.
Der Versuch klappt nur mit Gleichspannung, weil nur diese zwei Pole (Plus und Minus) hat.
Die Zersetzung von Quecksilberoxid
Der folgende Versuch ist für die Schule ungeeignet, da im Verlauf ein sehr giftiger Stoff entsteht.
Theoretischer Versuch: Erhitzen von Quecksilberoxid. Das entstehende Gas wird in einem mit Wasser gefülltem Reagenzglas aufgefangen (das nennt man auch „pneumatisches Auffangen“).

|
Beobachtung |
Schlussfolgerung |
|
- beim Erhitzen entstehen Gasblasen |
|
|
- silbrig glänzende Tröpfchen am oberen Ende des Reagenzglases (dort wo es noch kälter ist) |
|
Quecksilberoxid besteht aus den zwei Elementen Quecksilber und Sauerstoff. Quecksilber ist ein grauer Stoff, der sich nach dem Erhitzen am kalten Reagenzglasrand absetzt.
Quecksilberoxid (roter Feststoff) --> Quecksilber Sauerstoff (silbrig glänzende (farbloses Gas), Flüssigkeit)
Entstehen aus 1 Reinstoff mindestens 2 neue Reinstoffe, so spricht man von einer Zersetzung.
Quecksilberoxid + E -----> Quecksilber + Sauerstoff
-
Quecksilberoxid
+ E
-->
Quecksilber
+ Sauerstoff
Reinstoff
+ E
-->
Reinstoff
+ Reinstoff
Verbindung
+ E
-->
Element
+ Element
Beachte: Quecksilber kann durch keinen weiteren Versuch zersetzt werden!
=> Erweiterte Elementdefinition: Ein Element ist ein Reinstoff, der nicht weiter zersetzt werden kann.
Zusatzinformationen: https://de.wikipedia.org/wiki/Quecksilber
Die Zersetzung von Silbersulfid
Ein ähnlicher Versuch ist durch das Erhitzen von Silbersulfid möglich. Kannst Du ihn erklären?
Vor der Reaktion:

Nach der Reaktion:
Das Glasrohr ist überall gelb gefärbt und der Feststoff hat auch seine Farbe verändert.
Auflösung:
B: Silberschwefel ist ein grau/schwarzer Stoff, der in einem Rohr zur Reaktion gebracht wird. Dabei entsteht aus ihm Silber und Schwefel. Schwefel setzt sich am kalten Glasrand ab, das Silber bleibt wegen seiner hohen Dichte am Glasboden liegen.
S: Beim Erhitzen zerfällt Silberschwefel in seine Elemente Silber und Schwefel. Man spricht auch von einer „thermischen Zersetzung“.
Aufgaben:
1. Erstelle eine tabellarische Übersicht mit allen Zersetzungen, die Du kennst. Schreibe in die nächste Form, wie man bei diesen den Energieumsatz erkennt und in welcher Form Energie auftritt. Abschließend füge in eine zusätzliche Spalte ein, ob man diese Zersetzungen auch wieder rückgängig machen kann.
2. In der Bratpfanne wird ein Rest Bratkartoffeln und ein Stück Fleisch vergessen. Der Herd heizt, ohne das es bemerkt wird noch weiter. Erst nach 2 Stunden wird das Malheur bemerkt. In der Pfanne ist nur noch ein wenig schwarzer Rückstand zu finden. Liegt eine chemische Reaktion vor? Wenn ja, welcher Typ - Vereinigung oder Zersetzung? Begründe Deine Meinung.
Zusammenfassung: Kennzeichen chemischer Reaktionen
Bei chemischen Versuchen passiert eine ganze Menge. Vermutlich hast Du in der Schule auch schon viele chemische Reaktionen gesehen. Jede dieser Reaktionen geht auf die darin beteiligten Stoffe zurück. Diese Stoffe sind alle aus Atomen aufgebaut.
Man kann chemische Reaktionen in drei Typen einteilen:
Vereinigung: mehrere Atome vereinigen sich zu einem neuen Stoff (die Vereinigung wird auch Synthese genannt)
Zersetzung: Ein Stoff, der aus mehreren Atomen besteht (nennt man auch Verbindung) wird in einzelne Atome aufgespalten (die Zersetzung wird auch Analyse genannt.)
Umsetzung: zwei Stoffe tauschen untereinander Atome aus (also erst zersetzen sich die Stoffe, dann vereinigen sich neu)
Bei allen chemischen Reaktionen spielt Energie eine wichtige Rolle! Energie kann frei werden oder benötigt werden. Sicher weißt Du, dass beim Verbrennen von Holz Wärme und Licht freiwerden, das sind Energieformen. Die Verbrennung ist also eine chemische Reaktion.
Eine chemische Reaktion ist gekennzeichnet durch eine Stoffumwandlung und einen Energieumsatz.
In der Laborpraxis sind Stoffumwandlungen durch die Änderung von Eigenschaften erkennbar.
Den Energieumsatz erkennt man oft durch die Änderungen der Energieformen.
Energieformen können z.B. sein: Licht, Wärme, eine Druckwelle (Knall), elektrische Energie (in Batterien und Akkus laufen auch chemische Vorgänge ab). Kälte hingegen ist das Fehlen von Wärmeenergie.
Aufgaben:
1. Nenne fünf verschiedene Energieformen und nenne dann Geräte, welche diese ineinander umwandeln
(z.B. ein Toaster wandelt elektrischen Strom in Wärme um, usw.)
2. Wie kann man sich den Energieumsatz bei chemischen Reaktionen vorstellen?
3. Woher kann die Energie bei der Verbrennung von Benzin nur kommen?
Berzelius neue „Geheimschrift“
Alchemisten hatten im Mittelalter oft die Aufgabe Gold herzustellen. Sie waren dazu auf der Suche nach dem so genannten „Stein der Weisen“, welcher auch ewiges Leben versprach. Damit niemand die „Geheimnisse“ der Alchemisten stehlen konnte, notierte jeder von Ihnen seine Ergebnisse in einer anderen Geheimschrift. Da Alchemisten zwar kein Gold herstellen konnten, aber oft unglaubliche und eindrucksvolle Experimente durchführten, glaubten viele Menschen, dass die Chemie Hexerei sei und hatten Angst davor.
Der Schwede Jöns Jakob Freiherr von Berzelius (1779-1848) führte sehr umfangreiche und für die damalige Zeit extrem genaue Experimente durch. Er wusste dadurch, dass es eine Vielzahl von Stoffen gab und er nannte alle Reinstoffe, die nicht durch eine Vereinigung entstanden sind „Elemente“. Stoffe, die durch eine Vereinigung entstehen, nannte er „Verbindung“. Er bestimmte die für Elemente, noch heute gültige und wichtige Definition:
Ein Element ist ein Reinstoff, der nicht weiter zersetzt werden kann.
Durch diese genaue Definition war es ihm möglich, sogar drei neue chemische Elemente (Cer, Selen und Thorium) zu entdecken und die Elemente Silizium, Zirkonium und Titan als Erster in reiner Form zu isolieren.
Damit alle Chemiker davon profitieren konnten, führte er zur Vereinheitlichung das heute übliche System der chemischen Formelzeichen ein, bei dem jedes Element durch einen oder zwei Buchstaben des Alphabets symbolisiert wird. Bei Symbolen mit zwei Buchstaben wird, um Verwechslungen zu vermeiden, der Zweite grundsätzlich klein geschrieben. Nun konnten auch nicht-Chemiker diese Schrift verstehen und Einblick in die neue Wissenschaft haben. So verdiente sich Berzelius die Ehre kein Alchemist mehr gewesen zu sein, sondern vielmehr der Begründer der modernen Chemie.
Beispiele für Berzelius neue „Schrift“:
|
Elementname |
Symbol |
Ursprung |
Elementname |
Symbol |
Ursprung |
|
Wasserstoff Sauerstoff Kohlenstoff Stickstoff Schwefel Kupfer Eisen |
H O C N S Cu Fe |
Hydrogenium Oxygenium Carboneum Nitrogenium Sulfur Cuprum Ferrum |
Aluminium Gold Silber Quecksilber Blei Magnesium Phosphor |
Al Au Ag Hg Pb Mg P |
Aluminium Aurum Argentum Hydrargyrum Plumbum Magnesia Phosphorium |
Latein und Altgriechisch wurden oft als Ursprung für die wissenschaftlichen Namen.
Aufgaben:
1. Lies den Text und unterstreiche mit einem Bleistift alle Schlüsselwörter mit einer Wellenlinie, alle Nebeninformationen mit einer geraden Linie. Lies den Text dann nochmals durch, wenn Du keine Änderungen mehr an Deinen Schlüsselwörtern und den Nebeninformationen hast, kennzeichne die Schlüsselwörter mit einem Textmarker und unterstreiche die Nebeninformationen mit einer feinen roten Linie. Abschließend erstelle Dir einen Spickzettel für Deinen Vortrag mit den 10 wichtigsten Schlüsselwörtern (und beliebig viel Zeichnungen und Skizzen).
2. Übe mit Deinem Spickzettel einen freigesprochenen Vortrag zu halten.
3. Binde folgende Fragen nach Möglichkeit in Deinen Vortrag ein:
a) Warum hat Berzelius es für notwendig gehalten, eine „Kurzschreibweise“ einzuführen? (Tipp: Welchen Sinn haben Abkürzungen im Straßenverkehr
b) Warum hatten die Namen damals oft einen lateinischen oder griechischen Namen?
4. Kannst Du jetzt erklären, warum es nie ein Alchemist geschafft hat Gold herzustellen?
Elementsymbole zum Auswendiglernen
Elementsymbole von heute:
|
Elementname |
Symbol |
Elementname |
Symbol |
|
Wasserstoff |
H |
Aluminium |
Al |
|
Sauerstoff |
O |
Gold |
Au |
|
Kohlenstoff |
C |
Silber |
Ag |
|
Stickstoff |
N |
Quecksilber |
Hg |
|
Schwefel |
S |
Blei |
Pb |
|
Kupfer |
Cu |
Magnesium |
Mg |
|
Eisen |
Fe |
Phosphor |
P |
|
Mangan |
Mn |
Chrom |
Cr |
|
Nickel |
Ni |
Platin |
Pt |
|
Silizium |
Si |
Helium |
He |
|
Lithium |
Li |
Neon |
Ne |
|
Kalium |
K |
Natrium |
Na |
|
Calcium |
Ca |
Elementsymbole der Alchemisten
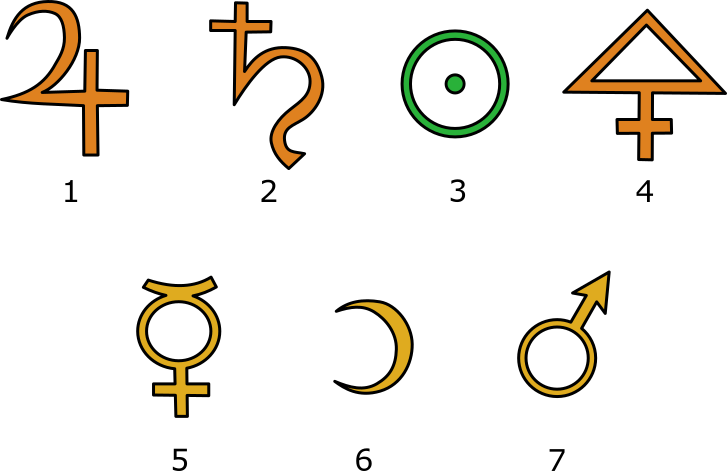
Quelle Bild: GNU-Lizenz für freie Dokumentation 1.2 und Creative-Commons-Lizenz „Namensnennung – Weitergabe unter gleichen Bedingungen 3.0 nicht portiert“ by Wikicommonsuser Roland 1952 & MaEr Thank you; https://commons.wikimedia.org/wiki/File:ElementeAlchemisten.svg
Zusatzinformationen:
https://de.wikipedia.org/wiki/Alchemie
Verschiedene Beispiele für die Geheimschrift der Alchemisten

Quelle Bild: Public domain by Wikicommonsuser Axon & Kenelm Digby A Choice Collection of Rare Secrets (1682) - thank you
https://www.lib.umich.edu/tcp/docs//dox/alchem.html; https://commons.wikimedia.org/wiki/File:Alchemy-Digby-RareSecrets.png

Quelle Bild: Public domain by Wikicommonsuser Sadi Carnot & Torbern Bergman's 1775 Dissertation Elective - thank you;
https://commons.wikimedia.org/wiki/File:Alchemical-symbols-1775.jpg
Quelle Bild: Public domain by Wikicommonsuser Frater5 & "A Table of Mediaeval Alchemical Symbols" from Basil Valentine’s The Last Will and Testament, 1670 ce. - Thank you. https://commons.wikimedia.org/wiki/File:Alchemytable.jpg
Zusammenfassung: Gemisch - Reinstoff - Element - Verbindungen
|
Reinstoffe |
---Vermischung---> <---Trennung--- |
Gemisch |
|
Eigenschaften v. Reinstoffen: Jeder noch so kleine Teil besitzt alle Eigenschaften des Stoffes. D.h.: alle Teilchen dieses Stoffes sind gleich! z.B.: - reiner Zucker - reines Kochsalz
Eigenschaften von Elementen: Elemente sind nicht zersetzbar |
Eigenschaften eines Gemisches: Jeder einzelne Bestandteil eines Gemisches, ist einem der beiden ursprünglichen Reinstoffe zuzuordnen und hat dessen Eigenschaften z.B.: Schwefel / Eisen; Kakao = Schokolade/ Fett/ Milch/ Wasser Kaffee/ Wasser
Eigenschaften von Verbindungen: Verbindungen sind zersetzbar: z.B.: Schwefeleisen Schwefelsilber Quecksilberoxid |
|
|
Element
|
<---Zersetzung--- ---Vereinigung---> |
Verbindung |
1. Lies den Text in der Tabelle aufmerksam und vervollständige die folgenden Sätze:
Die Trennung eines Gemisches ist mit einfachen physikalischen Methoden möglich.
Ein Element kann nicht mehr in zwei Reinstoffe zersetzt werden.
Die Zersetzung funktioniert nur bei Verbindungen.
Bei der Vereinigung zweier Reinstoffe entsteht eine Verbindung.
Die Zersetzung einer Verbindung ist nur mit chemischen Mitteln möglich.
Zerkleinert man ein Gemisch, so findet man mindestens zwei verschiedene Reinstoffe.
Ein Element ist ein Reinstoff, der nicht weiter zersetzt werden kann.
2. Beispiele aus der Chemie:
Schwefel und Eisen vereinigen sich zu Schwefeleisen.
Zersetzt man Silberschwefel so entstehen Silber und Schwefel.
Die Verbrennung von Kohle ist eine Vereinigung von Kohlenstoff und Sauerstoff.
Kakao ist ein Gemisch aus Schokolade, Milch, Fett und Wasser.
Mineralwasser mit Sprudel ist ein Gemisch aus Kohlenstoffdioxid und Wasser.
3. Schlage in Deinem Chemieheft alle bisher benutzen Chemikalien nach und trage sie in Dein Heft in eine Tabelle ein. Unterstreiche dann alle Stoffe mit den folgenden Farben:
Gemische in gelb, Verbindungen in grün, Reinstoffe in blau und Elemente in rot
|
Stoff |
Zersetzungsprodukt |
Weiter zersetzbar? |
|
Rohrzucker |
Zuckerkohle Qualm |
nein |
|
Quecksilberoxid |
Sauerstoff Quecksilber |
nein |
=> Ein Element ist ein Reinstoff, der nicht weiter zersetzbar ist!
Arbeitsblatt: Gemisch - Reinstoff - Element -
1. Lies den Text in der Tabelle aufmerksam und vervollständige die folgenden Sätze:
Die Trennung eines ...................... ist mit einfachen physikalischen Methoden möglich.
Ein ........................ kann nicht mehr in zwei Reinstoffe zersetzt werden.
Die ........................ funktioniert nur bei Verbindungen.
Bei der Vereinigung zweier Reinstoffe entsteht eine ...........................
Die Zersetzung einer Verbindung ist nur mit ....................... Mitteln möglich.
Zerkleinert man ein Gemisch, so findet man mindestens zwei verschiedene ............................
Ein Element ist ein Reinstoff, der nicht weiter ...................... werden kann.
2. Beispiele aus der Chemie:
Schwefel und Eisen vereinigen sich zu .......................
Zersetzt man Silberschwefel so entstehen ................. und ....................
Die Verbrennung von Kohle ist eine ...................... von Kohlenstoff und Sauerstoff.
Kakao ist ein Gemisch aus ................., ..................., ..................... und .......................
Mineralwasser mit Sprudel ist ein ................... aus Kohlenstoffdioxid und Wasser.
3. Schlage in Deinem Chemieheft alle bisher benutzen Chemikalien nach und trage sie in Dein Heft in eine Tabelle ein. Unterstreiche dann alle Stoffe mit den folgenden Farben:
Gemische in gelb, Verbindungen in grün, Reinstoffe in blau und Elemente in rot
|
Stoff |
Zersetzungsprodukt |
Weiter zersetzbar? |
|
Rohrzucker |
Zuckerkohle Qualm |
nein |
|
.....
|
=> Ein ................. ist ein ....................., der nicht weiter .......................... werden kann
Wiederholungsfragen Kapitel 2
- Erstelle zum Lernen eigene Lernkarteikarten mindestens mit folgenden Inhalten: Element, Vereinigung, Zersetzung, Elementsymbole, Aggregatzustände, Reinstoff, Gemisch, Trennungsmethoden. Führe diese Kartei selbstständig weiter!
- Entscheide anhand der Dir bekannten Merkmale von chemischen Reaktionen, ob in den Beispielen eine solche chemische Reaktion vorliegt:
a) Wäsche bei 40°C waschen
b) eine DVD zerbrechen
c) eine DVD schmelzen
d) Holz im Kamin entzünden
e) Schmelzen von Eisen in der Bunsenbrennerflamme - Erkläre die Begriffe „Vereinigung“ und „Zersetzung“ und nenne für beide Reaktionen je zwei Beispiele. Erstelle dann Reaktionsgleichungen in Wortform dazu!
- Erkläre den Unterschied zwischen einer Vereinigung (von z.B. Eisen und Schwefel) und dem Mischen (von z.B. Eisen und Schwefel).
- Erkläre den Unterschied zwischen einer Zersetzung und dem Trennen von Stoffen.
- Nenne Aussagen von Berzelius und wiederhole Dir bekannte Elementsymbole.
- Vervollständige die Tabelle mit den passenden Elementsymbolen:
|
Gold |
Sauerstoff |
Kohlenstoff |
|||
|
Wasserstoff |
Quecksilber |
Blei |
|||
|
Silber |
Magnesium |
Phosphor |
|||
|
Stickstoff |
Schwefel |
Kupfer |
|||
|
Eisen |
Aluminium |
Zink |
8. Erkläre mit Deinen Worten den Vorgang der Vereinigung.
9. Begründe, warum ein Gemisch nicht vereinigt ist?
10. Eine Testfrage lautete: Wie kann man feststellen, ob sich Silber und Schwefel in einer Reaktion tatsächlich vereinigt habe? (5P)
Ein Schüler schreibt dazu: „Wenn sich Silber und Schwefel zu Silbersulfid vereinigen, kann man es leicht zeigen, indem man beide Stoffe in Wasser gibt. Silber schwimmt nicht und Schwefel schwimmt. Durch diese Trennung ist beweisen, dass beide Stoffe in Silbersulfid enthalten sind.“
Wie viel Punkte würdest Du dem Schüler geben? Begründe Deine Meinung.
11. Wasser ist kein Element, sondern eine....................! Vervollständige den Satz und schlage ein Experiment zur Überprüfung vor.
12. In der Antike nannte man auch Erde und Feuer Elemente. Beides sind keine Elemente. Warum nicht?
13. Wie kann man das Element Sauerstoff nachweisen?
14. Wie kann man das Element Wasserstoff nachweisen?
15. Welche Eigenschaft in Bezug auf Flammen hat das Element Stickstoff?
16. Eine Frage, die einfach ist, wenn Du genau nachdenkst: Ist in Wasser grundsätzlich Wasserstoff und Sauerstoff enthalten?
17. Bei einem Versuch wird Silbersulfid erhitzt. Es entstehen zwei Produkte. Welche Farben haben sie?
18. Erkläre:

- Freies Lehrbuch "Anorganische Chemie": 03 Erforschen des Verbrennungsvorgangs
- Freies Lehrbuch "Anorganische Chemie": 04 Säuren und Laugen
- Freies Lehrbuch "Anorganische Chemie": 05 Wasser, Lösungen, Wasserstoff und das Teilchenmodel
- Freies Lehrbuch "Anorganische Chemie": 06 Atombau: Das Kern-Huelle Modell und das Periodensystem der Elemente
- Freies Lehrbuch "Anorganische Chemie": 07 Gesetzmäßigkeiten chemischer Reaktionen
- Freies Lehrbuch "Anorganische Chemie": 08 Radioaktivität
- Freies Lehrbuch "Anorganische Chemie": 09 Hauptgruppen des PSE
- Freies Lehrbuch "Anorganische Chemie": 10 Nebengruppen des PSE und Metalle
- Freies Lehrbuch "Anorganische Chemie": 11 Redoxreaktionen, Metallgewinnung und Energiediagramm
- Freies Lehrbuch "Anorganische Chemie": 12 Redoxreaktionen der großtechnischen und industriellen Chemie
- Freies Lehrbuch "Anorganische Chemie": 13 Chemisches Rechnen
- Freies Lehrbuch "Anorganische Chemie": 14 Ionen, Salze, Fällungsreaktionen und Ionenbindung
- Freies Lehrbuch "Anorganische Chemie": 15 Die Atombindung (Elektronenpaarbindung)
- Freies Lehrbuch "Anorganische Chemie": 16 Säure - Base - Reaktionen (nach dem Donator-Akzeptor-Prinzip)
- Freies Lehrbuch "Anorganische Chemie": 17 Redoxreaktionen als Elektronenübergänge
- Freies Lehrbuch "Anorganische Chemie": 18 Elektrochemie I
- Freies Lehrbuch "Anorganische Chemie": 19 Das Orbitalmodell als Atommodell
- Freies Lehrbuch "Anorganische Chemie": 20 Physikalische Chemie I - Grundlagen der Thermodynamik und des Energieumsatzes
- Freies Lehrbuch "Anorganische Chemie": 22 Das chemische Gleichgewicht
- Freies Lehrbuch "Anorganische Chemie": 23 Löslichkeit von Salzen & das Löslichkeitsprodukt
- Freies Lehrbuch "Anorganische Chemie": 24 Säure-Base-Gleichgewichte
- Freies Lehrbuch "Anorganische Chemie": 25 Elektrochemie II - Transportable Energie: Batterien, Akkus und Knopfzellen
- Freies Lehrbuch "Anorganische Chemie": 27 Analytik und Ionennachweise