Kapitel 03: Erforschung des Verbrennungsvorgangs

Chemische Reaktion?
Nimmt das Gewicht dabei ab oder zu?
Erforschung des Verbrennungsvorgangs: Vereinigung oder Zersetzung?
Die Verbrennung von Brennstoffen ist ein chemischer Vorgang, der für die Menschheit schon immer einer der wichtigsten war. Erst durch die Entdeckung des Feuers konnte sich eine Zivilisation entwickeln. Auf den folgenden Seiten wirst Du viel Neues über das Feuer (welches ja im Altertum noch als Stoff, sogar als Element falsch verstanden wurde) und den Verbrennungsvorgang lernen. Zuerst beschäftigen wir uns mit dem Reaktionstyp bei Verbrennungen und beantworten die Frage, ob eine Verbrennung eine Vereinigung oder eine Zersetzung ist. Dazu schauen wir uns die Masse vor und nach der Reaktion an und ziehen Schlussfolgerungen.
Ist die Verbrennung eine Vereinigung oder eine Zersetzung?
Diese Frage beschäftigte die Naturwissenschaftler sehr lange. Vor allem die Alchemisten bissen sich an dieser im Grunde einfachen Fragestellung lange die Zähne aus.
Sie beobachteten, dass wenn Holz im Kamin verbrennt oder eine Kerze entzündet ist, der Brennstoff mit der Zeit verschwindet. Damit wäre die Verbrennung eine Zersetzung, oder? Holz oder die Kerze zersetzen sich solange in andere Stoffe, bis nichts mehr vom Brennstoff übrig ist.
Bei einer Zersetzung (Analyse) würde sich der Brennstoff in zwei Stoffe spalten, bei der Vereinigung (Synthese) käme ein Stoff hinzu. Letzteres scheint absurd, da eine Kerze bei der Verbrennung ja kleiner wird. Wie kann da etwas hinzukommen?
Würde man also die Masse bei einer Verbrennung untersuchen, so wären drei theoretische Ergebnisse denkbar:
Massenzunahme => Die Verbrennung ist eine Vereinigung
Massenabnahme => Die Verbrennung ist eine Zersetzung
Keine Massenänderung => Die Verbrennung ist keine chemische Reaktion
Um nun genau zu klären, was passiert, müssen wir das ganze experimentell mit einer Waage untersuchen.
V1: Verbrennung von Eisenwolle auf einer Balkenwaage
Stahlwolle wird an eine Balkenwaage gehängt und mit dem Brenner entzündet. Als Alternative kann die Stahlwolle auch mit einer 4,5 V Batterie entzündet werden.
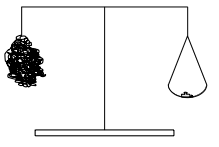
B: Die Seite mit der Eisenwolle wird schwerer. (Zuerst wird die Seite mit der Stahlwolle vielleicht leichter, dann deutlich schwerer.)1
S: Die Verbrennung ist eine Reaktion mit Sauerstoff.
Die Stahlwolle verbrennt dabei mit Sauerstoff
(wissen Schüler in der Regel!) zu Eisenoxid, welches schwerer als Eisen ist.
Antoine de Lavoisier war der Erste, der nachwies, dass bei der Verbrennung Sauerstoff zum Brennstoff hinzukommt. Diese Vereinigung mit Sauerstoff nannte er Oxidation.
Eisen + Sauerstoff ---> Eisenoxid
=> Jede Verbrennung ist eine Vereinigung mit Sauerstoff (=Oxidation). Es bildet sich ein Oxid.
Aber warum wird die Kerze nun beim Verbrennen kleiner?
Ganz einfach, Kerzenwachs besteht auch Kohlenstoff. Das Produkt der Verbrennung ist also Kohlenstoffdioxid, ein Gas, was nicht sichtbar ist und somit dachten die Menschen, es entstünde weniger Masse. Würde man das Kohlenstoffdioxid mit wiegen (z.B. in dem man es mit einem Ballon auffängt), dann würde man auch eine Gewichtszunahme beobachten:
Kohlenstoff + Sauerstoff ---> Kohlenstoffdioxid
Alle Verbrennungen sind Oxidationen, also Vereinigungen mit Sauerstoff. Und wenn man etwas vereinigt (also zusammenfügt), kann die Masse niemals danach geringer sein. Die Masse nimmt bei jeder Verbrennung immer zu!
Ein Video zu diesem Versuch findet ihr in meinem Kanal: https://youtu.be/Ic9Xp241GVg
Aufgaben:
1. Erkläre mit eigenen Worten die Massenänderung bei diesem Versuch
2. Warum wird die Kerze bei der Verbrennung leichter?
3. Die Feuerwehr ist immer daran interessiert, wie man am Besten ein Feuer löschen kann. Vergleiche die Löschwirkung von Wasser und CO2 - Schaum?
4. Wie würde die Feuerwehr ein brennendes Holzfeuer, wie ein Benzinfeuer löschen?
Erforschung des Verbrennungsvorgangs: Ist Luft ein Element?
Der Sauerstoff für die Verbrennung kommt aus der Umgebungsluft. Luft wurde im Altertum als Element bezeichnet. Nachdem Du schon weißt, dass Feuer kein Element ist (und Wasser auch nicht - siehe Wasserzersetzung), wäre die Frage, ob Luft ein Element ist noch offen…
V: Spiritus wird unter einer Glasglocke entzündet.

|
Beobachtung |
Schlussfolgerung |
|
Wasserpegel sinkt und manchmal entweicht Luft beim Reaktionsstart |
=> Durch die Hitze der Flamme wird die Luft erwärmt. Sie dehnt sich aus |
|
Die Flamme erlischt |
=> Spiritus verbrennt mit Sauerstoff. Wenn der ganze Sauerstoff reagiert hat, erlischt die Flamme |
|
Das Wasser steigt ca. 20% |
=> Sauerstoff hat reagiert. Nun fehlt er unter der Glasglocke. Durch den „fehlende“ Sauerstoff wird Platz frei, der durch Wasser von unten „aufgefüllt“ wird. (bzw.: der entstehende Unterdruck saugt Wasser in die Glocke). Da das Wasser um 20% steigt, kann man vermuten, dass Luft ca. 20% Sauerstoff enthält. |
Dieser Versuch zeigt mit sehr einfachen Mitteln, dass ca. 20% der Luft Sauerstoff sind.
Wenn also ein Stoff, wie hier Spiritus, verbrennt, dann benötigt er für diese Oxidation (= Vereinigung mit Sauerstoff) den Luftsauerstoff.
Die Verbrennung geht also so lange, wie Sauerstoff vorhanden ist. Der Platz, der vorher im Gefäß für Sauerstoff vorhanden war, ist nun frei, sodass Wasser eindringen kann.
Aber Moment mal, die Flamme geht aus und das Wasser steigt erst danach, oder (genau hinsehen!)? Richtig, das liegt daran, dass bei der Verbrennung sofort Kohlenstoffdioxid entsteht. Nach sehr kurzer Zeit, löst sich dieses aber in dem Wasser und reagiert dann mit Wasser weiter zu Kohlensäure.
Wasser + Kohlenstoffdioxid ---> Kohlensäure
Kohlenstoffdioxid belegt also im Gefäß über dem Wasser keinen Platz, sodass dort tatsächlich ein Unterdruck entsteht, sodass Wasser nachlaufen kann. Warum steigt das Wasser nicht bis oben? Die 80% Stickstoff reagieren nicht bei der Verbrennung, sie bleiben einfach als Gas im Gefäß. Sie belegen dieses Volumen, sodass Wasser nicht soweit eindringen kann - es ist schlicht kein Platz vorhanden.
Die Zusammensetzung der Luft
|
In Luft sind enthalten: |
Volumenprozent |
Siedepunkt |
|
Sauerstoff |
20,95% |
-183 °C |
|
Stickstoff |
78,1% |
-196 °C |
|
Edelgase |
0,93% |
< -190 °C |
|
Kohlenstoffdioxid |
0,04% |
-78 °C |
|
+ Restgase |
Rund 1/5 der Luft besteht aus Sauerstoff.
Nur dieser kann sich mit brennbaren Stoffen bei einer Verbrennung vereinigen.
Die Vereinigung eines Stoffes mit Sauerstoff nennt man Oxidation.
Die Verbindungen der Elemente mit Sauerstoff nennt man Oxide.
Das Video zu diesem Versuch findet ihr in meinem Kanal: https://youtu.be/S6XGEsMkkTc
Aufgaben:
1.a) In einem Becherglas mit Wasser gefüllt, steht ein Reagenzglas mit der Öffnung nach
unten. Es enthält Eisenwolle, die mit Wasser getränkt ist. (siehe Zeichnung). Lässt
man den Versuch zwei Tage stehen, steigt das Wasser im Reagenzglas an. Erkläre.
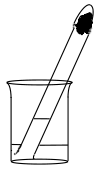
b) Um wie viel Prozent kann das Wasser nur steigen? Warum?
2. Kommt man bei Wiederholung des Versuches zum gleichen Ergebnis?
3. Warum kannst Du ausschließen, dass Luft ein Element ist?
Luft - ein Gasgemisch
Gewinnung durch
durch Zersetzen von sauerstoffhaltigen Verbindungen
(Bsp. Kaliumnitrat, Quecksilberoxid)
durch Destillation von flüssiger Luft
Luftverflüssigung
In einem mehrstufigen Prozess (Linde-Verfahren) wird Luft schrittweise bis zur Verflüssigung abgekühlt:
Kompression (Luft erwärmt sich)
Kühlung
Gegenstromkühler
Expansion (Abkühlung der Luft)
Destillation flüssiger Luft
Flüssige Luft kann durch Destillation in ihre Bestandteile aufgetrennt werden.
Gewinnung von Sauerstoff im Labor:
V: Erhitzen von Kaliumnitrat im Reagenzglas, Glimmspan
B: Weißer, kristalliner Feststoff schmilzt, Gasblasen steigen auf, Glimmspan leuchtet auf
Informationen zum Sauerstoff:
Lies den Text, markiere anschließend 15 Schlüsselwörter und bereite einen Vortrag vor:
Sauerstoff war durch seine Wichtigkeit bei der Verbrennung den Menschen schon früh als Element bekannt. Im Mittelalter wurde er auch Oxygenium genannt (von griech. oxýs „scharf, spitz, sauer“ und genese „erzeugen“). Der Name entstand, weil man damals glaubte, dass Sauerstoff zur Bildung von Säuren nötig ist.
Das Element wird heute mit dem Symbol O abgekürzt. In der Luft kommt er als Verbindung aus zwei Sauerstoff-Atomen O2 vor.
Vorkommen: Sauerstoff ist auf unserem Planeten 49,4 Massenprozent das häufigste Element! Im Universum ist er vermutlich das dritthäufigste Element. Sauerstoff kommt elementar als O2 und in Verbindungen, z.B. Wasser (H2O) vor.
Atomarer Sauerstoff, also einzelne Sauerstoffatome kommen nicht vor.
Ozon hat die Formel O3 und ist wenig stabil. Man findet es vor allem in der Atmosphäre als Ozonschicht. Die Ozonschicht filtert gefährliche ultraviolette Strahlung aus dem Licht der Sonne.
Verbindungen in denen Sauerstoff vorkommt: Wasser, Kohlendioxid, Siliziumdioxid. Viele Säuren, viele Salze, Säurereste, Zucker, Silikate uvm.
Eigenschaften von Sauerstoff:
- Als Gas ist Sauerstoff ein farb-, geruch- und geschmacklos.
- Sauerstoff ist das häufigste Element auf der Erde.
- Es ist bei Raumtemperatur ein farb- und geruchloses Gas
- Es hat die chemische Formel O2 (d.h. ein Sauerstoffatom ist mit einem anderen vereinigt)
- Siedepunkt: -182.9°C (Sauerstoff ist als Flüssigkeit hellblau)
- Schmelzpunkt: -218.4°C (Sauerstoff ist als Feststoff eine hellblaue kristalline Masse)
- Bei 0°C hat Sauerstoff (1,43 g/l) hat eine größere Dichte als Luft (1,29 g/l bei 0°C)
- Auch Gase lösen sich in Wasser (nicht nur Zucker und Salz). Bei 20°C lösen sich in einem Liter Wasser 31,1 ml O2 - So können auch Lebewesen, die unter Wasser leben atmen.
- Sauerstoff wurde 1774 unabhängig voneinander durch Joseph Priestley und Carl Wilhelm Scheele entdeckt.
- Ozon ist eine reaktivere und giftige „Form“ des Sauerstoffs (O3).
Reaktionen: Sauerstoff reagiert leicht mit unedlen Metallen (Oxidation), so dass es viele Metall-Sauerstoffverbindungen gibt. Diese werden auch Metalloxide genannt.
Alle grünen Pflanzen des Planeten setzten dauerhaft Sauerstoff durch Photosynthese frei.
Verbrennungen benötigen Sauerstoff:
Bis zum Mittelalter galt Feuer als ein unerklärliches Phänomen. Im Mittelalter untersuchten die ersten Wissenschaftler, mit den Methoden der Alchemie Feuer und die Verbrennung. Es galt für viele Jahrhunderte, das Feuer durch einen Stoff entsteht, der „Phlogiston“ genannt wird. Dieses „Phlogiston“ würde bei der Verbrennung entweichen. Man stelle sich die Verbrennung also als Zersetzung vor:
Brennstoff ----> Phlogiston und das Verbrennungsprodukt.
Sauerstoff spielte bei diesen Überlegungen keine Rolle, was vor allem daran lag, dass er noch nicht entdeckt war. Erst als 1772 der schwedische Apotheker Carl Wilhelm Scheele Sauerstoff als farbloses Gas entdeckte, kamen erste Zweifel an der Phlogistontheorie auf.
Der pariser Forscher Antoine Lavoisier (26.8.1743 - 8.5.1794) klärte dann endgültig, dass die Verbrennung eine Vereinigung mit Sauerstoff, also eine Oxidation ist.
Brennstoff + Sauerstoff ----> Verbrennungsprodukt.
Lavoisier konnte mit einer Waage leicht zeigen, dass ein Stoff beim Brennen schwerer wird, wenn das Verbrennungsprodukt nicht gasförmig (wie z.B. bei einer Kerze!) ist. Ursache ist die Vereinigung von Brennstoff und Sauerstoff.
Der Sauerstoff
Im Labor kann man Sauerstoff leicht aus Nitraten herstellen. Diese sind auch in vielen Sprengstoffen enthalten. Aber Achtung! Führe diese Versuche nicht außerhalb der Schule durch - Nitrate sind unberechenbar. Selbst mit viel Erfahrung ist der Umgang damit sehr gefährlich!
V: Erhitzen von Kaliumnitrat. In das Reagenzglas werden dann die folgenden Stoffe zugefügt:
a) Glimmspan
b) Holzkohle
c) Schwefel

B: - Das Salz Kaliumnitrat (weißer kristalliner Feststoff) schmilzt
- Gasblasen steigen auf
- weißer Rückstand
zu a) Glimmspanprobe positiv
zu b) Holzkohle glüht auf
zu c) Schwefel verbrennt mit hellblauer Flamme
S: Kaliumnitrat wird zersetzt in Sauerstoff und Kaliumnitrit. Der Sauerstoff ermöglicht erst die Verbrennung des Kohlenstoffes im Holz. Er ist somit für die Oxidation verantwortlich. Da das Kaliumnitrat den Sauerstoff bereitstellt, wird es als Oxidationsmittel bezeichnet
Kaliumnitrat + E Sauerstoff + Kaliumnitrit
Holzkohle + Sauerstoff Kohlenstoffdioxid + E
Schwefel + Sauerstoff Schwefeloxid + E
Sauerstoff ist unverzichtbar als Partner für jede Verbrennung. Er oxidiert dabei seinen Reaktionspartner und wird deshalb auch Oxidationsmittel genannt.
Was ist die Glimmspanprobe?
Vielleicht erinnerst Du Dich an die Glimmspanprobe im Biologieunterricht. Mit ihr kann gezeigt werden, dass Pflanzen Sauerstoff herstellen. Die Glimmspanprobe ist also ein Sauerstoffnachweis, der uns zeigt, ob irgendwo Sauerstoff enthalten ist (schließlich kann man ihn nicht sehen!).
Dazu wird ein glühender (glimmender) Holzspan in den zu untersuchenden Gegenstand gehalten. Flammt der Holzspan auf, war Sauerstoff enthalten.
Was brennt bei der Kerze?
Kerzen waren lange Zeit wichtige Begleiter des Menschen, vor allem als Licht- und Wärmequelle. Heute zündet man sie meisten wegen der angenehmen Lichtfarbe und der damit verbundenen positiven Stimmung an - vor allem in der Kirche, zu Hause oder bei Festen.
Allerdings stellt sich eine wichtige Frage:
Was brennt da eigentlich? Du wirst Dich wundern, wie kompliziert die Antwort ist.
Führe doch mal in Gegenwart Deiner Eltern folgenden Versuch durch:
Nimm eine brennende Kerze, lösche diese und nähere dich sofort von oben mit einem brennenden Streichholz.
=> Entzündung trotz Distanz
Was folgt aus diesem Versuch? Was brennt nun eigentlich? Ist es der Docht?
Hypothese:
Kerzenwachs + Sauerstoff --> „brennbares Gas“ + Kohlendioxid + Energie
Erklärung:
Der Docht ist ein sehr saugfähiger Faden, z.B. aus Baumwolle. Durch die Hitze der Kerzenflamme schmilzt Wachs, welches durch den Docht nach oben gesaugt wird und im Doch dann verdampft. Das verdampfende Gas ist der eigentliche Brennstoff.
Wachstypen:
- früher wurde vor allem Bienenwachs verwendet. Sein Schmelzpunkt liegt recht hoch, bei ca. 65°C
- heute verwendet man entweder Stearin (aus tierischen oder pflanzlichen Fetten gewonnen - Schmelzpunkt 56°C oder Paraffin (Teelichter) - Schmelzpunkt um 55 °C.
Nach Anzünden des Dochts schmilzt das Wachs. Durch die Sogwirkung des Dochts wird ständig neues (geschmolzenes) Wachs in die Flamme transportiert, wo es verdampft und verbrennt.
=> gasförmiges Kerzenwachs verbrennt.
Zusatzinformationen:
- Pro Stunde verbrennt eine Kerze ca. 3 - 8g Wachs und erzeugt eine Heizleistung von ca. 50W.
- Das Aufsteigen des Verbrennungsproduktes Kohlenstoffdioxid sorgt für einen Luftstrom, der unten wieder Sauerstoff ansaugt (vergleichbar mit einem Kamin). Dies wird auch Konvektion genannt.
- Dadurch erhält die Kerzenflamme ihre typische langgestreckte Form.
- Wenn eine Kerzenflamme stark rußt, dann ist meist der Doch zu lang. Bei vielen Kerzen verglüht aber die Wird der Docht zu lang, beginnt die Kerze zu rußen. Ursache ist ein durch den Doch relativ großer Anteil an verbrennendem Gas (weil die Oberfläche so groß ist) und im Vergleich zu wenig Sauerstoff. Man kann also sagen, dass Ruß (= unverbrannte Kohlenstoffteilchen) bei solchen unvollständigen Verbrennungen entsteht.
- Im Auto sorgt der Vergaser für ein gutes Luft/Brennstoff-Gemisch, so dass das die im Benzin enthaltene Energiemenge durch vollständige Verbrennung gut ausgenutzt wird.
https://de.wikipedia.org/wiki/Kerze
1 Selbst wenn bei Verbrennen der Stahlwolle, etwas Eisenoxid durch die heftige Reaktion von der Waage fällt, reicht die Menge an Verbleibendem i.d.R. aus, um den Effekt zu zeigen.
Erforschung des Verbrennungsvorgangs II: Übung - Die Produkte der Verbrennung I
Nachdem wir uns nun mit den Bedingungen, Ausgangsstoffen und dem Vorgang der Verbrennung beschäftigt haben, wollen wir uns nun die Produkte näher ansehen. Damit wir diese besser untersuchen können, müssen wir uns in einem Vorversuch eine Nachweissubstanz (das sogenannte „Kalkwasser“) herstellen.
a) Herstellung von Kalkwasser (CO2 - Nachweis mit Kalkwasser)
V: Calciumoxid wird mit Wasser gemischt und durch Filtrieren gereinigt. Dabei entsteht Kalkwasser, welches zum Nachweis von Kohlenstoffdioxid dient. Um zu testen, dass es gut funktioniert, wird in einen kleinen Teil des Kalkwassers hinein geblasen.
|
B: |
S: |
|
Es entsteht eine milchige Lösung |
=> Ein Feststoff entsteht, der sich nicht richtig auflöst |
|
Nach dem Filtrieren entsteht eine klare Lösung |
=> Der Feststoff bleibt im Filter, das im Wasser bereits gelöste Calciumoxid läuft hindurch, da gelöste Stoffe viel kleiner sind und durch die Poren des Filters passen. |
|
Beim Hineinblasen trübt sich die klare Lösung. |
=> Durch die Zugabe von Kohlenstoffdioxid trübt sich Kalkwasser. Es muss also ein neuer Stoff entstanden sein, welcher in Wasser unlöslich ist. Dieser Stoff ist Kalk, der als Feststoff ausfällt und auch für die Trübung sorgt. |
Kalkwasser + Kohlenstoffdioxid --> Kalk + Wasser + E
Wasserklares Kalkwasser ist ein Nachweismittel für Kohlenstoffdioxid.
Bei Kontakt mit diesem wird es durch Kalkbildung milchig trüb.
b) Nachweis von CO2 als Verbrennungsprodukt
V: Nun kommen wir zum eigentlichen Versuch. Wir untersuchen die Gase, die bei der Verbrennung von Kerzenwachs entstehen. Das Hauptproblem musst Du allerdings noch selbst lösen: wie kann man Verbrennungsprodukte auffangen, um sie nachweisen? Entwickle eigene Ideen, wie man die Gase einer Kerze auffangen kann. Hast Du eine Möglichkeit gefunden, so füge den Gasen Kalkwasser zu.
B: Das Kalkwasser trübt sich.
S: Kalkwasser ist in Wasser gelöstes Calciumoxid. Man nennt es auch Calciumhydroxid.
Bei der Verbrennung von Wachs entsteht Kohlenstoffdioxid. Kohlenstoffdioxid trübt Kalkwasser. Im Kalkwasser entsteht Kalk, welcher (nahezu) wasserunlöslich ist. Immer wenn sich ein Feststoff in Wasser nicht löst, kommt es zu einer Trübung.
Kalkwasser dient somit als Nachweis für Kohlenstoffdioxid (was man ja sonst nicht sehen kann!).
Ein Verbrennungsprodukt der Kerze (und allen anderen Kohlenstoffverbindungen auch)
ist Kohlenstoffdioxid [CO2].
Unterscheide die unterschiedlichen Calciumverbindungen:
CaO Ca(OH)2 CaCO3 CaSO4
Calciumoxid Calciumhydroxid Calciumcarbonat Gips, Kreide
(=Kalk, = Marmor)
Lies den Text und markiere anschließend 15 Schlüsselwörter und bereite einen Vortrag vor
Kohlenstoffmonoxid ist giftig
Allgemeine Informationen zu Kohlenstoffmonoxid
Kohlenstoffmonoxid ist bei Raumtemperatur ein farb- und geruchloses Gas. Für alle atmenden Lebewesen ist es sehr giftig. Bereits kleinste Mengen sind tödlich! Im Vergleich zu Kohlenstoffdioxid (CO2) fehlt dem Kohlenstoffmonoxid ein Sauerstoffatom (CO).
Zum Glück entsteht es in der Natur nur sehr selten. Aber bei Schwelbränden, wo zu wenig Sauerstoff für eine korrekte Verbrennung vorhanden ist, kann es entstehen. Diese unvollständige Verbrennung nennt man auch unvollständigen Oxidation.
Wenn zu wenig Sauerstoff bei der Verbrennung vorhanden ist,
kann Kohlenstoffmonooxid (=CO) entstehen.
Kohlenstoffdioxid und Sauerstoff binden sich von selbst an unsere roten Blutkörperchen. Dies geht sehr schnell und ist ein natürlicher Vorgang. Normalerweise werden so Sauerstoff und Kohlenstoffdioxid im Körper transportiert. Die roten Blutkörperchen sind also so etwas wie Taxi, die verschiedene Fahrgäste befördern.
Kohlenstoffmonoxid bindet ebenfalls an die roten Blutkörperchen, allerdings bindet es 200 bis 300 mal stärker an die roten Blutkörperchen, so dass diese die beiden anderen Gase nicht mehr transportieren können. Das wäre vergleichbar mit einem Fahrgast, der einfach nicht aus dem Taxi aussteigen möchte.
Die roten Blutkörperchen können so keine Gase mehr transportieren und so entsteht ein großer Sauerstoffmangel. Bei größeren Mengen an eingeatmeten Kohlenstoffmonoxid erstickt man, obwohl eigentlich genug Sauerstoff im Raum wäre.
Kohlenstoffmonoxid ist ab einem Gehalt von 0,3 Volumenprozent in der Luft sehr giftig. Ab 1,0 Prozent Kohlenstoffmonoxidgehalt wird man schnell ohnmächtig. Auf diese Bewusstlosigkeit folgt innerhalb von etwa fünf Minuten der Tod durch Ersticken.
Schon geringste Mengen blockieren unsere roten Blutkörperchen, welche dann keinen Sauerstoff mehr transportieren können. Die Folge ist, dass man ohnmächtig wird, wenn man es einatmet und dann erstickt.
Rettung bei Kohlenstoffmonoxid-Vergiftung
Bei einer Kohlenstoffmonoxid-Vergiftung kann, solange der Patient bewusstlos ist und noch lebt versucht werden mit reinem Sauerstoff beatmet zu werden. Durch dieses „Überangebot“ an Sauerstoff wird das giftige Gas von den roten Blutkörperchen verdrängt.
Reaktionen mit Kohlenstoffmonoxid:
Wird das Gas Kohlenstoffmonoxid entzündet, reagiert es explosionsartig. Es ist also brennbar.
Kohlenstoffmonoxid kann bei Verbrennungen als Nebenprodukt zu Kohlenstoffdioxid entstehen.
Wegen seiner Giftigkeit werden sonst kaum Versuche und Experimente mit dem Gas durchgeführt.
Zusatzinformationen:
https://de.wikipedia.org/wiki/Kohlenstoffmonoxid
Verbrennen von Nicht-Metallen (in reinem Sauerstoff)
V: Der Lehrer zeigt Dir einige besondere Versuche. Er verbrennt Schwefel, Phosphor und Kohlenstoff (für Kohlenstoff nimmt man kohlenstoffhaltige Verbindungen wie z.B.: eine Kerze, eine Zigarette, ein Holzspan, Papier usw...) in reinem Sauerstoff:
Kohlenstoff + Sauerstoff --> Kohlenstoffoxid + Energie
Schwefel + Sauerstoff --> Schwefeloxid + Energie
Phosphor+ Sauerstoff --> Phosphoroxid + Energie
Verbrennungen sind Oxidationen:
Bei der Verbrennung von Nichtmetallen entstehen Nichtmetalloxide.
Sie bilden sich durch die Vereinigung von Nichtmetall mit Sauerstoff
Wdh.: Die Vereinigung eines Stoffes mit Sauerstoff wird Oxidation genannt.
Kohlenstoffdioxid1 ist nicht das einzig mögliche Produkt. Ist für die Verbrennung von Kohlenstoff nicht genügend Sauerstoff vorhanden, so entsteht auch das giftige Kohlenmonoxid.
Ein Video zur Schwefelverbrennung findet ihr in meinem Kanal bei Youtube: https://youtu.be/2HVLvN_WsPs
Aufgaben:
- Bestimme den Faktor, um welchen Stoffe in reinem Sauerstoff schneller als in Luft verbrennen.
- Erkläre den Begriff Nichtmetalloxid.
- Ordne den drei Aggregatzuständen Dir bekannte Nichtmetalloxide zu.
- Informiere Dich über den Stoff Kohlenmonoxid und seine Gefahren
- Nenne Grunde, warum Kohlenmonoxid so gefährlich ist.
Verbrennen von Metallen
Nachdem wir uns mit den Nichtmetallen und ihren Oxiden beschäftigt haben, steht noch die Frage offen, was mit den Metallen passiert, denn das Verbrennen von Metallen entspricht ja meistens nicht den Alltagserfahrungen!
Zur Demonstration verbrennt der Lehrer Eisen, Aluminium und Magnesium in reinem Sauerstoff. Du wirst schöne, vielleicht sogar Dir bekannt Effekte beobachten können.
Eisen + Sauerstoff --> Eisenoxid + Energie
Aluminium + Sauerstoff --> Aluminiumoxid + Energie
Magnesium + Sauerstoff --> Magnesiumoxid + Energie
Bei der Verbrennung von Metallen entstehen Metalloxide.
Sie bilden sich durch die Vereinigung von Metall mit Sauerstoff
Aufgaben:
- Erkläre den Begriff „Metalloxid“ mit Deinen eigene Worten.
- Lese im Buch oder im Internet über die Verwendung von Metalloxide nach (achte dabei besonders auf die Verwendung zum Färben von Keramik und Ton usw.).
- Informiere Dich dann über die negativen Seiten von Metalloxiden. Ein gutes Stichwort für Deine Suche ist „Korrosion“ oder auch „Rost“.
Verzweifle aber nicht an der Schwierigkeit! Korrosion ist ein komplexes Thema. Viele der chemischen Reaktionen sind noch zu schwer für Deinen momentanen Wissensstand.
- https://de.wikipedia.org/wiki/Rost_%28Korrosion%29
- https://de.wikipedia.org/wiki/Korrosion_%28Chemie%29
- https://de.wikipedia.org/wiki/Korrosionsschutz
Die Entzündungstemperatur
Bei Verbrennungen reagieren Sauerstoff und Brennstoff erst miteinander, wenn die „Bedingungen“ günstig sind. Zu diesen Bedingungen gehört unter anderem eine bestimmte Temperatur. Ist es zu kalt, kann die Verbrennung nicht starten. Das ist schon daraus leicht verständlich, da ein Feuer beim Löschen ausgeht, wenn man Wasser darüber gießt (Wasser kühlt den Brennstoff ab).
V: In einem Porzellantiegel wird eine kleine Menge Kerzenwachs mit dem Bunsenbrenner solange erhitzt, bis eine Selbstentzündung stattfindet.
B: Zuerst bildet sich Wachsdampf, der immer dunkler sowie dichter wird und der sich dann schließlich von selbst entzündet. Selbst nach dem Löschen durch Ersticken, entzündet sich alles von selbst wieder.
S: Auch ohne das das heiße Wachs mit einer Flamme in Berührung kommt, entzündet es sich bei ca. 250°C. Dazu ist nicht unbedingt ein Funken nötig. Das Löschen von solchen Feuern ist sehr schwierig, da sie sich jederzeit wieder von selbst entzünden können.
Die Entzündungstemperatur (auch Zündtemperatur) ist die Temperatur eines Stoffes,
bei der er sich ohne Fremdeinwirkung von selbst entzündet.
An einer offenen Flamme ist die Entzündungstemperatur immer vorhanden, aber auch durch Funken oder heiße Gegenstände kann eine Zündung ausgelöst werden.
Wichtig: Flüssige Brennstoffe, die sehr leicht Gase oder Dämpfe bilden, entzünden sich viel schneller als feste Brennstoffe. Sie sind deshalb feuergefährlich (z.B. Benzin).
=> Wenn die Brennstoffe schon gasförmig sind, genügt oft ein Funke, um sie zu entzünden.
Entzündungstemperaturen
Hier einige Beispiele für Temperaturen, bei denen sich Stoffe von selbst entzünden:
-
Brennstoff
Entzündungs-
temperatur [°C]
Brennstoff
Entzündungs-
temperatur [°C]
Phosphor weiß
60
Fichtenholz
280
Streichholzkopf
ca. 60
Fett
300
Zündholzkopf
80
Holzkohle
300
Holzkohle
150 - 220
Phosphor rot
300
Ether
170
trockenes Holz
ca. 300
Zeitungspapier
175
Petroleum
300
Stearin
196
Kork
300-320
Kunststoffe
200 - 300
Steinkohle
350 - 600
Benzin
220 - 300
Schreibpapier
360
Terpentin
220
Butan (Flüssiggas für Feuerzeuge)
400
Torf
230
Asphalt
ca. 400
Schwefel
250
Glycerin
400
Paraffin (=Kerzenwachs)
250
Zucker
410
Benzin (Auto)
ca. 250 - 460
Spiritus
425
Dieselöl
250 - 350
Ethanol
425
Heizöl
250
Baumwolle
450
Papier
ca. 250
Methanol
455
Kohle
240-280
Propangas
460
Stroh
250-300
Essig (-säure)
460
Getreide
250-320
Roggenmehl
500
Heu
260-310
Schmieröl
500
Benzin
250
Methan (=Erdgas)
ca. 600
Weizenstaub
270
Aceton
600
Holz
280-340
Teer
600
Zusatzinformationen:
https://de.wikipedia.org/wiki/Zündtemperatur
Der Verbennungstetradeder

Ein Unfall im Haushalt: Die brennende Bratpfanne
Beim längeren Braten oder Frittieren kann sich Öl entzünden. Obwohl ein solcher Brand ein großer Schreck ist, wird innerhalb der nächsten 1-2- Minuten nicht viel passieren, da meistens das Holz der Küche eine größere Entfernung hat und sich nicht so schnell entzündet.
Leider reagieren viele Menschen trotzdem sehr panisch und neigen dazu Fehler zu begehen, die erst so richtig eine Katastrophe auslösen!
Der häufigste Fehler ist das Löschen eines Ölbrandes mit Wasser. Das Wasser gelangt in das heiße Öl und wird sofort gasförmig. Dabei vergrößert sich das Gasvolumen um das Tausendfache. 1l Wasser bildet schon bei 100 Grad C mehr als 1000 l Gas. Bei 300 °C, die in der Fritteuse vorliegen entsteht noch wesentlich mehr Gas!
Das Gas verlässt unter hohem Druck die Fritteuse und reizt kleine, feine brennende Öltröpfchen mit sich. So entsteht ein mehrere Meter großer Feuerball.
Aufgaben:
1. Nenne Möglichkeiten, eine brennende Bratpfanne zu löschen.
2. Nenne weitere Möglichkeiten Brände zu löschen und nenne dazu entsprechend auch jeweils einen Brandstoff
3. Wie kann man sich im Haushalt noch schützen und wie kann man Brände vermeiden und Branden vorbeugen?
Versuche zur Entzündungstemperatur
Du kannst im Unterricht die Erstaunlichkeit der Entzündungstemperatur leicht überprüfen:
V: Falte ein kleines Blatt als Trichter und durchstoße es mit einer oder zwei langen Metallnadeln im oberen Viertel. Fülle den Trichter bis 1cm vor die Einstichstellen mit Wasser und stelle darunter eine brennende Kerze.
Was passiert wohl? Wie die meisten Schüler, vermutest Du vielleicht auch, dass hier eine Entzündung des Papiers und dem anschließenden Auslaufen des Wassers stattfinden wird, was die Kerze durch das Wasser dann löschen würde.
Aber, wie heiß kann Papier denn nur werden, wenn sich darin Wasser befindet? Bedenke, das flüssiges Wasser nicht heißer als 100°C werden kann! Reicht diese Temperatur aus, um die Entzündungstemperatur des Papiers zu überschreiten.
B: Das Papier wird schwarz, das Wasser wird warm und beginnt eventuell zu kochen.
S: Papier hat Entzündungstemperatur von 250°C. Solange also flüssiges Wasser in dem Papiertrichter ist, kann dessen Temperatur nicht größer als 100°C sein! Deshalb kann das Papier sich nicht entzünden, da es vom Wasser gekühlt wird.
Stoffe, die ihre eigene Temperatur unterhalb der Entzündungstemperatur haben,
können nicht entzündet werden.
Merke: Für eine Verbrennung werden also immer 3 Dinge benötigt2:
- Ein brennbarer Stoff, z. B. Papier, Holz, Kohle, Benzin, Spiritus, Heizöl, Erdgas.
- Sauerstoff
- Entzündungstemperatur.
Aufgaben:
- Bei einem Waldbrand fliegen mit Wasser beladene Hubschrauber über das Feuer und werfen das Wasser ab. Erkläre den Nutzen dieser Methode. Was ist dabei vor allem im Sommer zu beachten?
- Warum kann ein Wald, der auf solche Art gelöscht wurde, jederzeit wieder anfangen zu brennen?
- Welche Rolle spielt eigentlich Wind beim Wiederentfachen eines Waldbrandes?
- Welchem Einfluss hat die Form eines Holzstücks auf seine Entzündung am Lagerfeuer? (Vergleiche dazu die Entzündbarkeit eines Asts und eines Baumstamms).
Der Flammpunkt
V: Eine Porzellanschale wird ca. einen 1cm mit Spiritus gefüllt. Eine weitere Porzellanschale wird gleichzeitig mit Heizöl gefüllt. Von oben wird sich beiden Schalen nun mit einem Holzspan genähert.
B: Während sich Spiritus recht schnell durch die Luft entzünden lässt, brennt Heizöl bei Kontakt mit der Flamme.
S: Spiritus ist eine Substanz, mit einem Siedepunkt von 78°C. Bei Heizöl liegt der Siedepunkt über 250°C. Das bedeutet, dass bei Raumtemperatur schon deutlich mehr Spiritusteilchen als Heizölteilchen verdunsten und in die Gasphase übergehen, da sich diese viel näher an ihrem Siedepunkt befinden. Diese Gasteilchen können viel leichter entzündet werden.
=> Spiritus verdampft bei Raumtemperatur leichter und schneller. Heizöl hingegen verdunstet bei Raumtemperatur nur sehr langsam. Folglich wird sich über der Heizölporzellanschale nur sehr wenig Gas befinden und es nicht zu einer schnellen Entzündung kommen. Erst wenn das Heizöl wärmer wird, entsteht mehr Gas. Dann ist eine Entzündung möglich.
Aufgaben:
1. Benzin lässt sich wesentlich leichter entzünden als Diesel. Von offenen Benzinkanistern geht beispielsweise eine sehr große Gefahr aus, wenn Funken in der Nähe sind. Treffe einen Rückschluss auf die Siedepunkte der beiden Flüssigkeiten.
2. Zum Tanken an Tankstellen werden an den Dieselzapfsäulen Handschuhe bereitgehalten, da im Falle des Verkleckerns, der Diesel noch stundenlang an den Händen unangenehm riecht. Bei Benzin ist der Geruch nach wenigen Minuten verschwunden. Nenne Ursachen.
3. Diesel hat einen Siedepunkt, der dem des Heizöls sehr ähnlich ist. Im Winter springen dieselgetriebene Fahrzeuge nur dann an, wenn der Brennstoff im Motor erwärmt wird. Dies geschieht bereits automatisch, wenn der Fahrer den Schlüssel ins Zündschloss steckt. Nenne den Grund, warum das notwendig ist.
1 zur Erklärung di = zwei/ mono = eins
2 Später wirst Du lernen, dass auch der so genannte Zerteilungsgrad eine Rolle spielt.
Verschiedene Formen der Oxidation
Du weißt nun schon sehr vieles über Verbrennungen. Zum Beispiel weißt Du, dass es immer Oxidationen sind. Es gibt aber drei verschiedene Arten von Oxidationen. Die Stille Oxidation, die Verbrennung und die explosionsartige Oxidationen. Hier lernst Du sozusagen die „Geschwister“ der Verbrennung kennen.
1. Stille Oxidation (langsame Oxidation)
V: Eisenwolle befeuchten und in ein Reagenzglas stecken,
es auf den Kopf in ein Wasserglas stellen

B: - Wasser steigt im Reagenzglas nach oben
- Eisenwolle verfärbt sich rotbraun
- Glimmspan erlischt im Restgas
S: Es hat sich offensichtlich Rost gebildet. Der korrekte Ausdruck dafür ist Eisenoxid. Es fand also eine Oxidation statt, ohne dass eine Flamme zu sehen war.
Sauerstoff + Eisen ---> Eisenoxid + E (=Rostvorgang)
Langsam verlaufende Reaktionen mit Sauerstoff nennt man stille Oxidationen.
Weitere Beispiele für stille Oxidationen:
- Rosten
- matt werden von Kupfer
- Anlaufen von Silber
- Matt werden von Aluminiumfolie
- Zellatmung der Menschen
Zusatzinformationen:
Durch die stille Oxidation von Eisen (= Rosten, =Korrosion) entstehen dem Staat jährlich Schäden von mehr als 50 Milliarden Euro. Der Hauptteil des Schadens entsteht durch rostende Autos, Brücken, Leitplanken und Bauwerke wie Brücken und Gebäuden.
Man kann Eisen aber veredeln, so dass es nicht mehr so stark korrodiert. Durch Zusätze von anderen Metallen, wie Nickel und Entzug von Kohlenstoffresten, die sich bei der Herstellung eingeschlichen haben, wird die Qualität viel besser. Eisen, welches so bearbeitet wurde nennt man Stahl. (Siehe auch: https://de.wikipedia.org/wiki/Stahl)
2. Verbrennung (mittelschnelle Oxidation)
Da Du Verbrennungen nun schon gut kennst, kommt hier nur noch eine kleine Zusammenfassung:
Die Verbrennung ist eine unter Licht und Wärmeentwicklung rasch ablaufende Oxidation.
Das Leuchten wird durch glühenden Feststoff hervorgerufen.
Im Unterricht hast Du schon z.B. Phosphor, Kerzenwachs, Holz, Papier, Schwefel und Metalle verbrannt. (siehe auch: https://de.wikipedia.org/wiki/Verbrennung_%28Chemie%29)
3. Explosionsartige Oxidationen (sehr schnelle Oxidation)
Explosionen kennst Du von Silvester. Sie ist eine Reaktion, die durch die Zündung fein verteilter Brennstoffe zustande kommt. Die Folge ist eine sehr schnelle, plötzlich verlaufende Kraftentfaltung, die auf dem Ausdehnungsbestreben von plötzlich erhitzten Gasen und Dämpfen beruht.
V: Der Lehrer zeigt Dir die Entzündung von Bärlappsporen.
|
B |
S |
|
Explosion mit Stichflamme |
Die Bärlappsporen werden von der Kerzenflamme entzündet. Sie oxidieren explosionsartig. |
Die Oberflächenvergrößerung führt zu einer größeren Zahl an reaktionsbereiten Teilchen.
Die Reaktionsgeschwindigkeit kann dabei so groß werden, dass es zur Explosion kommt.
Zusammenfassung Oxidationsarten:
Du kennst nun drei Arten von Oxidationen:
- die langsame stille Oxidation
- die mittelschnelle Verbrennung
- die sehr schnelle Explosion
Aufgaben:
- Denk Dir ein Verfahren aus, wie man stille Oxidationen beobachten und nachweislich dokumentieren kann.
- Begründe, warum Explosionen im Chemieunterricht als sehr gefährlich betrachtet werden und warum alle explosiven Stoffe Warn- und Sicherheitsschilder tragen müssen.
- Der Verkauf von Silvesterknallern aus osteuropäischen Ländern ist zum Teil in Deutschland verboten, was meinst Du, warum das so ist?
- Bei der Oxidation von Eisen wird Energie frei. Erkläre, ob sich die Energiebeträge bei den drei verschiedenen Oxidationsformen unterscheiden. Vergleiche dazu die Verbrennung von etwas Eisen mit der gleichen Menge an rostendem Eisen (z.B. am Fahrrad).
- Informiere Dich zu den Konsequenzen, der täglich millionenfachen Verbrennungen von Holz, Benzin, Erdöl, Diesel und anderen Brennstoffen auf unserem Planeten.
Gute Suchbegriffe sind: Luftverschmutzung, Klimawandel durch Treibhauseffekt (bzw. Treibhausgas Kohlenstoffdioxid), Smog
Beispiele für Explosionen
Mehlstaubexplosionen (z.B. in Mühlen):

Gemische aus Staub und Luft sind explosionsfähig, wenn sie aus brennbaren organischen oder anorganischen Stäuben wie z.B. Kohle-, Mehl-, Holz-, Kakao-, Kaffee-, Stärke-, Aluminium- oder Cellulosestaub bestehen. Entscheidend für die Zündfähigkeit ist der Sauerstoffanteil in der Luft und der Zerteilungsgrad des Brennstoffes. Ein Funke kann für die Zündung ausreichen.
Besonders gefährlich ist dies in Mühlen, da dort immer etwas Mehlstaub aufgewirbelt wird. Ein Funke reicht aus, um unter Umständen eine schreckliche Explosion herbeizuführen.
So kam es am 6.2.1979 in der Rolandmühle in Bremen zur größten Mehlstaubexplosion Deutschlands. Es starben 14 Menschen und 18 weitere wurden verletzt. Der Schaden an der Mühle und den Nachbarhäusern betrug etwa 50 Millionen Euro.
Material: Teelicht, Kunststoffflasche
V: In den Aluminiumbecher eines Teelichtes wird ca. 1g Mehl gegeben. Das entzündete Teelicht wird daneben gestellt. Eine aufgeschnittene 2 Liter Kunststoffflasche darüber gestellt. Die Flasche hat in ca. 5cm ein Loch in dem ein gebogenes Glasrohr steckt, welches in den Staub zeigt. Über ein Gebläse wird nun Luft zugepustet.
B: Beim Aufwirbeln des Staubs kommt es zur Staubexplosion
S: Brennbare Feinstäube wie Mehl, Sporen, Sägemehl o.a., können im Gemisch mit Luft äußerst heftig explodieren, wenn sie einen hohen Zerteilungsgrad haben. Solche Staubexplosionen sind sehr gefährlich.
Alternativ: Man dreht aus dünnem Karton unter Verwendung von Klebestreifen eine kegelförmige Tüte mit ei-ner kleinen Öffnung (Durchmesser 4 bis 5 mm) und einer großen Öffnung (Durchmesser ca. 5 cm). Dann hält man die kleine Öffnung mit einem Finger zu und gibt eine Spatelspitze Bärlappsporen (Lycopodium) oder Weizenmehl in die Tüte. Man setzt den Mund an die größere Öffnung und pustet möglichst kräftig das Pulver durch die kleinere Öffnung von schräg unten in die Flamme.
Siehe auch: (https://de.wikipedia.org/wiki/Staubexplosion)
b) Wasserstoffexplosion
V: Eine Konservenbüchse (mit Loch) wird mit Wasserstoff gefüllt und dann entzündet. Man muss ca. 2-3 min. bis zur Explosion warten.
B: Es kommt erst zur Explosion, wenn das Mischungsverhältnis zwischen H2 und O2 stimmt.
Gesetz von der Erhaltung der Masse und der Energie
a) Massenerhaltung:
Was geschieht mit der Masse der Reaktionsteilnehmer bei einer chemischen Reaktion?

Massenerhaltung
V: In einen Rundkolben werden Streichholzspitzen gefüllt. Er wird
mit einem Luftballon geschlossen und gewogen. So liegt ein geschlossenes System vor.
B: Luftballon dehnt sich aus und zieht sich wieder zusammen
Zu Beginn der Reaktion: m1 = 50,41 g
Am Ende der Reaktion m2 = 50,41 g
S: Das Gas dehnt sich bei Erwärmung aus und kontrahiert beim Abkühlen.
=> Die Gesamtmasse der Reaktionspartner hat sich nicht geändert.
Antoine Lavoisier (1743 - 1794): Gesetz von der Erhaltung der Masse:
„Rien ne se perd, rien ne se crée“
Die Gesamtmasse ändert sich bei chemischen Reaktionen (im Rahmen der Messgenauigkeit) nicht:
Masse Ausgangsstoffe = Masse Produkte
b) Energieerhaltung
Albert Einstein 14.3. 1879 - 18.4.1955):
„Umwandlung von Energie in Masse und von Masse in Energie ist möglich.“
E = m ∙ c2 (c = Lichtgeschwindigkeit = 300.000 km/s)
Bei einer chemischen Reaktion ist die Summe aus Masse und Energie der Ausgangsstoffe gleich der Summe aus Masse und Energie der Endstoffe.
Wird Energie frei, tritt ein unwägbar kleiner Massenverlust auf. Wird Energie investiert, tritt Massenzunahme auf. Dieses kann allerdings mit herkömmlichen Waagen nicht gemessen werden.
Energieerhaltung bei chemischen Reaktionen: (=1.HS Thermodynamik)
Theoretische Vorstellung:
V: Nasses CaO wird getrocknet. Anschließend wird wieder Wasser zugegeben
B: Es wird Energie zum Entfernen des Wassers benötigt. Die Zugabe von Wasser setzt Energie frei.
V: Wasser, CaO und Becherglas und Thermometer werden gewogen. Dann wird das Wasser zugegeben. Die Temperatur steigt.
Woher stammt die freiwerdende Energie (Temperatur)?
Einstein: E=mc2. Wenn c eine Konstante ist und nach dem ersten Gesetz die Masse sich nicht ändert, so muss auch die gesamte Energie bei chemischen Reaktionen unverändert bleiben
=> Wenn Benzin verbrennt und Energie frei wird, muss sie schon vorher enthalten sein
=> Diese Energie nennt man innere Energie
Wiederholungsfragen Kapitel 3
- Was brennt eigentlich, wenn du eine Kerze angezündet hast? Beschreibe, welche Aufgabe der Docht hat.
- Die folgenden Sätze beschreiben, was beim Anzünden einer Kerze geschieht. Leider sind sie durcheinander geraten. Wie muss die richtige Reihenfolge lauten?
a) Am Docht befindet sich festes Wachs. Es brennt nicht.
b) Der Wachsdampf entzündet sich und beginnt zu brennen.
c) Das flüssige Wachs steigt im Docht nach oben (ähnlich wie Tinte im Löschpapier).
d) Der Wachsdampf erreicht seine Entzündungstemperatur.
e) Wenn man eine Streichholzflamme an den Docht hält, wird das Wachs erhitzt und schmilzt.
f) Das Wachs beginnt zu sieden und verdampft. - Vergleiche die Flammen von Brenner und Kerze.
- Es müssen drei Voraussetzungen erfüllt sein, damit etwas brennt. Schreibe sie auf.
- Beim Gas genügt ein kleiner Funke, um es zu entzünden. Dazu reicht ein leeres Feuerzeug, welches selbst kein Gas mehr enthält. Könntest du auch eine Kerze mit einem leeren Feuerzeug entzünden? Begründe.
- Manche Stoffe dürfen nur in einem heißen Wasserbad erhitzt werden. Nenne Stoffe, auf die das zutreffen könnte. Begründe Deine Meinung.
- Stelle die Reaktionsgleichung der Verbrennung von a) Schwefel, b) Kohlenstoff, c) einem beliebigen Metall auf.
- Wozu dient Kalkwasser? Wie stellt man es her?
- Schlage einen Versuchsaufbau vor, der beweist, dass man Kohlenstoffdioxid ausatmet.
- Was ist eine Oxidation? Nenne die drei Formen der Oxidation? Kann man stille Oxidationen beobachten?
- Was denkst Du, warum Explosionen im Chemieunterricht als sehr gefährlich betrachtet werden und warum alle explosiven Stoffe Sicherheitsschilder tragen müssen?
- Der Verkauf von Silvesterknaller aus osteuropäischen Ländern ist zum Teil in Deutschland verboten. Was meinst Du, warum das so ist?
- Informiere Dich zu den Konsequenzen der täglich millionenfachen Verbrennungen auf unserem Planeten. Gute Suchbegriffe sind: Luftverschmutzung, Treibhauseffekt, Ozonloch, Smog.
- Um welchen Faktor verbrennen Stoffe in reinem Sauerstoff schneller als in Luft? Nenne Beispiele.
- Erkläre den Begriff Nichtmetalloxid und ordne den 3 Aggregatzuständen Dir bekannte Nichtmetalloxide zu.
- Informiere Dich über den Stoff Kohlenmonoxid und seine Gefahren.
- Was ist der Unterschied zwischen Sauerstoff und Luft? Wie kann man entstehenden Sauerstoff nachweisen?
- Ist Luft ein Element? Schlage einen Versuchsaufbau vor, mit dem dies gezeigt werden kann.
- Verbrennt ein Stückchen Kohle schneller in Luft, Stickstoff oder reinem Sauerstoff?
- Bei einem Waldbrand fliegen mit Wasser beladene Hubschrauber über das Feuer und werfen das Wasser ab. Was verspricht sich die Feuerwehr davon? Warum kann ein Wald, der auf solche Art gelöscht wurde jederzeit wieder anfangen zu brennen? Welche Rolle spielt eigentlich Wind beim wieder Entfachen eines Waldbrandes?
- Was versteht man unter der Entzündungstemperatur? Nenne Beispiele, wo sie eine wichtige Rolle spielt.
- Welchem Einfluss hat die Form eines Holzstücks auf seine Entzündung am Lagerfeuer? (Vergleiche dazu einen Ast und einen Baumstamm).
- Ein Schüler sagt: „eine Verbrennung ist eine Oxidation, aber nicht jede Oxidation ist eine Verbrennung“. Hat der Schüler damit recht?
- Ordne die folgenden Stoffe nach ihrer Entzündungstemperatur: Streichholz, Benzindampf, Holzkohle, Stroh.
- Was ist ein Metalloxid? Erkläre und nenne drei Beispiele (Was ist ein Nichtmetalloxid?)
- Wozu verwendet man Metalloxide?
- Ist die Verbrennung von Kupfer eine Oxidation? Begründe Deine Meinung.
- Erkläre den Unterschied zwischen Element und Verbindung.
- Erkläre die Vereinigung von Eisen und Schwefel und die Zersetzung von Quecksilberoxid.
- Auf dem Herd hat eine Bratpfanne angefangen zu brennen. Was ist passiert? Wie kann sie gelöscht werden?
- In einem Grill brennt Grillkohle. Liegt eine chemische Reaktion vor? Begründe Deine Meinung und stelle die Reaktionsgleichung auf.
- In einem mit Wasser gefüllten Becherglas steht ein Reagenzglas mit der Öffnung nach unten.
Es enthält feuchte Eisenwolle. Lässt man den Versuch zwei Tage stehen, steigt das Wasser im Reagenzglas an. Erkläre, warum und um wie viel Prozent das Wasser steigt.