Kapitel 25: Elektrochemie II - Transportable Energie: Batterien, Akkus und Knopfzellen

Eine 4,5 Volt Batterie besteht aus drei hintereinander geschalteten 1,5V Batterien
Allgemeines zu galvanischen Elementen
Batterien wandeln chemischer Energie in elektrische Energie um. Da chemische Reaktionen an Stoffe gebunden sind, sind diese transportabel. Der große Vorteil von Batterien und Akkus ist also, dass man durch ihre Hilfe elektrische Energie transportieren kann.
Alle Batterien haben als Kennzeichen den Aufbau aus zwei Halbzellen, zwischen denen der Strom fließt. Es handelt sich also um galvanische Elemente.
Galvanische Elemente bestehen aus einem Elektrolyten, einer Flüssigkeit, die Ionen enthält und zwei Elektroden. Die Elektroden bestehen in der Regel aus Metall oder Graphit.
Die positive Elektrode wird Anode (Ort der Oxidation) und die negative Kathode (Ort der Reduktion) genannt.
Die Spannung einer Batterie hängt maßgeblich von den verwendeten Elektroden ab. Ideal sind ein unedles und ein edles Metall. Zur Erhöhung der Spannung können mehrere galvanischen Elemente in Reihe geschaltet werden.
Man unterscheidet zwischen Primärelementen und Sekundärelementen:
Primärelement: in der Regel eine Batterie, der Entladevorgang ist nicht reversibel
Sekundärelement: in der Regel ein Akkumulator (Akku), die chemischen Reaktionen beim Entladevorgang sind reversibel
1. Primärelemente
Primärelemente sind galvanische Elemente, welche nachdem sie entladen wurden, nicht von neuem aufgeladen werden können. Ursache liegt darin, dass die exotherme chemische Reaktion zum Erliegen kam und nicht mehr umkehrbar ist.
Einmal nutzbare Batterien sind also typische Primärelemente.
Geschichte der Entwicklung der Batterie
1780 Luigi Galvani: Der italienische als Arzt bemerkte 1780, wie ein Froschbein, das mit Eisen und Kupfer in Berührung kam, immer wieder zuckte. Er folgerte daraus, dass es sich um eine elektrochemische Reaktion handeln musste.
1800 Alessandro Volta: Volta baute die erste „Volta'sche Säule“, ein galvanisches Element aus Silber und Zink, bei dem mehrere Zellen in Reihe geschaltet sind. Als Elektrolyt diente Salzwasser. Somit war diese Batterie nicht nur schwer und teuer, sondern auch durch die Flüssigkeit kaum transportierbar.
1866 Georges Leclanché: Entwicklung der Trockenbatterie mit Zink und Graphit als Elektroden (Zink-Kohle-Batterie genannt)
1887 Carl Gassner: Verbesserung der Zink-Kohle-Batterie durch einen Zinkbehälter, der gleichzeitig als Elektrode dient und einer zweiten Elektrode, welche nicht mehr den teuren Reinstgraphit, sondern eine Mischung aus Braunstein und Ruß enthielt. Als Elektrolyt kam Ammoniumchloridlösung zur Verwendung (heute nutzt man da eher Zinkchlorid).
Damit der Elektrolyt nicht zu flüssig ist, wird er mit Methylzellulose oder Stärke eingedickt.
Da der Zinkbehälter bei der Reaktion Schaden nehmen kann, kann eine Batterie (vor allem am Ende ihrer Lebenszeit auslaufen).
Verschiedene Primärelemente
1. Die Zink-Kohle Batterie bzw. Die Trockenbatterie (Leclanché Element)
V: In einem Batterieglas mit Ammoniumchloridlösung steht ein Zinkbecher.
In die Lösung taucht man eine Graphitelektrode ein, die mit einem mit Braunstein gefüllten Beutel umhüllt ist. Im Leclanché-Element ist die Ammoniumchloridlösung durch Gelatine eingedickt.
Die beiden Elektroden werden durch ein Voltmeter verbunden.
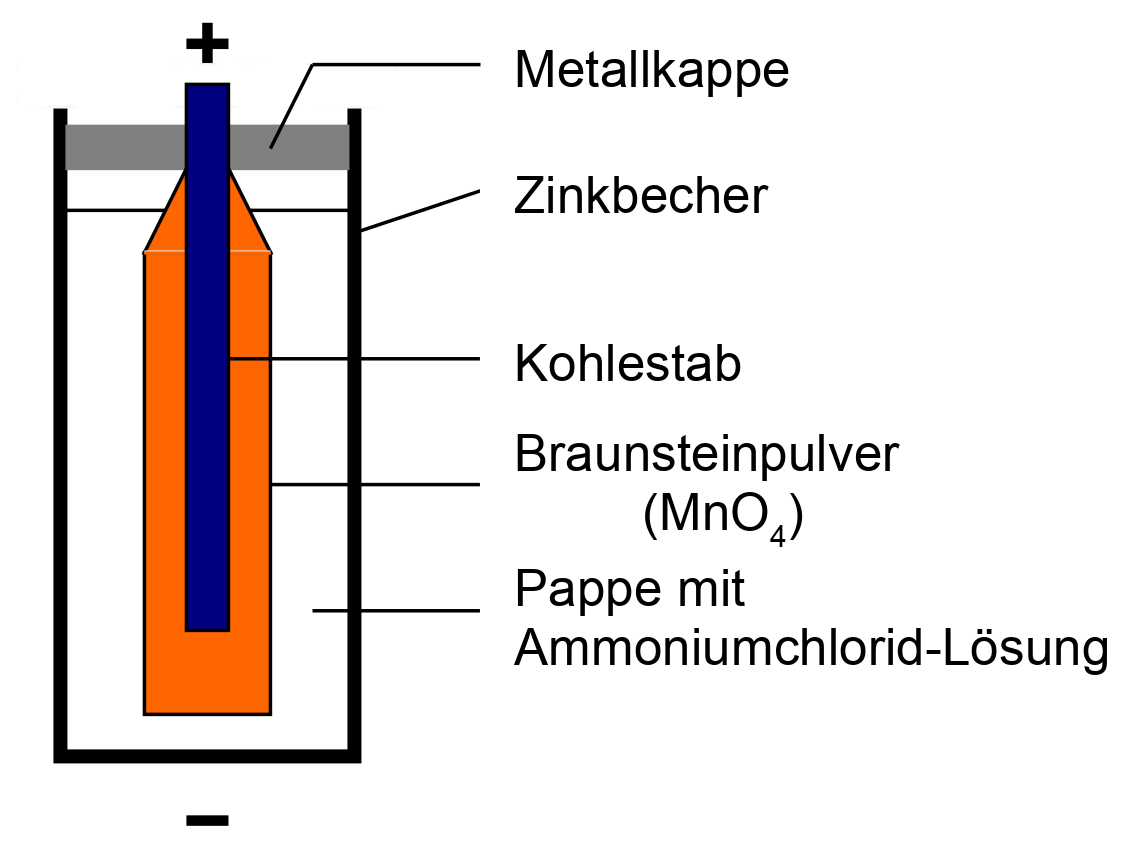
Achtung! kleiner Fehler in der Grafik: Die Formel von Braunstein ist MnO2
Redoxsysteme:
am Zinkbecher: ox: Zn --> Zn2+ + 2 e-
am Kohlestab: red: 2 MnO2 + 2 H3O+ + 2 e- --> 2MnO(OH) + 2H2O
—————————————————————————————————————————
Redox: Zn + 2 MnO2 + 2 H3O+ --> Zn2+ + 2MnO(OH) + 2H2O
Das Oxoniumion entsteht durch die Protolyse des Ammonium-Ions.
NH4+ + H2O --> NH3 + H3O+
Ammoniak entweicht nicht, sondern wird an Zink-Ionen gebunden. Es entsteht ein Zinkionenkomplex, dieser wiederum reagiert mit den Chloridionen zu einem schwerlöslichen Diamino-Zink-Chloridkomplex.
Zn2+ + 2NH3 --> [Zn(NH3)2)]2+
[Zn(NH3)2)]2+ + 2Cl- --> [Zn(NH3)2)]Cl2
Gesamtgleichung:
Zn + 2MnO2 + 2NH4Cl --> 2MnO(OH) + [Zn(NH3)2)]Cl2
Spannung einer Zink-Kohle-Batterie: ca. 1,5 V
Anwendung: Taschenlampenbatterie usw.
1,5 V Mono-Zelle: Ein Zinkbecher mit innerem Kohlestab und Mangann(IV)oxid. Als Elektrolyt dient eine getränkte Pappe mit Ammoniumchlorid

Beschrifte die Zeichnung mit den folgenden Begriffen:
- Metallkappe (Pluspol)
- Kohlestab (Kathode)
- Zinkbecher (Anode)
- Mangan(IV)oxid mit Aluminiumchlorid vermischt
- mit Elektrolyt getränkte Pappe (Salzbrücke)
- Metallboden (Minuspol)
2. Die Alkali-Mangan-Batterie
Alkali-Mangan-Zellen haben gegenüber den Zink-Kohle-Batterien einen großen Vorteil: sie sind ziemlich auslaufsicher. Ihre maximale Spannung liegt ebenfalls bei 1,5V.
Da die Alkali-Mangan-Batterie im Vergleich teurer in der Herstellung ist, nutzt man diese Batterien oft für Fotoapparate und langlaufende Geräte, in denen die Batterien länger gelagert werden.
Ansonsten ist die Alkali-Mangan-Batterie vergleichbar der Zink-Kohle-Batterie aufgebaut:
Gesamtgleichung einer Halbzelle:
Zn + 2MnO2 + 2H2O + 2OH- --> (Zn(OH)4 )2- + 2MnO(OH)
3. Knopfzellen
3.1 Silberoxid-Zink-Knopfzelle in der Armbanduhr:
Silberoxid-Zink-Knopfzelle haben eine hohe Lebensdauer von bis zu fünf Jahren. Typische Einsatzgebiete dieser recht teuren Batterien sind Herzschrittmacher und zum Teil Uhren.
Wenn die Batterie keine Spannung mehr liefert, so hat das komplette Silberoxid der Batterie zu Silber reagiert. Recycling dieser Batterien ist also ausgesprochen sinnvoll!
Als Elektrolyt kommt Kaliumhydroxid zum Einsatz.
Red: Ag2O + H2O+2e- --> 2Ag + 2(OH)-
Ox: Zn + 2(OH)- --> ZnO + H2O + 2e-
————————————————————————
Redox: Ag2O + Zn --> 2Ag + ZnO
Silberoxid-Zink-Zellen kommen häufig in Armbanduhren zum Einsatz und liefern recht lange eine Spannung von ca. 1,6 Volt.
3.2 Die Lithium-Mangan-Knopfzelle
Auch diese Knopfzelle ist sehr langlebig und wird gerne in Rauchmeldern, Kameras und anderen Geräten, welche dauerhaft Spannung benötigen verwendet.
Die Batterie kann eine Spannung von ca. 3 Volt bereitstellen, wobei Lithium oxidiert wird und Braunstein zu Mangan(III)-Ionen reduziert wird.
Redox: Li + MnO2 --> LiMnO(OH)
3.3 Zink-Luft-Knopfzelle
Eine ungewöhnliche Batterie ist die Zink-Luft-Knopfzelle. Bei ihr erfolgt die Reduktion von Luftsauerstoff zu Hydroxidionen. Dazu ist ein sauerstoffbindender Aktivkohle-Ruß-Gemisch-Katalysator notwendig.
Zink wird wie üblich zu Zinkionen oxidiert. Der Elektrolyt ist Kalilauge.
Die maximale Nennspannung beträgt 1,4V.
Ein typischer Einsatzbereich sind Hörgeräte.
Red: O2 + 2H2O + 4e- --> 4(OH)-
Ox: Zn --> Zn2+ + 2e-
—————————————————————————————
Redox: O2 + 2H2O + 2Zn --> 2Zn2+ + 4(OH)-
2. Sekundärelemente
Sekundärelemente haben als entscheidendes Merkmal die Fähigkeit durch bezeichnet elektrische Energiequellen mehrfach regeneriert (also geladen) werden zu können.
Zur Gruppe der Sekundärelemente gehören die Akkumulatoren, die man rund 1000 Male aufladen kann.

2.1 Der Bleiakkumulator
1854 entwickelte Wilhelm Josef Sinsteden einen Bleiakkumulator. Dazu verwendete er zwei Bleiplatten in einem säurefesten Gefäß mit verdünnter Schwefelsäure als Elektrolyt.
An beide Bleiplatten wurde eine elektrische Spannung angelegt. Anschließend war es möglich diese dann wieder zu entladen. Der ganze Vorgang des Ladens und Entladens war mehrfach wiederholbar. Die erste Möglichkeit elektrische Energie zu speichern war erfunden.
Die Leistung des Bleiakkus liegt bei ca. 2 Volt!
Beim Ladevorgang reagiert immer eine der Platten zu reinem Blei und die andere zu Bei(IV)-oxid. Beim Entladen bildet sich daraus Blei(II)sulfat:
Ab 1882 wurde der Aufbau des Bleiakkumulators von Henri Tudor weiterentwickelt. Eine wesentliche Änderung war dabei die nun spiralförmige Anordnung der Elektroden.
Entladung:
neg. Pol - Ox: Pb + (SO4)2- --> PbSO4 + 2e- (Pb gibt e- ab und wird zu Pb²⁺)
pos- Pol - Red: PbO2 + SO42- + 4H3O+ + 2e- --> PbSO4 + 6H2O (Pb⁴⁺ nimmt e- auf und wird zu Pb²⁺)

Quelle Bild: Public Domain von wikicommonsuser Fleshgrinder - Danke; http://commons.wikimedia.org/wiki/File:Bleiakkumulator_Entladevorgang.svg
Die Lebensdauer eines Bleiakkus liegt bei ca. 10 Jahren.
Beim Aufladen finden nun die genau umgekehrten Prozesse statt:
Negativer Pol - Ox: PbSO4 + 2e- --> Pb + (SO4)2-
Positiver Pol - Red: PbSO4 + 6H2O --> PbO2 + SO42- + 4H3O+ + 2e-
Wie man sieht, sind beide Vorgänge, Laden und Entladen, die gleichen Vorgänge nur rückwärts!
In der Chemie spricht man von Reaktion und Umkehrreaktion.
Dabei gilt:
- Der Elektronenfluss ist vom +-Pol zum - -Pol
- Beim Ladevorgang entstehen an beiden Polen Schwefelsäure.
- Beim Entladevorgang reagiert diese Schwefelsäure zu Wasser.
Zusatzinformationen:
http://de.wikipedia.org/wiki/Bleiakkumulator
2.2 Der Lithium-Ionen-Akkumulator
Der Lithium-Ionen-Akkumulator gehört zu den leistungsstärksten und gleichzeitig leichtesten Akkumulator (in Bezug auf seine Leistung!), den man herstellen kann.
Durch das unedle Metall Lithium kann er Spannungen von 3,3V bis zu 3,8V bereitstellen. Er kann viele Male aufgeladen werden und zeigt nur einen geringen Memory-Effekt. Allerdings ist er ein recht teurer Akku.
Typische Einsatzgebiete sind also Handys, Tabletts, Notebooks usw.
Den negativen Pol bildet oft ein Lithium-Graphitgitter, welches die Elektronen dem edleren und positiven Pols, dem Manganoxid (oder dem Cobaltoxid) zur Verfügung stellt. Man spricht dabei von Interkalationsverbindungen. Als Elektrolyt kommen Lithiumsalze zum Einsatz.
Wird das stabilere Mangan-Oxid als Kathode verwendet, so hat der Akku eine längere Lebenszeit und es liegt eine geringe Überhitzungsgefahr durch Überladung als bei einer Cobalt-Oxid Kathode vor.
Pos-Pol, Red: Li(1-x)Mn2O4 + xLi+ + xe- --> LiMn2O4
Neg-Pol, Ox: LixCn --> C + xLi+ + xe-
———————————————————————————————————————
Redox: Li(1-x)Mn2O4 + LixCn --> LiMn2O4 + nC
Als Vereinfachung kann die folgende Gleichung die Entladung zusammenfassen - beachte, dass hier Cobalt anstelle des Mangans zum Einsatz kommt:
Entladen: LiC6 + CoO2 --> 6C+ LiCoO2
Leistung des Lithium-Ionen-Akkus: Nennspannung ca.3,6 Volt.
2.3 Nickel-Metallhydrid-Akkumulatoren
Eine einfachere Form stellt der Nickel-Metallhydrid-Akkumulator dar. Er kann als Metallhydrid das giftige Schwermetall Cadmium (heute kaum noch in Verwendung!) oder andere Metallhydride verwenden. Hydride sind Verbindungen welche negative Wasserstoffionen (!) enthalten (H-).
Laden:
+II 0 +III -I
Ni(OH)2 + Metall --> NiO(OH) + Metall-H
Entladen:
+III -I +II 0
NiO(OH) + Metall-H --> Ni(OH)2 + Metall
Die Brennstoffzelle und Wasserstoffgewinnung
„Das Wasser ist die Kohle der Zukunft. Die Energie von morgen ist Wasser, das durch elektrischen Strom zerlegt worden ist. Die so zerlegten Elemente des Wassers, Wasserstoff und Sauerstoff, werden auf unabsehbare Zeit hinaus die Energieversorgung der Erde sichern.“ (Jules Verne, 1870)
Brennstoffzellen sind ganz allgemein Batterien, welche Strom aus den gasförmigen Elementen Sauerstoff und Wasserstoff herstellen.
Dabei findet eine stark exotherme Oxidation des Wasserstoffs statt.
Im Grunde liegt das umgekehrte Prinzip der Elektrolyse von Wasser vor.
Der Trick der Brennstoffzelle ist nun, dass sie die stark exotherme Reaktionsenergie nicht in Form von Wärme abgibt, sondern in Form von elektrischem Strom. Die freigewordene Energie wird also direkt in elektrische Energie umgewandelt.
Brennstoffzellen haben eine hohe Effizienz, da kaum Abwärme entsteht. Würde man z.B. einen ähnlich energiereichen Stoff wie Wasserstoff, also z.B. Benzin verbrennen, und mit der Wärmenergie einen Generator antreiben, so würde ein Großteil der Energie (ca. 75%) als Abwärme ungenutzt verpuffen.
Weitere positive Aspekte der Brennstoffzelle sind, dass auch kein Lärm, keine Abwärme, und auch keine Vibrationen oder Erschütterungen erzeugt werden.
Wasserstoffgewinnung zum Betrieb der Brennstoffzelle
Interessant wird die Brennstoffzelle erst, wenn man auch selbst den Wasserstoff gewinnt! Dies kann auch regenerativen Quellen, z.B. mithilfe von Sonnenlicht geschehen.
Wasserstoffgewinnung aus fossilen Quellen:
Wasserstoff wird auch heute noch überwiegend aus Erdgas und zum Teil auch aus Erdöl hergestellt. Ein Verfahren dazu ist die Dampfreformierung von Erdgas. Methan (CH4) reagiert dabei mit Wasser zu Wasserstoff und Kohlenstoffdioxid. Die dabei entstehenden CO2-Emission sind belastend für das Klima, so dass aus Gründen der sich verknappenden fossilen Brennstoffe und aus klimatischen & umweltspezifischen Gesichtspunkten diese Methode nicht mehr vertretbar ist.
Wasserstoffgewinnung aus regenerative Quellen:
Es gibt mehrere Verfahren, um Wasserstoff aus Wasser herzustellen. Am einfachsten ist es das Wasser elektrolytisch zu zersetzten. Der dazu notwendige Strom kann von Solarzellen auf dem Hausdach selbst hergestellt werden.
Eine weitere Möglichkeit ist die Vergasung und Pyrolyse von Biomasse mit anschließender Shiftreaktion. Bei dieser Wasserdampfvergasung von Biomasse können z.B. Landwirtschaftliche Abfälle, Kompost oder Tierkot mit Bakterien und Wasserdampf reagieren, wobei Biogase, vor allem Methan entsteht. Dieses Gasgemisch wird auch als Biogas oder Faulgas bezeichnet.
Aus den Faulgasen wird dann vergleichbar mit dem oben beschriebenen Verfahren Wasserstoff aus Methan produziert.
Pro und Kontra des Einsatzes von Brennstoffzellen:
|
Pro |
Kontra |
|
Wasserstoff ist momentan der aussichtsreichste Energieträger |
Die Gewinnung von Wasserstoff ist aufwändig |
|
Die Reaktion in Brennstoffzelle ist umweltfreundlich, da nur Wasser als Abgas entsteht.
|
Es ist schwierig Wasserstoff dauerhaft zu speichern, da es eine sehr geringe Dichte hat und durch die Wände der Druckgasflaschen diffundieren kann.
|
|
CO2 wird als Klimagas nicht freigesetzt!
|
Nicht alle Prototypen der letzten Jahre sind schon serienreif und bezahlbar! |
|
Verwendung im Keller (als Gas- oder Ölheizungsersatz) als auch in der in Autoindustrie möglich.
|
|
|
hoher Wirkungsgrad |
Wiederholungsfragen zum Thema Batterien und Akkus
- Erstelle eine beschriftete Skizze eines Leclanche-Elements (Trockenbatterie) und erkläre dann die Funktionsweise. Formuliere dann die vereinfachte Redoxgleichung, welche der Stromerzeugung zu Grunde liegt.
- Formuliere die Reaktionen beim Be- und Entladen eines Bleiakkumulators. (bzw. wie ist eine Trockenbatterie aufgebaut?)

Beschreibe die folgende Abbildung und erkläre die elektrochemischen Vorgänge. Die Metalle sind Kupfer und Zink:

- Erkläre die Spannungsunterschiede der folgenden Versuche. Kupfer wurde hierbei durch ein anderes Metall ersetzt:
- Kannst Du eine Aussage zu dem in 4 gewähltem Metall treffen?