Kapitel 12 Redoxreaktionen der großtechnischen und industriellen Chemie

Industrielle Chemie arbeitet in sehr großen Maßstäben, dabei muss auf die Umwelt geachtet werden. Keine Giftstoffe dürfen entweichen. Da dies in der Vergangenheit nicht immer so war, hat die Chemieindustrie bei einigen Menschen einen schlechten Ruf – ihre Produkte sind für unser Leben aber unverzichtbar!
Was versteht man unter großtechnischer Chemie?
Die großtechnische Chemie ist die industrielle Chemie, bei der Produkte in chemischen Werken und großen Industrieanlagen produziert werden.
Die Chemie im Labor unterschiedet sich durch großtechnische Chemie im wesentlichen dadurch, das in anderen Mengenmaßstäben gearbeitet wird. Während man im Labor oft nur an der Reaktion an sich interessiert ist, z.B. einer Farbreaktion, einem Nachweis usw., ist man in der Großtechnik vor allem daran interessiert möglichst preiswert viel Produkt herstellen zu können.
Demzufolge laufen die Reaktionen z.B. in sehr großen Reaktionstanks ab. Die Reaktionen selbst sind oft maschinell gesteuert, um genaue Mengenvorgaben und Zeitvorgaben einzuhalten.
Dieser Größenunterschied hat auch Konsequenzen auf die Sicherheitsvorkehrungen, da im großen Maßstab einfach mehr Druck entstehen kann, oder auch wesentlich höhere Energiebeträge benötigt oder frei werden.

Erdölraffinerie in Nordspanien
Wichtige Produkte der chemischen Industrie sind:
Säuren, Laugen, Düngemittel, Farben, Lösungsmittel, Baustoffe wie Kalk usw.
Produkte der chemischen Industrie I: Schwefelsäure
Schwefelsäure gehört zu den wichtigsten Säuren. Sie wird bei vielen anderen Reaktionsprozessen zugefügt, um ein saures Milieu zu erhalten oder auch als Katalysator oder Sulfatspender verwendet.
a) Vorkommen von Schwefel
- elementar
- in Verbindungen, z.B. Pyrit (FeS2), Zinkblende (ZnS), Gips (CaSO4 · 2 H2O)
- in Erdöl, Kohle (Braunkohle, Steinkohle) als begleitendes Element
b) Schwefelverbindungen: Schwefeldioxid
Verbrennung von Schwefel
S8 + 8 O2 ---> 8 SO2 ΔH = -297 kJ/mol
SO2 + H2O ---> H2SO3
Die schweflige Säure lässt sich nicht in reiner Form isolieren.
Struktur SO2
Beachte: Die Oktettregel gilt streng nur für die Atome der zweiten Periode des PSE. Schwefel darf also mehr als vier Atombindungen haben.
Herstellung von SO2 durch Rösten von Pyrit (Schwefelkies)
4 FeS2 + 11 O2 -----> 2 Fe2O3 + 8 SO2
Es gibt noch ein weiteres Schwefeloxid. Wie kann man dieses erhalten?
Die Verbrennung von Schwefel bildet SO2, welches u.a. ein Konservierungsmittel ist.
Durch Wasserkontakt entsteht daraus Schwefligesäure.
c) Technische Darstellung von H2SO4 durch das Kontaktverfahren
Vom Schwefeldioxid zur Schwefelsäure
2 SO2 + O2 ---Katalysator--> 2 SO3 ΔH = -176 kJ/mol bei 400°C
Schwefeltrioxid reagiert mit Wasser zu Schwefelsäure: SO3 + H2O ---> H2SO4
Industrielle Herstellung Schwefelsäure
Es laufen im wesentlichen drei Verfahrensschritte ab:
Gewinnung von Schwefeldioxid
Oxidation von SO2 zu SO3
Umsetzung von SO3 mit Wasser zu H2SO4
Alle drei Schritte sind exotherm => Kühlung nötig
Kontaktverfahren => ~ 3 % SO2 in der Abluft
Doppelkontaktverfahren => ~ 0,3 % SO2 in der Abluft
Katalysator:
2 SO2 + 2 V2O5 ---> 2 SO3 + 4 VO2
4 VO2 + O2 ---> 2 V2O5
--------------------------------------------------
2 SO2 + O2 ---> 2 SO3
d) Eigenschaften der Schwefelsäure

Cu + H2SO4 ---> CuO + H2O + SO2
H2SO4 ist ein Oxidationsmittel
Zuckerverkohlung mit konzentrierter Schwefelsäure
V: Zu Schwefelsäure wird Wasser zugefügt. Die Temperatur dabei gemessen – Vorsicht Gefahr!
B: Die Temperatur steigt bis auf 110°C ohne dass die Mischung siedet
S: H2SO4 reagiert mit Wasser unter stark exothermer Reaktion
H2SO4 ist ein stark wasserentziehendes Mittel (Beachte: die Oxidationszahl von C ändert sich nicht)
Eigenschaften von Schwefelsäure:
- stark wasserentziehend
- ein Oxidationsmittel
- eine starke Säure
e) Verwendung der Schwefelsäure
Herstellung von Düngemitteln
Herstellung von Weißpigmenten (TiO2)
Im Blei-Akkumulator (Autobatteriesäure)
Bei der TiO2-Produktion aus FeTiO3 fällt die sogenannte „Dünnsäure“ an (15-20% H2SO4).
Bis 1989 „Verklappung“ in die Nordsee. (Alle Anrainer zusammen 1,3 Mio t/a)
Recycling:
Wasserentzug im Vakuum
zurückbleibendes FeSO4 („Grünsalz“) wird bei hohen Temperaturen zersetzt.
4 FeSO4 ---> 2 Fe2O3 + 4 SO2 + O2
Labordarstellung
f) Salze der Schwefelsäure
Oxidationsreaktionen
(konz. + Cu)
(verd. + Zn)
g) Salze der schwefligen Säure
Na2SO3, K2SO3
g) Nachweis von Sulfationen
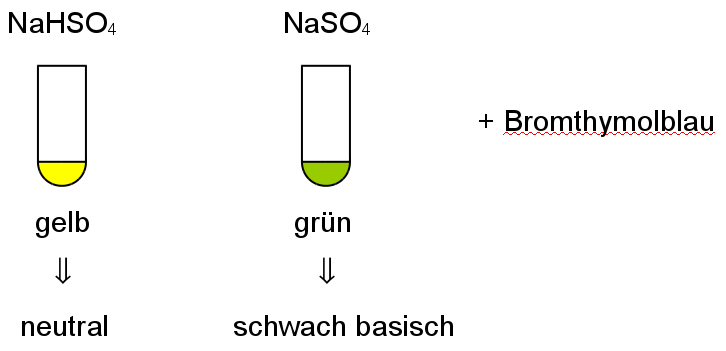
Sulfatiuonen fallen mit Bariumionen zu einem Feststoff aus. Diese Reaktion gehört zu den Fällungsreaktionen:
Ba2+ + SO42- ---> BaSO4
Produkte der chemischen Industrie II: Salpetersäure - eine Stickstoffverbindung
a) "Verbrennung" von Stickstoff im elektrischen Lichtbogen
Salpeterssäuregewinnung aus Chilesalpeter:
H2SO4 + 2 NaNO3 ---> Na2SO4 + 2 HNO3
Früher gab es vor allem die Gewinnung aus Harn und Fäkalien. Aber diese Menge reichte nicht aus für Kriegsindustrie. Salpeter war ein wichtiger Bestandteil bei der Herstellung von Schwarzpulver.
Stickstoff verbindet sich nicht ohne weiteres mit dem Sauerstoff der Luft. Um diese Reaktion zu ermöglichen, ist sehr viel Energie nötig.
V: Stickstoff wird im Lichtbogen mit Sauerstoff zur Reaktion gebracht.
B: Es entsteht ein braunes Gas. Die wässrige Lösung des Gases reagiert sauer.
S: Im elektrischen Lichtbogen verbrennt Stickstoff zu Stickstoffmonoxid sowie Stickstoffdioxid und evtl. weiteren Stickoxiden.
N2 (g) + O2 (g) ---> 2 NO (g) ΔH = + 90 kJ/mol
farblos
2 NO (g) + O2 ---> 2 NO2 ΔH = - 112 kJ/mol
farblos braun
Man erkennt deutlich, dass ein ungepaartes Elektron vorhanden ist. Verbindungen mit ungepaarten Elektronen nennt man Radikale.
Stickstoffdioxid reagiert mit sich selbst zu N2O4
2 NO2 ---> N2O4
Diese Reaktion kann in beide Richtungen reagieren. Bei Raumtemperatur liegt vor allem N2O4. Vor.
Bei höheren Temperaturen bildet zunehmend mehr NO2.
+IV +III +V
NO2 + H2O ---> HNO2 + HNO3
b) Wege zur Herstellung von NO
Verbrennung von N2 im Lichtbogen
Einwirkung von HNO3 auf Kupferspäne
Oxidation von NH3
c) Katalytische Verbrennung von Ammoniak (Ostwald-Verfahren)
Die Synthese in Lichtbogen ist extrem energieaufwändig! Mit Einführung der großtechnischen
NH3 -Synthese 1913/14 konnte Salpetersäure erstmalig günstig aus Ammoniak gewonnen werden.
N2 + 3 H2 ---> NH3 ΔH = - 92 KJ
Als Katalysator dienen Platin-Netze mit einem 5-10% Anteil an Rhodium.
1. Oxidation von NH3 zu NO
4 NH3 + SO2 ---> 4 NO + 6 H2O ΔH = - 3616 KJ
2. Oxidation von NO zu NO2
4 NO + 2 O2 ---> 4 NO2 ΔH = - 228 KJ
3. Umsetzung von NO2 zu HNO3
4 NO2 + O2 + 2 H2O ---> 4 HNO3
d) Eigenschaften der Salpetersäure
Reine Salpetersäure ist eine farblose Flüssigkeit. Beim Erhitzen oder unter Lichteinwirkung erfolgt teilweise Zersetzung.
4 HNO3 --> 2 H2O + 4 NO2 + O2
1. Säureeigenschaften von Salpetersäure
HNO3 ist eine starke Säure
Mit unedlen Metallen (Mg, Zn, Fe) entwickelt die verdünnte Säure Wasserstoff, dabei entstehen Nitrate.
2. Oxidierende Wirkung von Salpetersäure
Konz. HNO3 ist ein starkes Oxidationsmittel
Sie kann die meisten edlen und unedlen Metalle auflösen.
Pb + 4 HNO3 ---> Pb(NO3)2 + 2NO2 + 2 H2O
3 Cu + 8 HNO3 ---> 3 Cu(NO3)2 + 2 NO + 4 H2O
e) Verwendung von Salpetersäure
ca. 80 % zur Herstellung von Düngemitteln (v.a. NH4NO3)
Einsatz in der organischen Synthese
Aufgaben:
1. Bei der katalytischen Oxidation von NH3 können auch Stickstoff und Distickstoffmonoxid entstehen. Formuliere die Gleichungen beider Reaktionen.
e) Vergleich der verschiedenen Stickstoffoxide
Distickstoffmonooxid, N2O (Lachgas)
Die Gewinnung geschieht durch vorsichtiges Erhitzen von Ammoniumnitrat auf 200°C (man darf diese Temperatur aber nicht überschreiten, da zu hohe Temperaturen über 300°C die Explosionsgefahr steigern.)
NH4NO3(l) ⇌ N2O(g) + H2O(g)
Eigenschaften von NO2
- N2O ist farblos
- reaktionsträge
- diamagnetisch
- hat einen schwach süßlichen Geruch
- löst schon in geringen Mengen Rauschzustände (sowie Lachlust) aus
- wird auch als Narkosemittel eingesetzt
- Treibgaswirkung (enthalten Sprühsahne)
Stickstoffmonooxid, NO und Distickstoffdioxid, N2O2
- farblos
- giftig
- paramagnetisch
- hat freies Radikal, da es eine ungerade Zahl an Valenzelektronen hat
- gering reaktionsfähig
- Siedepunkt bei -152°C
- das Dimerisierungsgleichgewicht legt bei Raumtemperatur auf der Seite des NO: 2NO ⇌ N2O2
- entsteht z.B. bei sehr hohen Temperaturen aus N2 und O2 wobei die Ausbeute bei 2000°C nur bei 1% liegt.
- entsteht auch bei Gewittern und als Nebenreaktion bei Verbrennungen
- zu Herstellung von NO wird industriell v.a. das Ostwald-Verfahren angewendet
- NO reagiert mit Sauerstoff zu NO2 (exothermen Reaktion)
- trägt zur Luftverschmutzung bei
Distickstofftrioxid, N2O3
- blaue Flüssigkeit
- diamagnetisch
- nur bei sehr tiefen Temperaturen (ab -100,7°C) beständig
- bildet sich aber schon, wenn man ein Gemisch von NO und NO2 auf -20°C abkühlt:
NO(g) + NO2(g) ⇌ N2O3(l)
Produkte der chemischen Industrie III: Kalk
Kalk
a) Kalkbrennen
E + CaCO3 ---> CaO + CO2
Produkt: gebrannter Kalk, Branntkalk, Ätzkalk
b) Kalklöschen
CaO + H2O ---> Ca(OH)2 + E
Produkt: Löschkalk (fest)
(Kalkmilch: Löschkalk + Wasser)
Der technische Kalkkreislauf
Durch technische Vorgänge kann Calciumcarbonat (Kalk) in Kalkmörtel umgewandelt werden. Bei der Verwendung härtet dieser durch die Reaktion mit Kohlenstoffdioxid (aus der Luft) wieder zu Calciumcarbonat aus. Dabei bilden sich lange Kalknadeln, welche die Baustoffe (wie Ziegel) gut miteinander verbinden).
V: a) Marmor/ Calciumcarbonat wird in Wasser gegeben. Es erfolgt ein Indikatortest.
b) Dann wird er in der Brennerflamme mehrere Minuten gebrannt und anschließend in Wasser gegeben. Führe einen Indikatortest durch.
B: a) Keine Änderung der Indikatorfarbe.
b) Es ist eine Lauge entstanden.
S: Durch das Brennen ist Calciumoxid entstanden, welches mit Wasser Kalkwasser bildet. Kalkwasser ist eine Lauge - Vorsicht!

a) Gebrannter Kalk
Ab einer Temperatur von etwa 800 °C wird Kalkstein zersetzt. CO2 wird ausgetrieben und es entsteht der gebrannte Kalk:
Calciumcarbonat + E ---> Calciumoxid + Kohlenstoffdioxid
CaCO3 + E ---> CaO + CO2
b) Gelöschter Kalk
Wird gebrannter Kalk mit Wasser versetzt, entsteht unter Volumenvergrößerung und starker Wärmeentwicklung gelöschter Kalk, das zum Kalken von Wänden und als Zusatz zu Kalkmörtel verwendet wird.
Gebrannter (ungelöschter) Kalk und gelöschter Kalk sind stark ätzend! Kontakt mit den Augen kann zur Erblindung führen!
Gewöhnlicher Kalk ist dagegen harmlos.
Calciumoxid + Wasser ---> Calciumhydroxid + E
CaO + H2O ---> Ca(OH)2 + E
c) Abbinden des Mörtels:
An der Luft bindet gelöschter Kalk mit Hilfe von Kohlenstoffdioxid wieder zu Calciumcarbonat ab, womit sich der Kreislauf schließt. Der Vorgang des Abbindens kann durch den geringen CO2 Gehalt der Luft jahrelang dauern. In einigen alten dicken Mauern alter Burgen ist der Mörtel teilweise heute noch nicht abgebunden.
Calciumhydroxid + Kohlenstoffdioxid ---> Calciumcarbonat + Wasser + E
Ca(OH)2 + CO2 ---> CaCO3 + H2O + E
Zusatzinformationen:
https://de.wikipedia.org/wiki/Kalziumcarbonat
https://de.wikipedia.org/wiki/Technischer_Kalkkreislauf
Der Kalkkreislauf
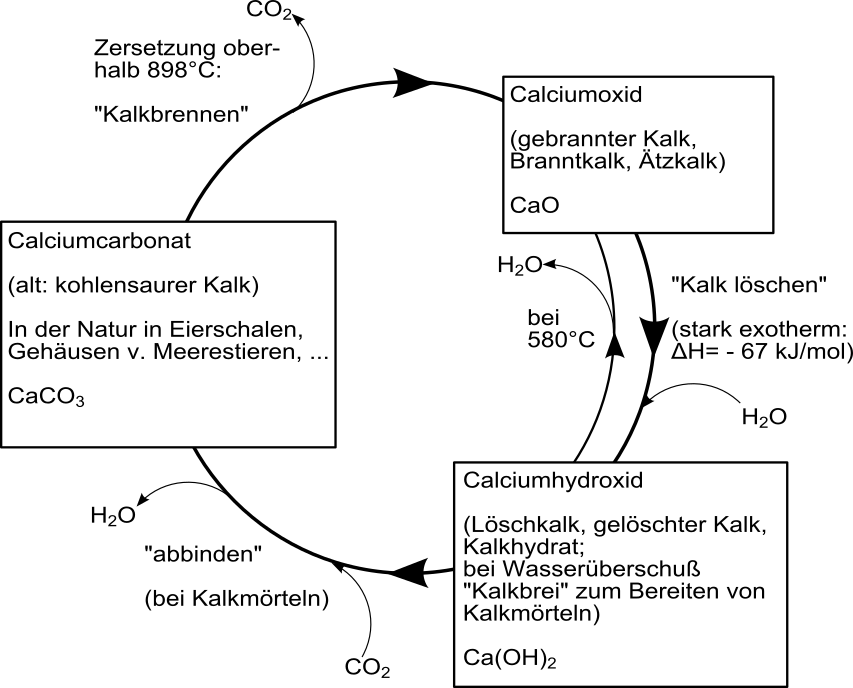
Quelle Bild: Public Domain by Wikicommonsuser: teelittle, Chris und Roland1952 – danke! https://commons.wikimedia.org/wiki/File:Kalkkreislauf.svg
Drehrohrofen

Versteinerung (Fossil), auch Ammonit genannt

Zusatzinformationen
https://de.wikipedia.org/wiki/Versteinerung
Produkte der chemischen Industrie III: Zement
Zement (lat. caementum: Bruchstein, Baustein) verbindet ähnlich wie Kalkmörtel Baustoffe wie z.B. Ziegelsteine. Zement ist besonders fest und hält sehr lange. Obwohl er nicht völlig unanfällig gegen Verwitterung ist, so halten Bauten mit Zement und Beton (einem Produkt aus Zement) sehr lange.
Zur Herstellung wird ein Gemisch aus Ton und Kalk fein gemahlen (manchmal nimmt man Mergel, welches ein natürliches Gemisch beider Stoffe ist). Das Gemisch wird in einen Drehrohofen bei 1450°C erhitzt/ gebrannt. Es entsteht dabei der Zement.
Kommt Zement mit Wasser in Berührung, bindet er ab. Dabei reagieren Calcium-Aluminium-Silikate, die beim Brennen entstanden sind mit Wasser. Es entstehen kleinste Kristalle, die sich ineinander „verfilzen“. Da das Abbinden mit Wasser funktioniert, kann er sogar unter Wasser abbinden, was besonders beim Brückenbau in Flüssen von großer Bedeutung ist.
Diese Verfestigung tritt auch noch ein, wenn die 6-8 fache Menge Sand und Kies zugefügt werden. Eine solche Mischung bezeichnet man als Beton. (Stahlbeton mit Stahlstäben).

Zusatzinformationen:
https://de.wikipedia.org/wiki/Zement_%28Baustoff%29
2) Zementherstellung
Zement wird aus Kalkstein und Ton hergestellt. Die fein gemahlenen Ausgangsmaterialien werden bei 1500 °C gebrannt. Es entweicht Wasser und CO2.
Das erkaltete Produkt (Klinker) wird nach Zusatz von Gips (CaSO4) oder Schlacke zu Zementmehl vermahlen.
3) Kalkmörtel und Beton
V1: Kalk + Sand (1:3) + Wasser
V2: Zement + Sand (1:3) + Wasser
B: Sowohl Zementmörtel als auch Kalkmörtel härten an der Luft aus.
Unter Wasser härtet nur der Zementmörtel (Beton) aus.
Versetzt man Kalkmörtel mit HCl, so schäumt der Mörtel auf und es entwickelt sich CO2.
S: Der Kalkmörtel bindet ab, indem sich CaCO3 aus Ca(OH)2 bildet:
Ca(OH)2 + CO2 ---> CaCO3 + H2O
Dabei wird CO2 aufgenommen und H2O abgegeben.
Kalkmörtel braucht zum Abbinden Luft-Zufuhr (da in Luft CO2 enthalten ist).
Zum Vergleich: Zementmörtel bindet auch unter Luftabschluss ab. Beim Abbinden wird zunächst Wasser gebunden. Dabei entstehen feste Hydrate.
Kalkmörtel bezeichnet man auch als Luftmörtel, Zementmörtel als Wassermörtel (hydraulischer Mörtel).
Aufgaben zu Kalk, Kalkmörtel und Zement
Für alle Aufgaben darf das Handy zur Internetrecherche genutzt werden.
1. Erkläre, was Kalk für ein Stoff ist. Beschreibe dazu auch sein Vorkommen.
2. Erkläre, wie man ausgehend von Kalkstein Kalkmörtel herstellt und wozu man ihn verwendet.
3. Was passiert beim Abbinden (Festwerden) von Kalkmörtel. Erkläre mithilfe der Reaktionsgleichung und erkläre dann, warum in dicken Gemäuern diese Reaktion manchmal Jahrzehnte dauert (z.B. im Dom von Fulda).
4. Ist ein Recycling von altem Kalkmörtel, nachdem ein Haus eingestürzt war, möglich? Begründe, ob man aus Kalkmörtel wieder Calciumcarbonat herstellen kann.
5. Was ist Zement und wo liegt der Unterschied zu Beton und Stahlbeton?
6. Erkläre das Abbinden von Zement und begründe, ob dies auch unter Wasser möglich wäre.
7. Erstelle eine Tabelle in der Du Kalkmörtel, Zement und Beton in mindestens 6 Punkten vergleichst.