- Details
- Zugriffe: 22733
Kapitel 11: Redoxreaktionen, Metallgewinnung und Energiediagramm

Industriedenkmal: Der Hochofen von Hattingen
Wiederholung aus dem Kapitel „Oxidationen I“
Lies am besten nochmal das Kapitel 3 zu den Verbrennungen und Oxidationen. Es ist die Basis für dieses Kapitel.
Rosten von Eisen:
Eisen + Sauerstoff ---> Eisenoxid + Energie
4 Fe + 3 O2 ---> 2 Fe2O3 + E
Verbrennung von Kohlenstoff:
Kohlenstoff + Sauerstoff ---> Kohlenstoffdioxid + Energie
C + O2 ---> CO2 + E
Oxidation von Kupfer:
Kupfer + Sauerstoff ---> Kupferoxid + Energie
Cu + O2 ---> CuO + E
=> Oxidation = Vereinigung mit Sauerstoff
Das erste Metall: Kupfer
Seit ca. 2 Milliarden Jahre gibt es Sauerstoff auf unserem Planeten. Metalle sind seit der Entstehung unseres Planeten vorhanden. Da fragt man sich natürlich, in welcher Form so wichtige Metalle wie Eisen oder Kupfer heute vorliegen? Die Antwort ist oft: durch Jahrmillionen des Kontakts mit Sauerstoff liegen Metalle im Boden fast immer oxidiert, also verbunden mit Sauerstoff vor. Auch Verbindungen mit Schwefel sind übrigens vorhanden! Elementar kommen, wenn überhaupt, nur noch die Edelmetalle vor.

Cuprit / Rotkupfererz (Kupferoxid, Cu2O als Mineral)
Die im Boden vorkommenden Oxide sind nun aber in der Regel für die Menschen nicht zu gebrauchen gewesen, da sie oft verunreinigt und obendrein oft spröde und brüchig sind. Die Menschen zogen deshalb in unserer Frühgeschichte Waffen und Gegenstände aus Stein aufgrund ihrer Haltbarkeit vor.
Aber ca. 5000 Jahre vor Christi Geburt änderten sich dies plötzlich. Die Waffen der sich bis dahin mit Faustkeilen bewaffneten Steinzeitmenschen veränderten sich. Ab der Bronzezeit vor ca. 5000 Jahren hatte der Mensch Metallwerkzeuge aus Kupfer und Bronze. Was muss passiert sein? Die Menschheit hatte eine ihrer wichtigsten Erfindungen gemacht - sie konnte aus Kupferoxid das Metall Kupfer herstellen und dieses weiter zu Bronze verarbeiten. Die Oxidation der Bodenmetalloxide konnte nun wieder von den Menschen rückgängig gemacht werden! Dies war ein wesentlicher Schritt in der Geschichte der Menschheit, da
Bronze dem Stein überlegen war, da sie fest, haltbar und trotzdem verformbar war!
Welche Leistung hat der Mensch am Übergang von der Stein- zur Bronzezeit vollbracht?
=> Die Oxidation muss umgekehrt wurden sein!
Was ist also das Ziel der Metallgewinner aus chemischer Sicht gewesen? (Wenn eine Oxidation die Vereinigung mit Sauerstoff ist...)
=> Die Abgabe/ Entzug von Sauerstoff aus dem Metalloxid (=Reduktion)
Die Reaktion von Kupferoxid mit Wasserstoff - eine Redoxreaktionen
Reaktion von Kupferoxid mit Wasserstoff
V: (Schwarzes) Kupferoxidpulver wird im Wasserstoffstrom erhitzt
B: Flamme wird kleiner, rötliches Produkt, Kondenswasser im Glasrohr, exotherme Reaktion
S: Was ist mit dem Kupferoxid geschehen? Es hat seinen Sauerstoff abgegeben!
CuO + H2 ----> Cu + H2O + E
Die Abgabe (bzw. den Entzug) von Sauerstoff nennt man Reduktion.
Die Reduktion ist der gegenläufige Prozess zur Oxidation.
Wasserstoff ermöglicht seinem Reaktionspartner diese Reduktion, indem es den Sauerstoff aufnimmt. Wasserstoff ist somit ein „Reduktionsmittel“.
Das Reduktionsmittel wird selbst immer oxidiert.
Merkmale von Redoxreaktionen
Einem 8. Klässler, wäre allerdings am Ende der 8. Klasse noch etwas anderes aufgefallen…
Fällt Dir nichts auf? Na klar, es findet doch auch eine Oxidation statt. Wasserstoff vereinigt sich schließlich mit Sauerstoff => es liegt beides vor.
Reduktion und Oxidation finden immer gemeinsam statt.
Das führt zu folgendem Rätsel: Muss immer beides vorliegen? Ist dies nun ein Sonderfall oder gar ein Irrtum?
Diese Frage zu beantworten ist recht einfach, wenn Du Dir einen Vergleich vorstellst:
Du bekommst Taschengeld von Deinen Eltern. Zum Austausch eines Geldscheins gehören immer zwei Leute. Einer der den Schein aufnimmt und einer, der ihn abgibt, oder? Es ist nicht nur etwas Dir passiert, sondern auch mit dem der Dir Taschengeld gibt. Du wirst reicher, die andere Person ärmer.
=> Reduktion und Oxidation liegen immer gekoppelt vor. Man nennt diese Art der Sauerstoffaustauschreaktion Redoxreaktion.
Wie kann man nun eine Redoxreaktion erkennen?
Das Merkmal einer solchen Redoxreaktion ist die Sauerstoffübertragung zwischen den Reaktionspartnern.
Magnesiumfackeln brennen unter Wasser:
Magnesium + Wasser ---> Magnesiumoxid + Wasserstoff(gas) + Energie
Mg + H2O ---> MgO + H2 + E
Kannst Du erkennen, dass Sauerstoff den Partner gewechselt hat? Erst war er an Wasserstoff gebunden (also im Molekül Wasser). Das Wasser hat sich in der Reaktion in seine Elemente zersetzt. Endlich frei, hat der Sauerstoff seine Chance ergriffen und ist nun vereinigt mit seiner große Liebe dem Magnesium.
=> Jede Verbrennung ist eine Redoxreaktion.Als Produkt entsteht immer ein Oxid.
Historische Herstellung von Kupfer aus Kupferoxid
Menschen in der Bronzezeit hatten keinen Wasserstoff als Reduktionsmittel1, sondern sie verwendeten ein anderes vorhandenes Reduktionsmittel. Nur welches Element vereinigt sich leicht mit Sauerstoff und reagiert dabei am besten zu einem Gas (damit keine Verunreinigungen entstehen)?
Die Menschen nahmen damals Kohlenstoff. Man hatte ihn zu dieser Zeit noch überirdisch gefunden und musste nicht tief graben.
V2: In einem Verbrennungstigel wird feiner Kohlenstoff verteilt und eine Mulde gebildet.
Da hinein wird Kupfer(I)Oxid oder Kupfer(II)oxid gefüllt. Alles wird leicht mit Kohlenstoff bedeckt. Mit einem feinen Stab (z.B. einem Schaschlikstab) werden wenige Löcher hineingestochert! Nun muss man alles ca. 10-15 min. bei geschlossenem Deckel erhitzen! Dann kann man das Gemisch in ein Becherglas mit Wasser kippen, damit es sauber wird.
B: Es kam zu einer exothermen Reaktion, bei der ein rötliches Produkt am Boden entsteht. Eine anschließende Untersuchung des entstehenden Gases mit Kalkwasser zeigt eine Trübung des Kalkwassers.
S:
2CuO + C ---> 2Cu + CO2 +E
=> Es liegt eine Redoxreaktion vor, da Sauerstoff zwischen Kupfer und Kohlenstoff ausgetauscht wird. Kohlenstoffdioxid kann man in einem Bestätigungsexperiment durch den Kalkwassertest nachweisen.
Aufgaben:
- Formuliere die Reaktionsgleichung, die kennzeichnend für die Eisenzeit ist
- Welche Gefahr besteht beim Erhitzen des Glasrohrs, wenn es mit Wasserstoff durchflutet wird?
- Bestimme das Oxidationsmittel und das Reduktionsmittel der Reaktion aus dem Versuch zur Kupferherstellung.
- Löse die Reaktionsgleichungen und bestimme, ob eine Redoxreaktion vorliegt:
CO2 + 2Mg ---> C + 2MgO + E
H2O + Mg ---> H2 + + E
CuO + Fe --->
PbO + C --->
Informationen zur Bronzezeit
In dieser Periode begannen die Menschen erste Werkzeuge aus Bronze herzustellen. Dazu war Kupfer notwendig, welches sie aus Kupferoxid gewonnen hatten. Der Beginn dieses wichtigen Zeitabschnittes war ab ca. 10000- 8000J v. Chr. in China.
In Europa begann die Bronzezeit viel später:
Frühe Bronzezeit (17.-16.Jh. v. Chr.)
Mittlere Bronzezeit (15.-13.Jh. v. Chr.)
Späte Bronzezeit (12.-9. Jh. v. Chr.)
Bronze war das wichtigste Rohmaterial v. a. für Schmuckgegenstände und Waffen. Für die Herstellung der Bronze brauchte man Kupfer (Bronze = Kupfer (60%) Zinn und manchmal etwas Zink). Die Metalle werden dabei im flüssigen Zustand miteinander vermischt. Ein solches Gemisch von Metallen nennt man Legierung.
Das Wort Kupfer kommt übrigens vom Wort Zypern, da wahrscheinlich dort, die erste europäische Produktion begann. Viele Jahrtausende vorher konnten allerdings schon die Chinesen Bronze herstellen.
Weitere frühe Funde stammen aus Anatolien und Ägypten. Dort wurde Kupfererz schon vor 6000 v. Chr. verhüttet. In Mitteleuropa ist die Verarbeitung von Kupfererz seit etwa 3000 v. Chr. bekannt.
Abgelöst wurde die Bronzezeit durch die Eisenzeit, in der Bronze zwar weiterhin für Kult- und Alltagsgegenstände verwendet, in der Technik und Waffenherstellung aber vom Eisen verdrängt wurde.
Die Erfindung der Bronze führte auch zu Fortschritten in Handel und Seefahrt. Schließlich mussten nun Waren, aber auch die Rohstoffe transportiert werden. Es bildeten sich in dieser Periode wichtige Städte an Flüssen und am Meer. Es entstanden viele neue Häfen. Dies führte zu einer Entwicklung der Kulturen im größten Teil Europas, in Teilen Nord Afrikas und in vielen Teilen Asiens.
Heute weiß man darüber einiges, da man viele historische Funde untersucht und genau datiert hat. Zu den Funden gehören Schmuckstücke (Armringe, Ketten, Schnallen, Nadeln), Waffen (Messer, Dolche, Äxte, Pfeilspitzen, Schwerter).
Zusatzinformationen:
https://de.wikipedia.org/wiki/Bronzezeit
Kupferkessel rosten nicht
Sie sind deshalb gut zur Lagerung und zur Produktion von Lebensmittel geeignet.

Kupferkessel zur Bierherstellung im Brauhaus
Bei der Bierherstellung entstehen große Mengen an Kohlenstoffdioxid. Damit das Gas nicht die Apparatur beschädigt, muss diese besonders stabil sein. Üblicherweise lässt man das Bier in einem solchen Kupferkessel gären.
Weitere Redoxreaktionen
Kann man ein „Recycling“ von Kohlenstoffdioxid zu Grillkohle nach dem Grillen durchführen?
V1: Verbrennung von Magnesium in CO2 bzw. in Luft.
B: Schwarzer Feststoff, weißer Feststoff, Magnesium brennt in beiden Gasen.
S:
CO2 + 2Mg ---> C + 2 MgO +E
O2 + 2Mg ---> 2 MgO +E
V2: Reaktion von Bleioxid (PbO) mit Kohlenstoff.
B: Es bildet sich ein metallisch glänzender Feststoff, überschüssiger Kohlenstoff schwimmt auf dem Wasser.
S: Es entsteht das Element Blei:
2PbO + C + E ---> 2Pb + CO2 + E
Aufgaben:
1. Erstelle die folgenden Reaktionsgleichungen, kennzeichne Oxidation und Reduktion
Mg + H2O --->
Mg + CO2 --->
H2 + O2 --->
CuO + Zn --->
CuO + Mg --->
2. Bei der zweiten Reaktion, der Gewinnung von aus Bleioxid kann auch das giftige Kohlenstoffmonooxid entstehen. Erstelle dazu die passende Reaktionsgleichung und erkläre, wie es zu dieser Reaktion kommen kann.
1 Es wurde Malachit verwendet (Cu2(OH)2CO3), welches beim Erhitzen in Kupferoxid überging.
Eisen, das wichtigste Metall
- Eisen kommt nicht elementar (gediegen) vor, sondern nur vereinigt als Erz (z.B. mit Sauerstoff).
- Eisen ist zusammen mit Nickel vermutlich der Hauptbestandteil des Erdkerns.
- Mit einem Anteil von ca. fünf Prozent ist Eisen aber auch eines der häufigsten Elemente der Erdkruste.
- Eisen ist das zehnthäufigste Element im Universum.
- Eisenerz wird im Tagebau (Brasilien, Australien, China u.a.) und Untertagebau (Deutschland, Frankreich u.a.) gewonnen.
- Eisen ist mit 95% das weltweit am häufigsten genutzte Metall.
- Wenn Eisen oxidiert, bildet es keine feste Schutzschicht, sondern das spröde Eisenoxid. Der dabei entstehende Rost zerstört Eisen vollständig. So gehen jährlich viele 1000t Eisengegenstände verloren.
- Stähle sind Legierungen des Eisens, die beim Vermischen (= legieren) mit anderen Metallen und auch Nichtmetallen (insbesondere Kohlenstoff) entstehen.
- Eisen ist eines der drei ferromagnetischen Metalle (Kobalt und Nickel sind die Übrigen).
- Obwohl Eisen ein wichtiges Spurenelement für den Menschen ist, kann zu viel Eisen im Körper giftig sein.
- In der Natur kommt Eisen (fast) nie gediegen (d.h. als Element) vor.
Bekannte Eisenverbindungen sind:
- Fe2O3 sowie FeO (Eisenoxid)
- Fe3C (Eisencarbid)
- Fe(CO)5 (Eisencarbonyl) sowie Fe2(CO)9
- Fe(SCN)3 (Eisen(III)-thiocyanat, Eisenrhodanid)
Zusatzinformationen:
https://de.wikipedia.org/wiki/Eisen
Die Eisenzeit
In Mitteleuropa begann die Eisenzeit etwa ab dem 8. Jahrhundert v. Chr. Tatsächlich begann sie aber schon vorher in Anatolien ca. 1200 v. Chr. Die Methode zur Reduktion des Eisenoxids verbreitete sich von dort nach Indien, China und den Mittelmeerraum. Über Italien gelangte das Wissen dann endlich nach Nordeuropa.
Zu dieser Zeit entdeckten die Menschen einen Weg, Eisenoxid zu reduzieren, um daraus Eisen für Werkzeuge und Waffen herzustellen. Der Vorteil gegenüber der Bronze war die bessere Verfügbarkeit des Oxids. Kupferoxid ist im Boden seltener zu finden.
Zur Eisengewinnung kann man z.B. die beiden bekannten Eisenerze FeO (grün) und Fe2O3 (rot) verwenden. Kohlenstoff wurde als Reduktionsmittel, genau wie bei der Kupfergewinnung, verwendet:
2FeO + C ---> CO2 + 2Fe + E
2Fe2O3 + 3C ---> 3CO2 + 4Fe + E
Die Eisenzeit ist nach der Steinzeit und der Bronzezeit die dritte wichtige Periode der Menschheitsgeschichte. In Europa und dem Mittelmeerraum folgte darauf die Epoche der Antike oder die Völkerwanderungszeit.
Zusatzinformationen:
https://de.wikipedia.org/wiki/Eisenzeit
Die Thermitreaktion
Material: Blumentopf, Alufolie, Magnesiumpulver, Magnesiumband (oder eine Wunderkerze), Aluminiumpulver, Aluminiumgrieß, totes Eisenoxid
Diese Reaktion dient dazu, Eisen aus Eisenoxid herzustellen. Der Reaktionspartner ist dabei das unedlere Aluminium. Diese Reaktion ist so stark exotherm, dass man mit höchster Vorsicht arbeiten und dringend eine feuerfeste Unterlage benutzen muss.
V: Mischen von 15g Fe2O3 und 5g Al-Grieß (oder Pulver). Das Gemisch gibt man in einen Blumentopf, in welchem eine Toilettenpapierrolle steht. Der Rand wird mit Sand gefüllt. Auf das Gemisch gibt man etwas Magnesiumpulver und zündet alles mit einem Magnesiumband oder einer geeigneten Wunderkerze an.
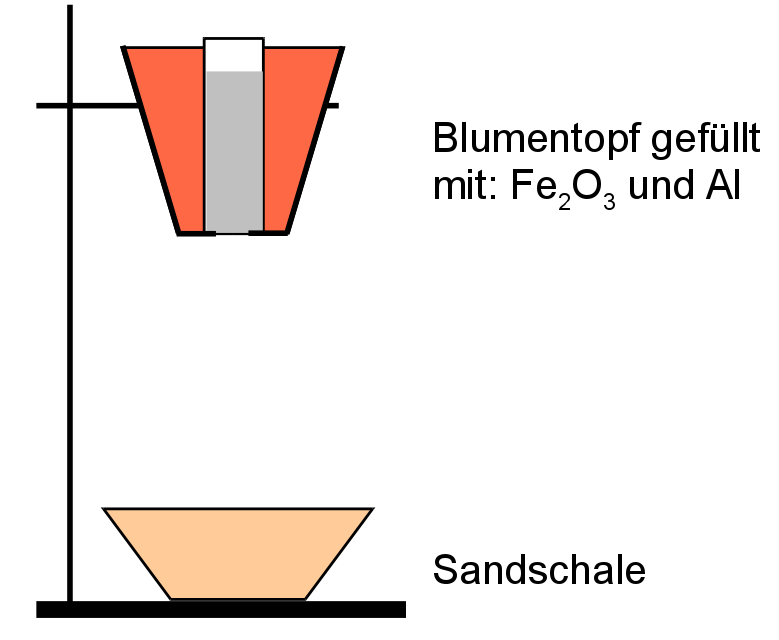
B: Heftige Reaktion mit heller Flamme, Funken, sehr heißes, rot glühendes, flüssiges Produkt, welches magnetisch ist.
S: Bei der Reaktion von Eisenoxid mit Aluminium entsteht Eisen. Dabei werden sehr große Energiemengen frei. Diese Reaktion wird z.B. zum Schweißen von Eisenbahnschienen verwendet.
Fe2O3 + 2Al ---> Al2O3 + 2Fe +E
Industrielle Eisengewinnung im Hochofen
Bei der Thermitreaktion entsteht stark verunreinigtes Eisen. Es ist durchzogen mit Resten von Aluminiumoxid. Außerdem wäre Aluminium ein sehr teurer Reaktionspartner, um Eisen herzustellen. Großtechnisch gibt es deshalb einen anderen (besseren und vor allem preiswerteren) Weg, große Eisenmengen herzustellen. Die dazu notwendige Industrieanlage nennt sich Hochofen. Ein solcher Hochofen ist ein ca. 30 m hoher Schacht, in dem Eisen durch Reduktion aus Eisenoxid gewonnen wird.
Die eigentliche Reduktion findet vor allem im unteren Teil statt, deshalb muss der Hochofen von oben, schichtweise mit Koks und Möller (dem Gemisch aus Eisenoxid und Kalk) gefüllt werden. Diese Ausgangsstoffe werden in Förderkübeln (sogenannten Hunten) über einen Schrägaufzug zur oberen Öffnung des Hochofens befördert und entleert.
Im unteren Teil finden nun die folgenden Redoxreaktionen statt:
1. Verbrennung des Koks (liefert Verbrennungsenergie): C + O2 ---> CO2 + E
2. Erzeugung des Reduktionsmittels (=Kohlenstoffmonoxid): CO2 + C ---> 2CO + E
3. Reduktion des Eisenoxids zu elementarem Eisen: Fe2O3 + 3CO ---> 3CO2 + 2 Fe + E
Das entstandene Roheisen fließt durch eine Öffnung im unteren Teil aus dem Hochofen (=Abstich). Das sehr heiße und flüssige Roheisen fließt nun durch Rinnen im Boden zur Weiterverarbeitung.
Im Hochofen befindet sich nun noch die etwas leichtere Schlacke (diese hat eine geringere Dichte als Eisen und schwimmt im Hochofen darüber). Sie ist ein recht wertvoller Rohstoff und kann für weitere Produkte verwendet werden.
Mögliche Eisenerze als Ausgangsstoffe:
- FeO Eisenoxid, auch Magnetkies genannt
- Fe2O3 Hämatit (=Roteisenstein)
- Fe3O4 Magnetit
- FeCO3 Siderit (=Eisenspat oder auch Spateisenstein genannt)
- FeS2 Pyrit (Eisenkies bzw. Katzengold genannt)
Wozu ist eine so große Anlage notwendig? Brauchen wir alle denn soviel Eisen?
Ja, man kann leicht den Jahresverbrauch eines Landes durch die Anzahl der Einwohner teilen und stellt fest, dass jeder Mensch in Deutschland pro Jahr mehr als 100 kg Eisen „benötigt“. Dies wird natürlich nicht nur für Dinge des Haushalts verwendet, sondern auch für Autos, Brücken, Autobahnleitplanken usw.
Veredelung des Roheisens
Im Hochofen entsteht Roheisen. Der Reaktionspartner des Eisenoxid ist hierbei Koks (ausgeglühte Steinkohle). Als Konsequenz enthält das entstehende Roheisen 4-5 Prozent Kohlenstoff als Verunreinigung und ist dadurch recht spröde. Will man eine bessere Qualität erreichen, muss man das Roheisen veredeln.
Gusseisen enthält 2 - 6,5% Kohlenstoff und weitere Legierungselemente, wie beispielsweise Silizium und Mangan. In Abhängigkeit von der Abkühlgeschwindigkeit liegt der Kohlenstoff im Gusseisen als Carbid oder elementar als Graphit vor. Gusseisen ist sehr hart und spröde. Es lässt sich gewöhnlich nicht verformen. Es wird z.B. verwendet für Gullideckel.
Durch das Windfrischen, einen Vorgang zur Veredlung mit Sauerstoff. In das flüssige - sehr heiße - Roheisen wird heißer Sauerstoff geblasen. Durch die hohen Temperaturen oxidiert das Roheisen nicht! Stattdessen oxidiert der restliche Kohlenstoff zu Kohlenstoffdioxid, welches als Gas entweicht.
Das Roheisen enthält nun nur noch ca. 0,1% - 2% Kohlenstoff und wird nun Stahl genannt. Stahl ist qualitativ wesentlich hochwertiger und haltbarer und im Vergleich zu Gusseisen ist er biegsamer und verformbarer. Meist werden noch weitere Zusätze aus Chrom und Nickel zugefügt (Cr-Ni-Stahl-Legierung („Nirosta“)), um ihn noch härter und vor allem Rostfrei zu machen.
Aufgaben zum Thema Hochofen:
1. Die Außenwand des Hochofens muss durch eine Wasserkühlung permanent gekühlt werden.
Die Arbeiter in der Hochofenhalle müssen Schutzanzüge tragen, da es dort heißer als 50°C ist.
a) Warum ist der Hochofen so heiß?
b) Welche Konsequenzen hat das für die Arbeiter?
c) Warum wird der Hochofen nicht Nachts abgeschaltet?
2. Erkläre, warum der Hochofen eine nach oben auslaufende Form hat.
3. Mittlere Hochöfen haben eine Tagesproduktion von ca. 6.000t Roheisen, große Hochöfen schaffen sogar mehr das Doppelte. Ein Hochofen ist mindestens 10 Jahre ununterbrochen in Betrieb.
a) Berechne die Menge an Roheisen, die in 10 Jahren entsteht.
b) Wozu braucht man soviel Roheisen?
Zusatzinformationen:
Übersicht über die Vorgänge im Hochofen: https://de.wikipedia.org/wiki/Bild:Hochofenprozess.PNG
- https://de.wikipedia.org/wiki/Hochofen
- https://de.wikipedia.org/wiki/Hochofen
- https://de.wikipedia.org/wiki/Koks
- https://de.wikipedia.org/wiki/Gicht_%28Hochofen%29
- https://de.wikipedia.org/wiki/Eisen
- https://de.wikipedia.org/wiki/Stahl
Im Labor kann man den Hochofenversuch simulieren:
V: In einem Glasrohr werden Eisenoxid (pulvriges Eisen) und gekörnter Aktivkohle gefüllt. Das Rohr wird von außen erhitzt und mit einem Fön durchgepustet.
B: Aufglühen, das rote Eisenoxid wird dunkel.
S: Die Kohle verbrennt unvollständig. Es entsteht das giftige Gas Kohlenmonoxid. Das Eisenoxid reagiert mit dem Kohlenmonoxid zu Eisen.
Zusammenfassende Reaktion: Fe2O3 + 3 CO ---> 2 Fe + 3 CO2 + E
Der Hochofen von Hattingen



Der Hochofen von außen, die Anlage zum Windfrischen, der obere Abschnitt zur Füllung des Hochofens


Warnschild für Mitarbeiter und Besucher, äußere Umbauung mit Kühlsystem
Der Abstich
Wenn genügend Eisen entstanden ist, muss in den unteren Verschluss des Hochofens per Abstich ein Loch gestoßen werden, durch das das heiße Roheisen in einer Rinne hinaus fließt. Die Temperaturen vor dem Ofen sind in dem Moment über 1000°C heiß. Für Menschen, selbst in gekühlten Schutzanzügen, unerträglich.


Hochofen am Hafen von Piombino


Der Hochofenprozess
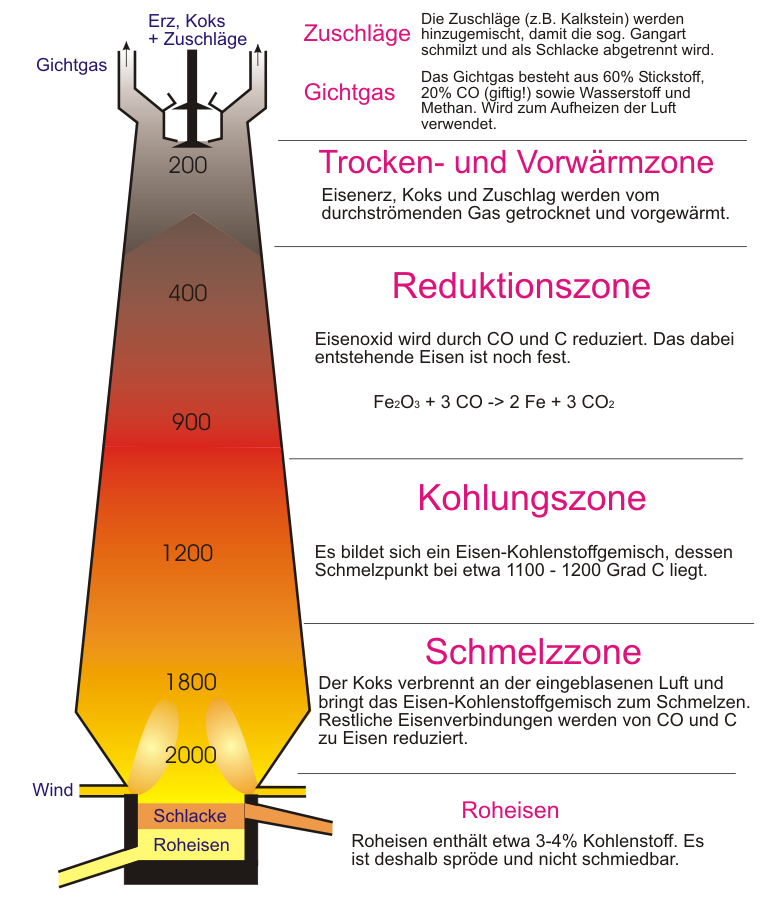
Quelle Bild: GNU Free Documentation License, Version 1.2 by Wikipediauser Maksim, Andreas Schmidt - https://commons.wikimedia.org/wiki/Image:Hochofenprozess.PNG
Der Aufbau und die Temperaturzonen im Hochofen
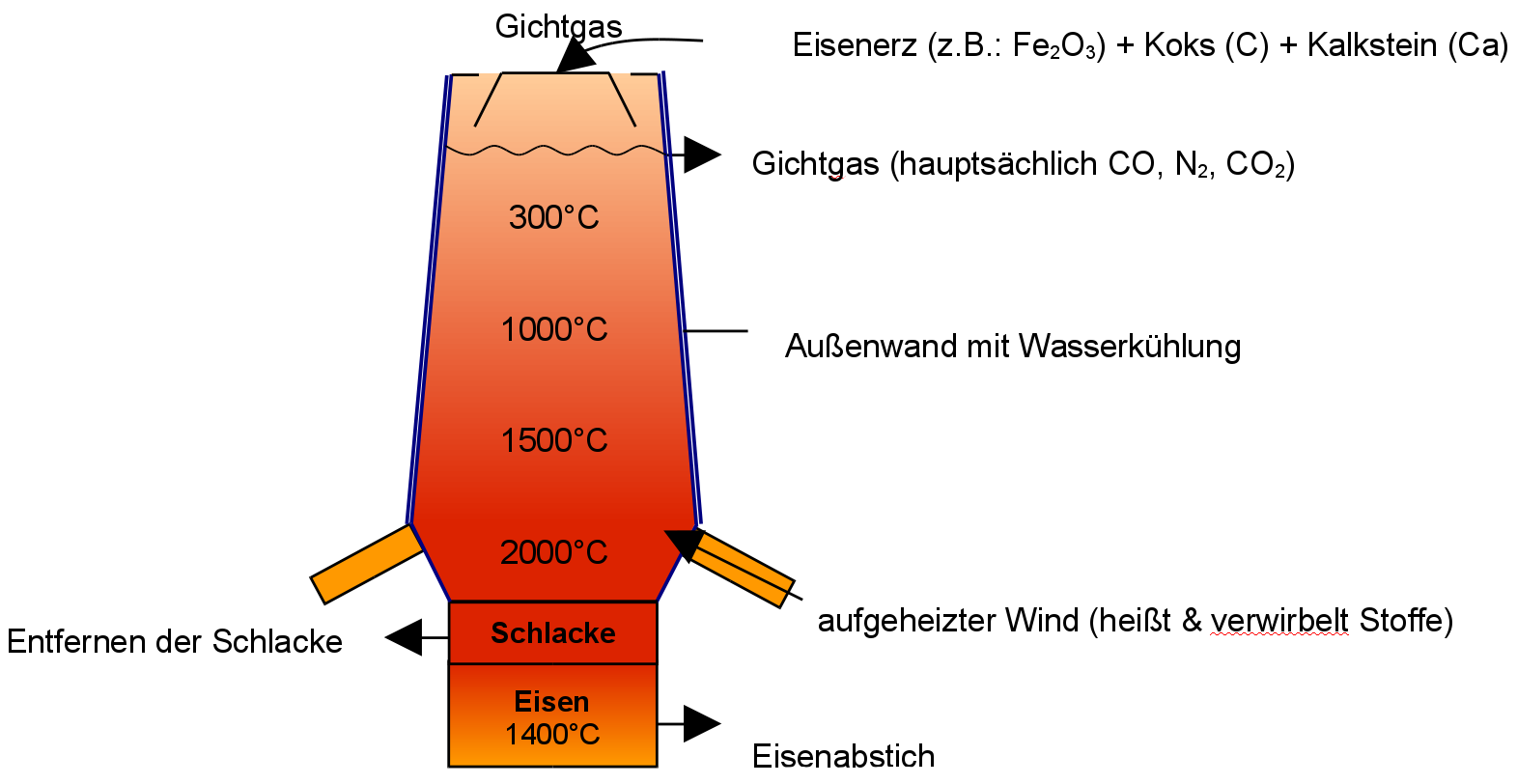
Ein Hochofen ist eine bis zu 40m hohe Industrieanlage, in der Eisen aus Eisenoxid gewonnen wird. Er wird von oben mit Förderbändern oder mit so genannten „Hunten“, das sind Metallwagen auf Schienen, gefüllt. Dazu wird ein Gemisch Eisenoxid und Koks (dem Reduktionsmittel) und Kalk zur Auflockerung gebildet. Dieses Gemisch wird auch Möller genannt.
In oberen kälteren Regionen reagiert Fe2O3 in geringer Hitze zu dem Zwischenprodukt Fe3O4, welches aufgrund seiner höheren Dichte weiter absinkt. Weiter unten ist es durch die ablaufenden Redoxreaktionen und durch zugeführte heiße Luft viel heißer. Hier findet die Umwandlung von Fe3O4 zu einem weiteren Zwischenprodukt satt (FeO). Dies hat eine noch höhere Dichte und es sinkt noch weiter ab. Im heißesten Bereich finden dann die Hauptreaktion statt, bei der aus Kohlenmonoxid und Eisenoxid dann Kohlenstoffdioxid und Roheisen entstehen. Aufgrund seiner hohen Dichte sammelt sich das Roheisen am Boden des Hochofens (darauf schwimmt nur noch die Schlacke aus Kalk und Erzresten, welche alle eine geringere Dichte als Roheisen haben).
Das Roheisen wird dann durch eine Keramiköffnung regelmäßig entnommen. Man lässt es über Rinnen im Boden der Abstichhalle fließen.
Die als Abfallprodukt entstehende Schlacke ist ein wichtiger und auch wertvoller Rohstoff. Sie dient beispielsweise als einfacher Zement, auch Hüttenzement genannt.
Genaue chemische Reaktionen im Hochofen
1. Schritt: Vorbereitung - Herstellung des CO
a) C + O2 ---> CO2 + E
b) C + CO2 ---> 2CO + E
2. Schritt:
Fe2O3 + CO ---> 2FeO + CO2 + E
3. Schritt
FeO + CO ---> Fe + CO2 + E
2. und 3. Schritt zusammengefasst: Fe2O3 + 3CO ---> 3CO2 + 2 Fe + E
Zusatzinformationen:
https://de.wikipedia.org/wiki/Hochofen
https://de.wikipedia.org/wiki/Gichtgas
Energiebeteiligung bei chemischen Reaktionen
V: Zink reagiert mit Schwefel in einer Zinkrinne.
B: - Selbstständiges, heftiges Durchglühen des Reaktionsgemisches
- Rauchbildung
- Das Produkt ist ein weißer Feststoff
S: Zink vereinigt sich mit Schwefel zu Zinksulfid unter Energiefreisetzung.
0 0 +II -II
Zn + S ---> ZnS + E
Bei jeder chemischen Reaktion spielt die Umwandlung von Energie eine Rolle. Entweder wird Energie freigesetzt, die z.B. vorher in den Ausgangsstoffen enthalten war, oder Energie wird zum Ablauf der Reaktion benötigt und somit dem System entzogen.
Als Beispiel dient uns nun die Verbrennung von Zucker, bzw. die Bildung von Zucker in der Photosynthese, die eigentlich genau die gleiche Reaktion ist, nur genau rückwärts. Man nennt solche Reaktionen „Rückreaktion“.
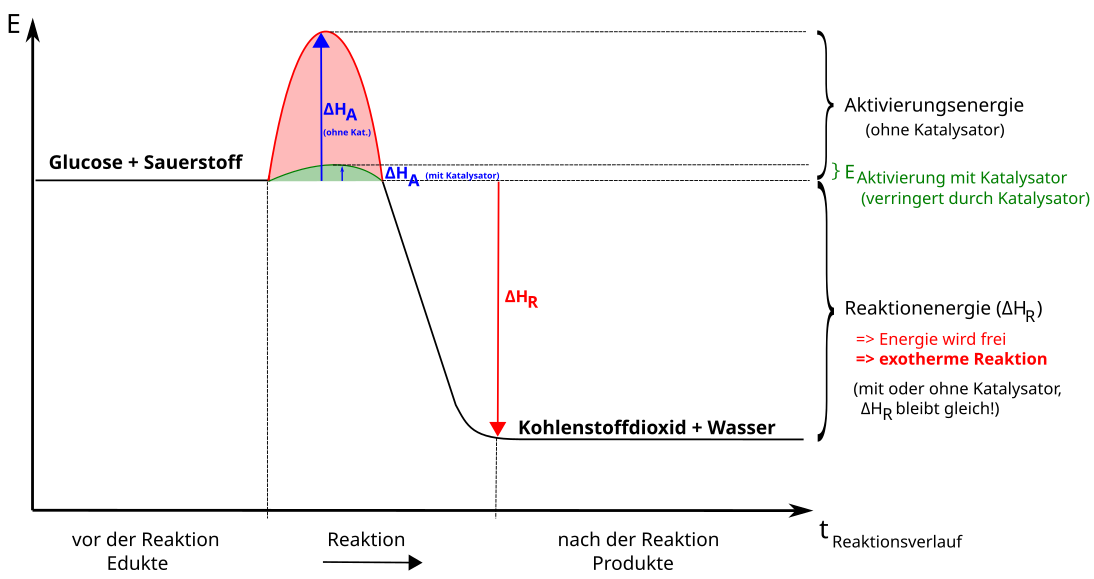
a) Energiediagramm der exothermen Reaktion
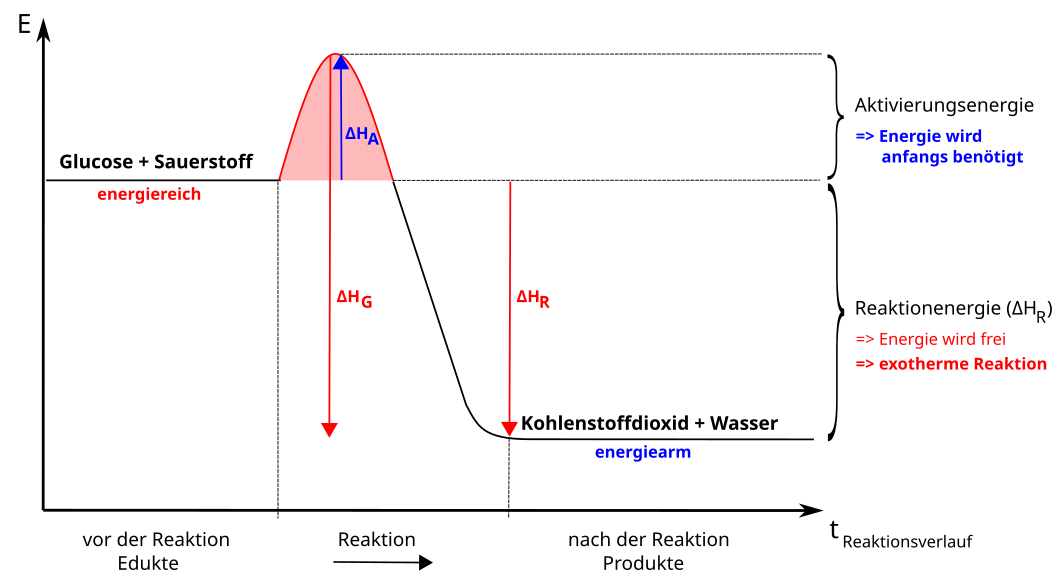
Energiediagramm exotherme Reaktion
Aktivierungsenergie (ΔHA), notwendig zum Auslösen der Reaktion (manchmal auch ΔEA genannt).
Reaktionsenthalpie (ΔHR), Energieüberschuss, der bei exothermen Reaktionen frei wird (= ΔEG).
Gesamt freiwerdende Energie (ΔHG)
Traubenzucker (Glucose) ist ein sehr energiereicher Stoff. Wenn wir ihn essen gibt er uns diese Energie ab und wir atmen Kohlenstoffdioxid und Wasser aus.
Genauso energiereich reagieren Holz, Erdgas und Benzin bei der Oxidation mit Sauerstoff (z.B. beim Verbrennen).
b) Energiediagramm der endothermen Reaktion
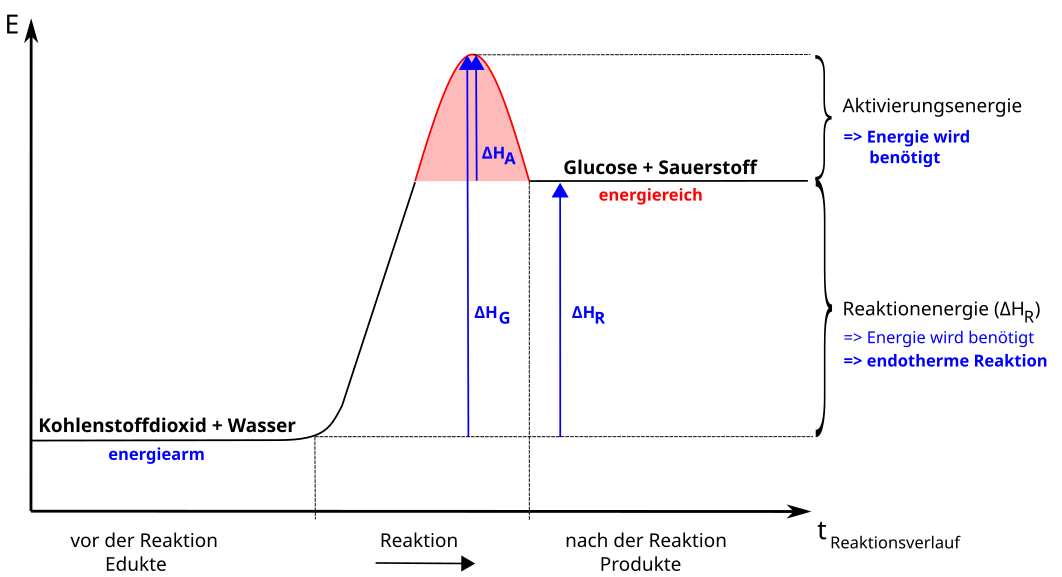
Energiediagramm endotherme Reaktion
Wie man sieht, ist der Verlauf bei energiearmen Stoffen umgekehrt. Es startet mit energiearmen Verbindungen, die durch die Reaktion Energie aufnehmen und so zu energiereichen Verbindungen werden.
Ein Beispiel wäre hierfür die Photosynthese. Bei dieser wird durch energiereiches Sonnenlicht aus Kohlenstoffdioxid und Wasser energiereicher Traubenzucker (Glucose) gebildet.
Ein anderes Beispiel, welches Du schon kennst, ist die Wasserzersetzung in Wasserstoff und Sauerstoff. Wasser ist sehr energiearm, der entstehende Wasserstoff aber sehr energiereich. Diese Reaktion benötigt als besonders viel Energie!
Generell sind alle Elektrolysen endotherme Reaktionen.
Merke: Endotherme Reaktionen laufen oft nicht freiwillig ab.
Chemische Reaktionen, die unter Energieabgabe ablaufen heißen exotherme Reaktionen.
Die freiwerdende Energie kann dabei als Wärme, Licht oder in anderen Formen vorliegen.
Chemische Reaktionen, bei denen ständig Energie zugeführt werden muss,
damit sie überhaupt ablaufen nennt man endotherme Reaktionen.
Beispiele für endo- und exotherme Reaktionen
|
exotherme Reaktionen |
endotherme Reaktionen |
|
Verbrennungen (Kohle, Magnesium usw.) |
Erhitzen von Kaliumnitrat |
|
Entzündung von Schwefel-Eisen-Gemisch |
Zersetzung von Quecksilberoxid |
|
Neutralisation |
Zersetzung von Wasser |
|
Magnesium mit Salzsäure |
|
|
Neutralisation |
Der Katalysator
V: Verbrennung von Zucken mit und ohne Braunstein (Asche)
|
V |
B |
S |
|
Entzünden von Zucker |
Karamellisation |
=> Änderung des Aggregatzustandes |
|
Entzünden von Zucker-Braunstein Gemisch |
Zucker brennt |
Aufstellen der Gleichung mit Wertigkeiten / Oxidationszahlen: 0 +I -II 0 IV -II I -II
|
Energiediagramm einer Katalyse
Energiediagramm, mit und ohne Katalysator
Ein Katalysator ist ein Stoff, der die Aktivierungsenergie einer Reaktion herabsetzt (er hilft sozusagen über den Energieberg). Er nimmt an der Reaktion teil, geht aber am Ende unverändert aus ihr hervor (er nimmt dann von neuem an der Reaktion teil).
Die Reaktionsenergie wird nicht verändert.
Dadurch wird die Reaktionsgeschwindigkeit erhöht.
Zusatzinformationen:
https://de.wikipedia.org/wiki/Katalyse
Entscheide bei folgenden Reaktionen, ob es sich um einen exo- oder endothermen Vorgang handelt!
- Beim Entladungsvorgang einer Autobatterie werden Bleiverbindungen verändert, und elektrische Energie wird abgegeben.
- Holz wird zum Heizen von Häusern verwendet.
- Der Mensch und viele Wirbeltiere sind gleichwarm: Die Körpertemperatur bleibt aufgrund der chemischen Umsetzung von Nährstoffen (hauptsächlich Kohlenhydrate) und Sauerstoff bei der Atmung konstant.
- Die Explosionen in Verbrennungsmotoren werden in mechanische Energie umgewandelt.
- Bauxit enthält einen großen Prozentsatz an Aluminiumoxid. Die Gewinnung von Aluminium wird stets dort durchgeführt, wo billige elektrische Energie zur Verfügung steht.
- Quecksilberoxid lässt sich durch Erhitzen in Quecksilber und Sauerstoff zerlegen. (Zersetzung)
- Pflanzen speichern bei der Photosynthese Sonnenenergie in chemischer Form in energiereichen Verbindungen (Traubenzucker, Sauerstoff).
- Eine starke Säure einer Autobatterie wird zum Entsorgen neutralisiert
Übung: Reduktions- und Oxidationsvermögen von Metallen I
Material: je Gruppe: Bunsenbrenner, Reagenzglasklammer, 2 Reagenzgläser
Führe diese Versuche nicht außerhalb des Chemieunterrichts durch!
Sie sind sehr gefährlich und unberechenbar!
Kann man eigentlich durch das pure stattfinden von Reaktionen beurteilen, ob ein Metall edler oder unedler als ein anderes ist? Führe dazu die folgenden beiden Versuche durch und entscheide, welches der beiden Elemente edler ist.
|
V |
B |
S |
|
Mische 1,6 g schwarzes CuO-Pulver und 0,8 g Fe-Pulver. Erhitze das Gemisch im Reagenzglas bis zum ersten Aufglühen und entferne das Reagenzglas sofort aus der Brennerflamme!] SCHUTZBRILLE
|
Das Gemisch glüht nach dem Reaktionsstart selbständig durch, Farbänderung des Reaktionsgemisches von schwarz zu rot, Magnettest negativ |
3CuO + 2Fe ---> 3Cu + Fe2O3 +E Kupfer ist edler als Eisen und deshalb gibt CuO leicht seinen Sauerstoff ab => Cu ist ein gutes Oxidationsmittel |
|
Erhitzen von Cu mit Fe2O3 (Durchführung wie oben) (In welchem Verhältnis müssen die Chemikalien abgewogen werden?) |
(keine Reaktion) |
Da Kupfer edel ist, wird es nicht so leicht oxidiert - schon gar nicht von einem Oxid eines unedleren Elements! |
Oxidationsmittel: CuO (wird bei Redoxreaktion reduziert)
Reduktionsmittel: Fe (wird bei Redoxreaktion oxidiert)
Eisen ist Reduktionsmittel für Kupferoxid, Eisenoxid aber nicht für Kupfer1.
=> CuO ist Ox-Mittel für Eisen, Cu aber nicht für FeO
=> Der edlere Stoff lässt sich „schwerer“ oxidieren und ist eher bereit seinen Sauerstoffabzugeben
=> Kupfer ist edler als Eisen
Red-Vermögen nimmt zu
<-------------------------------
Fe Cu
Fe2O3 CuO
------------------------------->
Ox-Vermögen nimmt zu
Reduktions- / Oxidationsvermögen einiger Metalle und Nichtmetalle II
Wie kann man nun weitere Metalle/ Metalloxide in diese Reihe von edlen und unedlen Metallen einordnen (und wie geht man experimentell dabei am einfachsten vor?).
Führe diese Versuche nicht außerhalb des Chemieunterrichts durch!
Sie sind sehr gefährlich und unberechenbar!
|
V |
B |
S |
|
ZnO + Cu |
keine Reaktion |
Kupfer ist edler als Zn. Aus diesem Grund kann Kupfer nicht das Zinkoxid reduzieren.
|
|
CuO + Zn |
heftige Reaktion, Kupferbildung, Funken |
Das unedle Zn entreißt dem Kupfer den Sauerstoff CuO + Zn ---> ZnO + Cu + E
|
|
CuO + Mg (nie im Reagenzglas, explodiert! Auf feuerfester Unterlage mit Glimmspan zünden (evtl. mit Brenner - Augen schützen - Lichtblitz!)) |
sehr heftige Reaktion |
Mg ist sehr unedel und entreißt dem CuO augenblicklich den Sauerstoff CuO + Mg ---> MgO + Cu + E
|
|
Fe2O3 + Mg (genauso heftig!) |
sehr heftige Reaktion |
Fe2O3 + 3Mg ---> 3MgO + 2Fe + E |
|
Mg mit ZnO (genauso heftig!) |
sehr heftige Reaktion |
ZnO + Mg ---> MgO + Zn + E |
|
Vorherige Stunden: Fe2O3 + Al |
heftige Reaktion |
Fe2O3 + 2Al ---> 2Fe + Al2O3 + E
|
|
CuO + Fe |
mittelstarke Reaktion |
3CuO + 2Fe ---> 3Cu + Fe2O3 +E |
|
Bonus-Experiment zur Hilfe: Mg + Al2O3
|
mittelstarke Reaktion |
3Mg + Al2O3 ---> 3Al + 3MgO + E |
Aufgaben:
1. Stelle zuerst die kompletten Reaktionsgleichungen auf und bestimme dann die Reihenfolge der Metalle nach edlem und unedlem Charakter.
Reduktionsvermögen nimmt zu
<-------------------------------------------------------------
Reduktionsmittel: Mg Zn Al Fe Cu
Oxidationsmittel: MgO ZnO Al2O3 Fe2O3 CuO
------------------------------------------------------------->
Oxidationsvermögen nimmt zu
Aufgabe:
1. Ordnen Au, Ag in diese Reihenfolge ein. Da Du keine Messwerte hast, überlege Dir aus Deinen Erfahrungen, wo sie stehen könnten.Reduktionsvermögen verschiedener Metalle
Folgende Reaktionen finden durch einfaches Entzünden statt. Ihre Umkehrreaktionen hingegen lassen sich auf diesem Wege nicht durchführen!
Aufgaben:
1. Stelle zuerst die kompletten Reaktionsgleichungen auf, kennzeichne dann Oxidation und Reduktion.
2. Vervollständige: unedle Metalle reagieren mit Oxiden edler Metalle als …...............................
3. Bestimme die Reihenfolge der Metalle nach edlem und unedlem Charakter: Notiere Deine Lösung dann in diesem Schema:
Reduktionsvermögen nimmt zu
<-------------------------------------------------------------
Reduktionsmittel:
Oxidationsmittel:
------------------------------------------------------------->
Oxidationsvermögen nimmt zu
Wiederholungsfragen für Zuhause & das Schwimmbad
Verschwenderisch leichte Wiederholungsfragen zum Aufwärmen
- Wiederhole die Elementsymbole. Erstelle dann eine Übersicht über alle Elemente, die auf „-stoff“ enden.
- Beschreibe, was man erhält, wenn man Säure und Lauge gleicher Konzentration mischt. Wie nennt man diese Reaktion? Was ist bei deren Durchführung zu beachten?
- Nenne sechs Säuren und drei Laugen mit Formel und nenne deren Säurereste.
- Was sagt der Massenerhaltungssatz aus? Was sagt der Energieerhaltungssatz aus?
- Stelle die Reaktionsgleichung der Bildung folgender Stoffe auf: Fe2O3 ; Schwefeldioxid ; Schwefeltrioxid ; P4O10. Welcher Stoff entsteht, wenn man Phosphoroxid und Wasser mischt?
- Welcher Stoff entsteht, wenn man Kohlenstoffdioxid und Wasser mischt?
- Stickstoffdioxid reagiert mit Wasser zu Salpetersäure und Salpetriger Säure. Erstelle die Reaktionsgleichung.
- Welche Aussagen treffen folgende Reaktionsgleichungen?
- N2 + 3 H2 + E ---> 2 NH3
- CH4 + 3 O2 ---> CO2 + 2 H2O + E
- Stelle die Reaktionsgleichung der Bildung von Fe2O3 auf.
- Was sagt das Gesetz der vielfachen Massenverhältnisse aus? Worin liegt die Erweiterung des Gesetzes der vielfachen Massenverhältnisse im Vergleich zu den konstanten Massenverhältnissen?
- Stelle die Reaktionsgleichung der Bildung von SO3 auf.
- Welcher Stoff entsteht, wenn man Stickstoffdioxid (bzw. Kohlenstoffdioxid) und Wasser mischt?
- Was sagt der Massenerhaltungssatz / Energieerhaltungssatz aus?
- Was ist der Unterschied zwischen Sauerstoff und Luft?
- Was versteht man unter Edelgaskonfiguration.
- Was bedeutet 73Li ?
- Stelle die folgenden Gleichungen auf:
-
Salzsäure
+
Calciumlauge
--->
Wasser
+
Calciumchlorid
+
E
Zink
+
Salzsäure
--->
Zinkchlorid
+
Wasserstoff
+
E
Magnesium
+
Salzsäure
--->
Magnesiumchlorid
+
Wasserstoff
+
E
Stickstoffdioxid
+
Wasser
--->
Salpetersäure
+
Stickstoffmonoxid
+
E
Kohlenstoffmonoxid
+
Wasserstoff
--->
Methan (CH4 )
+
Wasser
+
E
Benzin (C8H18)
+
Sauerstoff
--->
Wasser
+
Kohlenstoffdioxid
+
E
- Fe verbrennt mit Schwefel unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis.
- Schwefel verbrennt an der Luft mit blassblauer Flamme, wenn der Schwefel in reinem Sauerstoff verbrennt, leuchtet er blau und es entsteht ein weißer Feststoff. Stelle die zwei Reaktionsgleichungen auf und bestimme die Massenverhältnisse.
- Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis N:O = 7/8. Bestimme die Formel des entstehenden Gases.
- Auch Gase haben ein Gewicht. 2g Wasserstoff und 16g Sauerstoff vereinigen sich beim Entzünden mit einem lauten Knall. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Gramm Wasserstoff braucht man für 12g Sauerstoff?
- Bei einem Versuch reagieren 140g Eisen mit 80g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Schwefel braucht man für 105g Eisen?
- Eisen verbrennt mit Schwefel unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis.
Tipp: schau Dir noch einmal gut alle Inhalte des ersten Halbjahres und die wichtigen Themen der 8. Klasse an! Vor allem, wenn Du unsicher mit Reaktionsgleichungen bist, löse noch einmal einige Gleichungen von den 3 Reaktionsgleichungs-Arbeitsblättern.
Kapitel 10: Metalle und Redoxreaktionen& Energiediagramm
- Die Reaktion von Kupferoxid mit Wasserstoff ist eine typische Redoxreaktion. Erkläre sie genau und definiere dann Redoxreaktion und erkläre ihre Kennzeichen.
- Vergleiche diese Kupferoxidreduktion mit der historischen Kupfergewinnung.
- Was versteht man unter Oxidation, Reduktion und Redoxreaktion? Erkläre mit einem Beispiel.
- Liegt bei dem Luftballon-Explosionsversuch eine Redoxreaktion vor? Begründe mit einer Reaktionsgleichung.
- Nenne drei Wege (mit Reaktionsgleichung) aus CuO das metallische Element zu gewinnen.
- Was ist der Hochofenprozess? Erkläre umfassend.
- Beschreibe das Thermitverfahren.
- Wie unterscheidet sich der Hochofenprozess vom Thermitverfahren, wo liegen Gemeinsamkeiten?
- Wie kann aus Bleioxid (PbO) Sauerstoff und Blei gewonnen werden?
- Ist die Zersetzung von Wasser eine Redoxreaktion? Wiederhole den Versuchsaufbau und begründe.
- Kann man zu Kohlenstoffdioxid verbrannten Kohlenstoff wieder zurückgewinnen?
- Zum Knobeln: Benzin (C8H18) verbrennt an der Luft zu Wasser und Kohlenstoffdioxid. Erstelle die Reaktionsgleichung und dass passende Energiediagramm. Liegt eine Redoxreaktion vor?
- Erkläre die Begriffe „endotherme Reaktion“ und „exotherme Reaktion“ mit je einer Beispielreaktion und zeichne das passende Energiediagramm. (Vergisst Du die Achsen zu beschriften, schreibe alle Fragen 17mal ab! *g* ).
- Entscheide bei folgenden Reaktionen, ob es sich um einen exo- oder endothermen Vorgang handelt:
a) Beim Entladungsvorgang einer Autobatterie werden Bleiverbindungen umgewandelt und elektrische Energie wird abgegeben.
b) Holz wird zum Heizen von Häusern verwendet.
c) Der Mensch und viele Wirbeltiere sind gleichwarm: Die Körpertemperatur bleibt aufgrund der chemischen Umsetzung von Nährstoffen (hauptsächlich Kohlenhydrate) und Sauerstoff bei der Atmung konstant.
d) Die Reaktion in Verbrennungsmotoren.
e) Bauxit der Ausgangstoff der Aluminiumherstellung enthält einen großen Prozentsatz an Aluminiumoxid. Die Gewinnung von Aluminium wird stets dort durchgeführt, wo billige elektrische Energie zur Verfügung steht.
f) Quecksilberoxid lässt sich durch Erhitzen in Quecksilber und Sauerstoff zersetzen.
g) Pflanzen speichern bei der Photosynthese Sonnenenergie in chemischer Form in energiereichen Verbindungen (Traubenzucker, Sauerstoff).
h) Eine starke Säure einer Autobatterie wird zum Entsorgen neutralisiert. - Was ist ein Katalysator? Nenne Aufgaben und beschreibe sein Verhalten z.B. bei der Verbrennung von Zucker. Erstelle die Reaktionsgleichung [Zucker: C6H12O6] und zeichne anschließend ein Energiediagramm der katalytischen Zuckerverbrennung.
- Vergleiche das Thermitverfahren mit dem Hochofenverfahren.
- Vergleiche Kupfer und Eisen hinlänglich ihrer Eigenschaften und Verwendung.
- Nenne Eigenschaften von Aluminium? Wie wird es herstellt?
- Vergleiche die Reaktion von ZnO + Cu mit der Reaktion von CuO + Zn. Welches der beiden Metalle ist edler?
- CuO reagiert mit Mg explosionsartig. Stelle eine Reihung (edel/ unedel) der Metalle Au, Ag, Cu, Mg, Na und Zn auf.
- In der Natur kommen die meisten Metalle als Oxid vor (also nicht als Element). Gold, Silber und Kupfer hingegen auch in gediegener Form (= als Element). Was vermutest Du als Ursache?
- Warum hat die „Erfindung“ der Eisenherstellung länger gedauert als die der Kupferherstellung?
- Ist Bronze ein Element? Was weißt Du eigentlich über die Bronzezeit?
- Beschreibe eine Möglichkeit, wie man Silber aus dem Erz gewinnt.
- Nenne Eigenschaften von Wasserstoff und erkläre die Nachweisreaktion (Knallgasprobe). Ist es eine Redoxreaktion?
- Erstelle die folgenden Reaktionsgleichungen und bestimme, ob Redoxreaktionen vorliegen:
a) Magnesiumoxid reagiert mit Schwefel zu Magnesium und Schwefeldioxid.
b) Magnesiumoxid reagiert mit Schwefel zu Magnesium und Schwefeltrioxid.
c) Aluminiumoxid reagiert mit Kohlenstoff zu Aluminium und Kohlenstoffdioxid. - Gönn‘ Dir eine Pause ;-)
- Freies Lehrbuch "Anorganische Chemie": 12 Redoxreaktionen der großtechnischen und industriellen Chemie
- Freies Lehrbuch "Anorganische Chemie": 13 Chemisches Rechnen
- Freies Lehrbuch "Anorganische Chemie": 14 Ionen, Salze, Fällungsreaktionen und Ionenbindung
- Freies Lehrbuch "Anorganische Chemie": 15 Die Atombindung (Elektronenpaarbindung)
- Freies Lehrbuch "Anorganische Chemie": 16 Säure - Base - Reaktionen (nach dem Donator-Akzeptor-Prinzip)
- Freies Lehrbuch "Anorganische Chemie": 17 Redoxreaktionen als Elektronenübergänge
- Freies Lehrbuch "Anorganische Chemie": 18 Elektrochemie I
- Freies Lehrbuch "Anorganische Chemie": 19 Das Orbitalmodell als Atommodell
- Freies Lehrbuch "Anorganische Chemie": 20 Physikalische Chemie I - Grundlagen der Thermodynamik und des Energieumsatzes
- Freies Lehrbuch "Anorganische Chemie": 22 Das chemische Gleichgewicht
- Freies Lehrbuch "Anorganische Chemie": 23 Löslichkeit von Salzen & das Löslichkeitsprodukt
- Freies Lehrbuch "Anorganische Chemie": 24 Säure-Base-Gleichgewichte
- Freies Lehrbuch "Anorganische Chemie": 25 Elektrochemie II - Transportable Energie: Batterien, Akkus und Knopfzellen
- Freies Lehrbuch "Anorganische Chemie": 27 Analytik und Ionennachweise