- Details
- Zugriffe: 8086
Kapitel 07: Gesetzmäßigkeiten chemischer Reaktionen

Gesetze von der Erhaltung der Masse und der Energie
a) Massenerhaltung:
Was geschieht eigentlich mit der Masse der Reaktionsteilnehmer bei einer chemischen Reaktion?
Dies zu überprüfen, ist gar nicht so einfach, da man dazu ein geschlossenes System haben muss, in das kein neuer Stoff eindringt, aber auch nichts entweicht. Um das zu erreichen, wird ein Rundkolben mit einem Luftballon gasdicht verschlossen. (Ein Stopfen würde sofort durch die Wärmeausdehnung herausknallen!)
V: In einen Rundkolben werden Streichholzspitzen gefüllt. Er wird mit einem Luftballon geschlossen und gewogen.
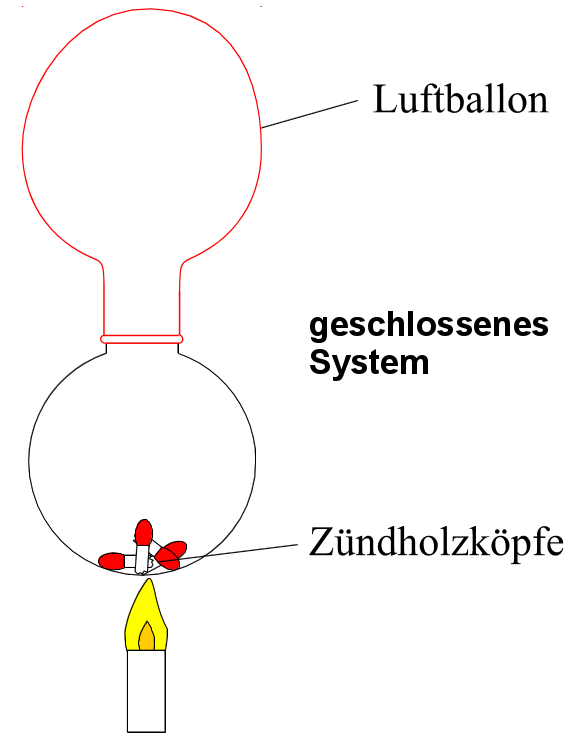
B: Der Luftballon dehnt sich aus und zieht sich wieder zusammen.
Masse zu Beginn der Reaktion: m = 50,41 g
Masse am Ende der Reaktion: m = 50,41 g
S: Das Gas dehnt sich bei Erwärmung aus und kontrahiert beim Abkühlen.
=> Die Gesamtmasse der Reaktionspartner hat sich nicht geändert!
Antoine Lavoisier (1743 - 1794): Gesetz von der Erhaltung der Masse:
„Rien ne se perd, rien ne se crée“
Die Gesamtmasse ändert sich bei chemischen Reaktionen nicht.
(im Rahmen der Messgenauigkeit): Masse Ausgangsstoffe = Masse Produkte
b) Energieerhaltung
Albert Einstein (1879 - 1955): „Umwandlung von Energie in Masse und von Masse in Energie ist möglich.“
E = m * c2 (c = Lichtgeschwindigkeit = 300.000 km/s)
Bei einer chemischen Reaktion ist die Summe aus Masse und Energie der Ausgangsstoffe gleich der Summe aus Masse und Energie der Endstoffe.
Wird Energie frei, tritt ein unwägbar kleiner Massenverlust auf. Wird Energie investiert, tritt Massenzunahme auf. Dieses kann allerdings mit herkömmlichen Waagen nicht gemessen werden.
Ein Video zum Versuch findet ihr hier: https://youtu.be/GO_T6uF_AN4
Energieerhaltung bei chemischen Reaktionen: (=1.HS Thermodynamik)
Bei diesem Versuch wird nasses CaO getrocknet. Anschließend wird wieder Wasser zugegeben. Wir beobachten das Energie zum Entfernen des Wassers benötigt wird.
Die Zugabe von Wasser setzt Energie frei. Wasser, CaO und Becherglas und Thermometer werden gewogen. Dann wird das Wasser zugegeben. Die Temperatur steigt.
Woher stammt die freiwerdende Energie (Temperatur)?
Praktisch: Einstein: E=mc2. Wenn c eine Konstante ist und nach dem ersten Gesetz die Masse sich nicht ändert, so muss auch die Gesamtenergie bei chemischen Reaktionen unverändert bleiben.
(=> Wenn Benzin verbrennt und Energie frei wird, muss sie schon vorher enthalten sein => innere Energie).
Gesetz der konstanten Massenverhältnisse (=konstante Proportionen)
Joseph Louis Proust (1754 - 1826) war Apotheker in Paris und auch Forscher in Madrid, wo er vom spanischen König bezahlt wurde. Er musste für seine Medikamente viele Kräuter mischen und reagieren lassen und war daran interessiert, so wenig wie möglich bei einer Reaktion an Resten „über“ zu haben, also zu verschwenden, da die Kräuter selten und teuer waren. Er untersuchte also chemische Reaktionen unter dem Aspekt der Masse.
Um seine Erkenntnisse zu verstehen, kann man ein einfaches Masseexperiment durchführen, welches schon bekannt ist, die Vereinigung von Kupfer mit Schwefel:
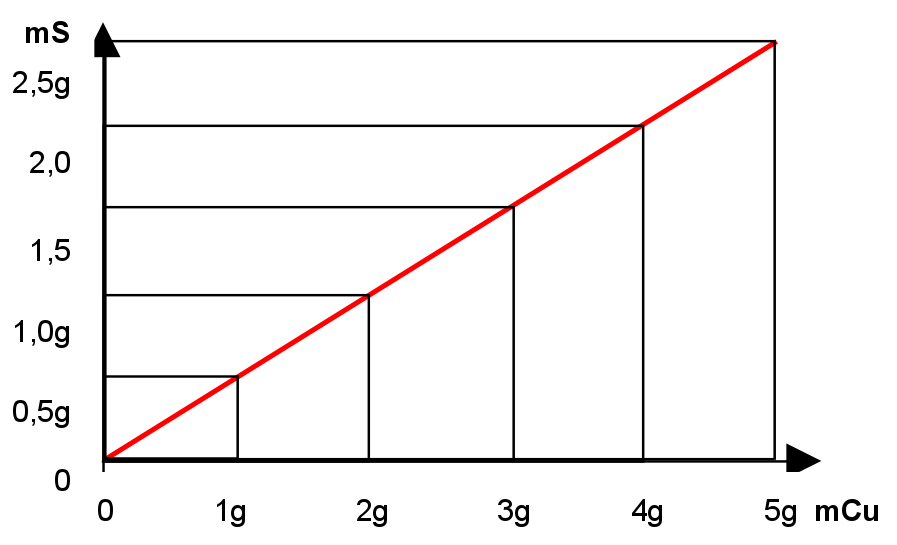
V: Mehrere Schülergruppen wiegen ein Kupferblech vor und nach der Vereinigung mit Schwefel. Dann wird der Mittelwert aller Messungen bestimmt und das Massenverhältnis berechnet.
B: Der Mittelwert aller Messungen lautet:
Kupferblech vor der Reaktion: 6g
Kupferblech nach der Reaktion: 9g
=> es hat mit 3g Schwefel reagiert
Schlussfolgerung: Kupferblech + Schwefel --> Schwefelkupfer +E
m Kupfer 6g 2
——————— = ——— = ———
m Schwefel 3g 1
Folgende Grafik soll Dir verdeutlichen, dass der Zusammenhang bei jeder Masse besteht und proportional ist. D.h. Das konstante Massenverhältnis von Kupfer zu Schwefel ist immer 2:1
Louis Proust 1799: Gesetz der konstanten (=unveränderlichen) Massenverhältnisse:
Bei chemischen Reaktionen (Vereinigung, bzw. der Zersetzung) reagieren die Reinstoffe immer in einem von der Natur vorgegebenen festen Verhältnis miteinander.
Aufgaben zum Rechnen mit konstanten Massenverhältnissen
1. Eisen + Schwefel (Fe + S):
a) Bei einem Versuch reagieren 140g Eisen mit 80g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis.
b) Wie viel Schwefel braucht man für 105g Eisen?
c) Bei einer anderen Vereinigung werden zu einem Eisenblech 200g Schwefel gegeben. Die Vereinigung verläuft vollständig. Wie schwer war das Eisenblech?
2. Kupfer und Schwefel (Cu + S):
a) Ein Kupferblech wiegt 400g. Es wird mit Schwefel vereinigt. Nach der Reaktion wiegt es 600g. Wie groß ist die Masse des Schwefels, der reagiert hat?
b) Bestimme das Massenverhältnis.
c) Wie viel Gramm Schwefel braucht man für die Reaktion von 233g Cu?
3. Wasserstoff und Sauerstoff (H + O):
a) Auch Gase haben ein Gewicht. 8g Wasserstoff und 64g Sauerstoff vereinigen sich beim Entzünden mit einem lauten Knall. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis.
b) Wie viel Gramm Wasserstoff braucht man für 12g Sauerstoff?
Gesetz der konstanten Massenverhältnisse
=> Eisen und Schwefel reagieren im Massenverhältnis 7:4 miteinander. Dieses Ergebnis gilt auch bei großen Massen (z.B. Tonnen)!
=> Gesetz der Konstanten Massenverhältnisse:
Bei chemischen Reaktionen reagieren die Stoffe immer in einem von der Natur vorgegebenen festen Verhältnis miteinander.
Wie weit kann man Stoffe zerlegen?
Schon der Grieche Demokrit (460 - 371 v. Chr.) nahm an, dass man Stoffe nicht beliebig weit zerkleinern und zersetzen kann. Er vermutete ein am Ende vorliegendes unteilbares Teilchen, welches er „Atomos“ nannte (griechisch = unteilbar).
Für die Existenz von winzigen Teilchen sprechen viele Befunde:
V: Brom ist ein bei Raumtemperatur gerade noch flüssiges Nichtmetall, welches bei Freisetzung sofort verdunstet. Zum Beweis, dass die Flüssigkeit Brom aus kleineren Bestandteilen besteht, wird ein Tropfen Brom in einen mit Luft gefüllten Gaszylinder getropft.
B: Der braune Dampf breitet sofort sich aus und verteilt sich im ganzen Zylinder.
S: Die Teilchen verteilen sich selbstständig im Raum. Man nennt diesen Vorgang Diffusion. Dies ist die Verteilung von Teilchen aufgrund ihrer Eigenbewegung (siehe auch Kapitel 5 - Versuch des Kaliumpermanganatkristalls in Wasser).
Weiterhin spricht für die „Atom-Theorie“, dass viele Stoffe Kristalle bilden:
V: Man erstellt eine gesättigte Alaunlösung. Ein kleiner Impfkristall wird in die Alaunlösung gehängt.
B: Der Kristall wächst und bildet einen Oktaeder.
S: Kleinste Teilchen legen sich an die Oberfläche in ganz bestimmter Weise aneinander. Es bildet sich ein großer Kristall. Jede neue Schicht vergrößert den Kristall, lässt die Grundgestalt aber unverändert.
Wiederholung: John Dalton's Atomhypothese
Erinnere Dich an die Aussagen der „Dalton’sche Atomhypothese“ John Dalton, welche Du im vorherigen Kapitel gelernt hast:
- Jedes Element besteht aus extrem kleinen, bei chemischen Reaktionen ungeteilt bleibenden Teilchen, den Atomen.
- Die Massen der Atome eines bestimmten Elementes sind gleich (alle Atome eines Elements sind gleich). Die Atome verschiedener Elemente unterscheiden sich in ihren Eigenschaften (z.B. in Größe, Masse, usw.).
- Es existieren so viele Atomsorten wie Elemente.
- Bei chemischen Reaktionen werden Atome in neuer Kombination vereinigt oder voneinander getrennt (zersetzt).
- Eine bestimmte Verbindung wird von den Atomen der betreffenden Elemente in einem ganz bestimmten, einfachen Zahlenverhältnis gebildet.
Dalton bestimmt das Atomgewicht durch Vergleich von Atommassen

Wenn man die relative Atommasse auf ein Atom bezieht und in Gramm ausrechnet, bemerkt man, wie gering die Masse eines Atoms ist:
Die Masse eines Wasserstoffatoms beträgt:
0,000 000 000 000 000 000 000 001 637g
Die Masse eines Sauerstoffatoms beträgt:
0,000 000 000 000 000 000 000 0267g
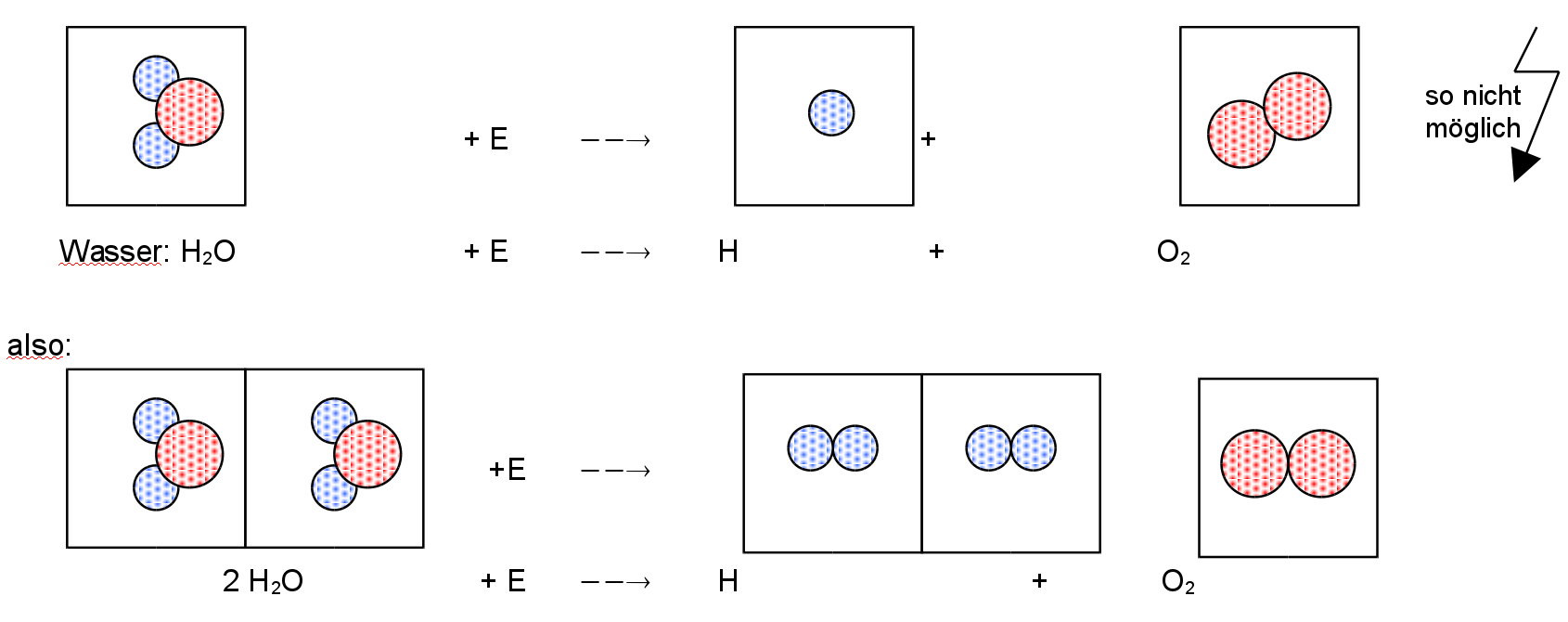
Warum ist das Massenverhältnis konstant?
Nimmt man die Masse von je einem Atom Wasserstoff und einem Atom Sauerstoff
=>
m 2H 2 · 0,000 000 000 000 000 000 000 001 637g 1
———— = ————————————————————————— = ———
m O 0,000 000 000 000 000 000 000 0267g 8,15
Nimmt man statt einem Atom beispielsweise 12345 Atome:
m 2H 12345 · 2 · 0,000 000 000 000 000 000 000 001 637g 1
———— = ————————————————————————————— = ———
m O 12345 · 0,000 000 000 000 000 000 000 0267g 8,15
Wie man sieht, ist das Massenverhältnis, nicht von der Anzahl der beteiligten Atome abhängig, da sie sich aus dem Verhältnis sowieso rauskürzen.
Die Dalton´sche Atomhypothese erklärt das Gesetz der konstanten Massenverhältnisse
Bsp.: Eisensulfid
7 g Eisen + 5 g Schwefel ----> 11 g Eisensulfid + 1 g Schwefel +E
9 g Eisen + 4 g Schwefel ----> 11 g Eisensulfid + 2 g Eisen +E
7 g Eisen + 4 g Schwefel ----> 11 g Eisensulfid +E
=> Da Schwefel und Eisen in einem konstanten Verhältnis miteinander reagieren und bei 7g Eisen und 4g Schwefel (und kein Rest übrig bleibt), folgt daraus das in 7g Eisen genauso viele Atome enthalten sind wie in 4 g Schwefel.
Wichtig: Es können nur ganze Atome reagieren (da sie chemisch unteilbar sind).

gezählt: 5 Atome Fe + 5 Atome S ---> 6 Moleküle FeS + E
=> Anzahlverhältnis:
Fe 5 Atome 1
—— = ————— = ———
S 5 Atome 1
gewogen: 7g Fe + 4g S ---> 11g FeS + E
=> Massenverhältnis: mFe
Fe 7g 7
—— = —— = ——
S 4g 4
bzw.: 56u Fe + 32u S ---> 88u FeS
=> Massenverhältnis: mFe
Fe 56u 7
—— = ——— = ——
S 32u 4
Hat damit Dalton das Gesetz der konstanten Massenverhältnisse schon erklärt?
=> Wenn die Anzahl der reagierenden Eisenatome der Anzahl an reagierenden Schwefelatomen entspricht, dann muss das Massenverhältnis immer gleich sein, da nur ganze Atome miteinander reagieren können und sich deren Anzahl im Verhältnis herauskürzt:
=> unabhängig von der Anzahl der beteiligten Atome ist das Massenverhältnis immer konstant, da die Atome in einem festen Anzahlverhältnis miteinander reagieren.
Ein Vergleich: Im Klassenraum sind Jungen (alle 70kg) und Mädchen (40kg). Egal wie viele Mädchen mit Jungen sich zu Paaren zusammenstellen, es kommt immer das Verhältnis 7:4 pro Paar raus.
Aufgaben:
- Schreibe einen Aufsatz, der erklärt, inwiefern Dalton´s Atomhypothese das Gesetz der konstanten Proportionen erklärt.
- Erkläre die Konsequenzen der Aussage „Eisen reagiert mit Schwefel zu Eisensulfid. Genau ein Atom Eisen reagiert dabei immer mit einem Atom Schwefel“.
- Was kann man mit diesem Wissen nun alles aus der Formel „FeS“ herauslesen?
- Was passiert, wenn wir mehr Schwefel nehmen? (=> S Atome bleiben übrig.)
Gesetz der vielfachen Massenverhältnisse (multiple Proportionen)
Ein Mineraliensammler findet einen schwarzen Brocken mit Eisensulfid (FeS) sowie einen Brocken eines goldenen Minerals. Eine Untersuchung ergibt für beide Brocken, dass nur Fe und S enthalten sind!
Die quantitative Analyse der Massenverhältnisse ergibt
a) schwarzes Eisensulfid (Magnetkies): 1 Atom Fe: 1 Atom S => MV = 7/4
b) goldenes Eisensulfid: 1 Atom Fe: 2 Atomen S => MV = 7/8
=> auf 7 g Fe kommen im „goldenen“ Mineral 8 g Schwefel => mFe : mS = 7 : 8
=> In 8 g Schwefel sind doppelt so viele Atome enthalten wie in 7 g Eisen.

gezählt: 5 Atome Fe + 2·5 Atome S ---> 5 Moleküle FeS2 + E
=> Anzahlverhältnis:
Fe 5 Atome 1
—— = ————— = ———
S 10 Atome 2
gewogen: 7g Fe + 8g S ---> 15g FeS2 + E
=> Massenverhältnis: mFe
Fe 7g 7
—— = —— = ——
S 8g 8
bzw.: 56u Fe + 32u S ---> 88u FeS
=> Massenverhältnis: mFe
Fe 56u 7
—— = ——— = ——
S 2·32u 8
Durch diesen Wert kann man nun die Formel und den Namen des Minerals mit der passenden Fachliteratur bestimmen: Das Mineral heißt Eisenkies (Pyrit, Katzengold, fools gold) und kommt z.B. in Silberbergwerken vor. Seine Formel ist FeS2.
=> Es handelt sich um zwei völlig verschiedene Verbindungen, die beide aus Eisen und Schwefel bestehen und ganz verschiedene Eigenschaften haben. Sie unterschieden sich z.B. in ihrem Massenverhältnis.
=> Das Gesetz der Multiplen Proportionen: Elemente verbinden sich in einem von der Natur vorgegebenem, einfachen, Massenverhältnis oder deren Vielfachen miteinander.
Theoretisch mögliche Kombinationen wären:
7/4, 7/8, 14/4, 14/12… usw.
Durch diesen Wert kann man nun die Formel und den Namen des Minerals mit der passenden Fachliteratur bestimmen: Das Mineral heißt Eisenkies (Pyrit, Katzengold, fools gold) und kommt z.B. in Silberbergwerken vor. Seine Formel ist FeS2
Aufgaben zum Thema Massenverhältnisse
- Beschreibe das Gesetz mit Deinen Worten
- Wie viele Atome sind in Schwefelsäure (Phosphorsäure) miteinander vereinigt?
- Fe reagiert mit S unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis
- Schwefel verbrennt an der Luft mit blassblauer Flamme, wenn der Schwefel in reinem Sauerstoff verbrennt, leuchtet er blau und es entsteht ein weißer Feststoff:
Stelle die zwei Reaktionsgleichungen auf und bestimme die Massenverhältnisse. - Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis.
N:O = 7/16. Bestimme die Formel des entstehenden Gases. - Eine Müllverbrennungsanlage verbrennt am Tag 1000kg Kunststoffe. Diese enthalten 950kg Kohlenstoff. 95% davon verbrennen vollständig zu Kohlenstoffdioxid. 5% verbrennen unvollständig zu Kohlenstoffmonoxid. Stelle beide Reaktionsgleichungen auf und bestimme die Massen der entstehenden Gase.
- Eisen reagiert mit Schwefel unter hohem Druck im Massenverhältnis 14/12. Bestimme das Atomverhältnis
- Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis N:O = 7/8. Bestimme die Formel des entstehenden Gases
- Im Labor lässt sich Stickstoff aber auch in anderen Massenverhältnissen oxidieren. So reagieren 126g Stickstoff mit 288g Sauerstoff zu einem gelben Gas. Bestimme das Massenverhältnis und bestimme die Formel des gelben Gases.
Vergleiche:
Eisensulfid1: schwarzes Pulver, magnetisch (=> Magnetkies)
Bildung durch: 7 g Eisen + 4 g Schwefel ----> 11 g Eisensulfid 1 (=Magnetkies)
m Fe / S = 7g/4g = 7/4 => einfachstes Massenverhältnis (bei 1 Atom Fe + 1 Atom S)
Eisensulfid2: gold-metallisch glänzend, nicht magnetisch (=> Eisenkies, Katzengold, Pyrit),
Bildung durch: 7g Eisen + 8g Schwefel ----> 15g Eisensulfid 2 (=Eisenkies)
Diese Reaktion erfordert speziellen Reaktionsbedingungen, wie sie z.B. im Erdinneren, bei hohem Druck und hoher Temperatur vorliegen.
m Fe/ S = 7g / 8g = 7/8 = 7/ 2·4 => Fe1S2 (1 Atom Fe + 2 Atome S)
Mit diesem Wissen wurden von Chemikern nun viele Mineraliensucher ausgeschickt, die rausfinden sollten, welche Verbindungen es wirklich gibt. In der Natur findet man allerdings nicht alle denkbaren Vielfachen, obwohl theoretisch viele möglich sind.
Es stellte sich heraus, dass es tatsächlich nur wenige Elementkombinationen gibt.
Ein weiteres Eisensulfid wurde aber tatsächlich noch gefunden, die Analyse ergab ein Massenverhältnis von Fe : S = 14 : 12 entspricht gekürzt: 7/6
=> 7 g Eisen vereinigen sich mit 6 g Schwefel vollständig.
2 Fe + 3 S ---> Fe2S3
Die Formel dieses Eisensulfids ist Fe2S3.
Dieses Wissen erforderte eine neue Schreibweise für chemische Verbindungen:
Regeln für die chemische Formel
Bsp.: C6H12O6 (Traubenzucker)
Anschreiben der Symbole der an der Verbindung beteiligten Elemente (C, H, O).
Das Anzahlverhältnis der Atome wird durch tief gestellte Zahlen ausgedrückt. Metallsymbole werden vorangestellt.
Aufgaben:
- Wie viele Atome sind in Schwefelsäure (Phosphorsäure) miteinander vereinigt?
- Fe reagiert mit S unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis.
- Schwefel verbrennt an der Luft mit blassblauer Flamme, wenn der Schwefel in reinem Sauerstoff verbrennt, leuchtet er blau und es entsteht ein weißer Feststoff.
Stelle die zwei Reaktionsgleichungen auf und bestimme die Massenverhältnisse. - Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis .
N:O = 7/16. Bestimme die Formel des entstehenden Gases. - Eine Müllverbrennungsanlage verbrennt am Tag 1000kg Kunststoffe. Diese enthalten 950kg Kohlenstoff. 95% davon verbrennen vollständig zu Kohlenstoffdioxid. 5% verbrennen unvollständig zu Kohlenstoffmonoxid. Stelle beide Reaktionsgleichungen auf und bestimme die Massen der entstehenden Gase.
-------------------------------------------------------------------------------------------------------------------------------------
Lösung 5:
950kg C, davon sind 95% für CO2 (=902,5kg C) und 5% für CO (=47,5kg C)
mO2 / mC: 32/ 12 = X/ 902,5kg x = m O2= 2406,6 kg m CO2 = 2406,6 kg + 902,5 kg = 3309,1 kg CO2
mO/ mC : 16/ 12 = X/ 47,5 kg x = m O = 63 kg m CO = 63 kg + 47,5 kg = 110,5 kg CO2
-------------------------------------------------------------------------------------------------------------------------------------
Aufgaben zum Rechnen mit Massenverhältnissen
- Eisen reagiert mit Schwefel unter hohem Druck im Massenverhältnis 14/12. Bestimme das Atomverhältnis.
- Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis N:O = 7/8. Bestimme die Formel des entstehenden Gases.
- Im Labor lässt sich Stickstoff aber auch in anderen Massenverhältnissen oxidieren. So reagieren 126g Stickstoff mit 288g Sauerstoff zu einem gelben Gas. Bestimme das Massenverhältnis und bestimme die Formel des gelben Gases.
- Schwefel verbrennt an der Luft mit blassblauer Flamme, wenn der Schwefel in reinem Sauerstoff verbrennt leuchtet er blau und es entsteht ein weißer Feststoff.
Stelle die zwei Reaktionsgleichungen auf und bestimme die Massenverhältnisse. - Im Dieselkraftstoff ist Schwefel enthalten. Es bildet sich bei der Verbrennung im Motor das Gas Schwefeldioxid.
a) Stelle die Reaktionsgleichung (mit „C“ als Dieselkraftstoff) auf.
b) Bestimme, wie viel Gramm Schwefeldioxid pro kg Sauerstoff entstehen.
c) In einem Liter Dieselkraftstoff sind (ca.) 10g Schwefel enthalten. Bestimme die Masse an Schwefeldioxid, die bei einer Fahrstrecke von 100 km (Verbrauch 5l/ 100km) entsteht. - Wenn reiner Kohlenstoff in reinem Sauerstoff verbrennt, ist kein Produkt zu sehen. Kann man es dennoch beweisen?
- Bei einem Versuch reagieren 21g Eisen mit 12g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Schwefel braucht man für 25g Eisen?
Volumenverhältnisse bei chemischen Reaktionen
V: Zersetzung von Wasser durch elektrische Energie im Hoffmann’schen Zersetzungsapparat:

Hoffmannscher Wasserzersetzungsapparat
B : - Gasblasen steigen auf
-Pol: Knallgasprobe positiv
+Pol: Glimmspanprobe positiv
S: Wasser (l) + Energie ----> Wasserstoff (g) + Sauerstoff (g)
V(Wasserstoff) : V(Sauerstoff) = 2:1
=> 2 Vol Wasserstoff + 1 Vol Sauerstoff ----> 2 Vol Wasserdampf + E
Wie kommt es dazu, das doppelt so viel Wasserstoff entsteht?
Volumengesetz nach Gay-Lussac:
Die reagierenden Gasvolumina stehen zueinander im Verhältnis kleiner ganzer Zahlen.
2 RT Wasserstoff (g) + 1 RT Sauerstoff (g) ----> 2 RT Wasserdampf (g)
3 RT Wasserstoff (g) + 1 RT Stickstoff (g) ----> 2 RT Ammoniak (g)
Hypothese von Avogadro:
Gleiche Gasvolumina enthalten bei gleichem Druck und gleicher Temperatur die gleiche Anzahl von Teilchen.
Weitere Beispiele
H2 + Cl2 ----> 2 HCl
1 RT Wasserstoff (g) + 1 RT Chlor (g) ----> 2 RT Chlorwasserstoff (g)
2 H2 + O2 ----> 2 H2O
2 RT Wasserstoff (g) + 1 RT Sauerstoff (g) ----> 2 RT Wasserdampf (g)
3 H2 + N2 ----> 2 NH3
3 RT Wasserstoff (g) + 1 RT Stickstoff (g) ----> 2 RT Ammoniak (g)
Merke: Kleinste Teilchen, die aus zwei oder mehreren Atomen zusammengesetzt sind,
nennt man Moleküle.
Regel: die Gase Sauerstoff, Stickstoff, Wasserstoff und die Halogene sind die Nichtmetalle,
die als zweiatomiges Molekül vorkommen.
Also: H2, O2, N2, Cl2, Br2, I2
Unterscheide: 1 H2 = 1 Molekül Wasserstoff , 1 H = 1 Wasserstoffatom 2 NH3, = 2 Moleküle Ammoniak
Bestimmung der Formel des Wassers auf zwei Wegen
1. Mit dem Hoffmanschen Wasserzersetzungsapparat kann man Wasser in Sauerstoff und Wasserstoff spalten. Dabei sieht man, dass zwei Teile Wasserstoff notwendig sind.
2. Mit Hilfe eines Eudiometers kann man Wasserstoff und Sauerstoff in verschiedenen Verhältnissen miteinander zur Reaktion bringen. Den lautesten Knall und die beste Reaktion erhält man beim Gemisch von 2 teilen Wasserstoff und einem Teil Sauerstoff.
Volumenverhältnisse bei chemischen Reaktionen (alternativ mit Eudiometer)
Sauerstoff + Wasserstoff ----> Wasser + Energie
(blaue Gasflasche) (rote Gasflasche)
V: Bestimmung der Volumenverhältnisse bei der Reaktion mit Wasserstoff. (Eudiometerversuch)
B: Wasserstoff und Sauerstoff reagieren immer im Volumenverhältnis 2:1 miteinander
Aus dem Verhältnis H:O= 2:1 folgt die Formel H2O.
Unglaublich leichte Wiederholungsfragen
- Ist Luft (Wasser?) ein Element? Begründe!
- Erkläre: Element - Verbindung - Gemisch.
- Was ist ein Metalloxid (Nichtmetalloxid) ? Nenne je zwei Beispiele.
- Wie kann man Metallsulfide bilden. Nenne ein Beispiel.
- Erkläre die Vereinigung von Kupfer mit Schwefel (Eisen mit Schwefel).
- Was ist eine Vereinigung, was ist eine Zersetzung?
- Nenne Stationen in Daltons Leben.
- Beschreibe, was man erhält, wenn man Säure und Lauge gleicher Konzentration mischt.
- Was sagt der Massenerhaltungssatz aus?
- Was sagt der Energieerhaltungssatz aus?
- Was sagt das Gesetz der vielfachen Massenverhältnisse aus?
- Worin liegt die Erweiterung des Gesetzes der vielfachen Massenverhältnisse im Vergleich zu dem der konstanten Massenverhältnisse?
- Welcher Stoff entsteht, wenn man Phosphoroxid und Wasser mischt (Natriumoxid)?
- Welcher Stoff entsteht, wenn man Stickoxid (NO2) und Wasser mischt?
- Welcher Stoff entsteht, wenn man Kohlenstoffdioxid und Wasser mischt?
- Nenne die Formel für Sauerstoff, Wasserstoff, Stickstoff, Wasser und Kohlenstoffdioxid.
- Was ist eine Säure, was ist eine Lauge? Wie macht man eine Säure unschädlich?
- Stelle die Reaktionsgleichung der Bildung von Fe2O3 auf (SO2, SO3, CO2 ).
- Nenne 5 Säuren mit Formel (3 Laugen mit Formel, 5 Säurereste mit Formel).
Lerne nochmals alle Säuren, Laugen und die Säurereste auswendig!!!
Halsbrecherische, fiese und vor allem testrelevante Fragen zum Tüfteln
- Erstelle eine Übersicht der chemischen Gesetze, indem Du das Gesetz jeweils formulierst und mindestens ein Beispiel findest.
- Fe verbrennt mit Schwefel unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis.
- Zwei Atome verbinden sich im Massenverhältnis 1: 19. Wie heißt die Verbindung?
(Für Profis: 2: 16). - Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis
N:O = 7/16. Bestimme die Formel des entstehenden Gases. - 2,4g Magnesium und 7,0 g Chlor reagieren miteinander. Bestimme die Formel der Verbindung.
- Eine Müllverbrennungsanlage verbrennt am Tag 1000kg Kunststoffe. Diese enthalten 950kg Kohlenstoff. 95% davon verbrennen vollständig zu Kohlenstoffdioxid. 5% verbrennen unvollständig zu Kohlenstoffmonoxid. Stelle beide Reaktionsgleichungen auf und bestimme die Massen der entstehenden Gase.
- Eisen reagiert mit Schwefel unter hohem Druck im Massenverhältnis 14/12. Bestimme das Atomverhältnis.
- Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis N:O = 7/8. Bestimme die Formel des entstehenden Gases.
- Im Labor lässt sich Stickstoff aber auch in anderen Massenverhältnissen oxidieren. So reagieren 126g Stickstoff mit 288g Sauerstoff zu einem gelben Gas. Bestimme das Massenverhältnis und bestimme die Formel des gelben Gases.
- Im Dieselkraftstoff ist Schwefel enthalten. Es bildet sich bei der Verbrennung im Motor das Gas Schwefeldioxid.
a) Stelle die Reaktionsgleichung (mit „C“ als Dieselkraftstoff) auf.
b) Bestimme, wie viel Gramm Schwefeldioxid pro kg Sauerstoff entstehen.
c) In einem Liter Dieselkraftstoff sind (ca.) 10g Schwefel enthalten. Bestimme die Masse an Schwefeldioxid, die bei einer Fahrstrecke von 100 km (Verbrauch 5l/ 100km) entsteht. - Bei einem Versuch reagieren 21g Eisen mit 12g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Schwefel braucht man für 25g Eisen?
Die Wertigkeit (=Oxidationszahl) - eine nützliche Hilfszahl
Wertigkeiten werden als römische Ziffer über den entsprechenden Atomsymbolen angegeben. Wertigkeiten geben eine Art gedachter Ladung an. Sie helfen beim Erstellen von Formeln.
1. Elemente haben stets die Wertigkeit 0.
0 0 0
z.B.: Cl ; H2 ; Au
2. In Verbindungen muss man für jedes Element eine eigene Wertigkeit bestimmen.
Die Summen dieser Wertigkeiten ergibt dann immer 0
3. Sauerstoff besitzt in Verbindungen die Wertigkeit -II.
II -II I -II IV -II
z.B.: MgO ; H2O ; SO2
4. Wasserstoff besitzt in Verbindungen die Wertigkeit +I.
I -I I -II -III I
z.B.: HCl ; H2O ; NH3
5. Die Wertigkeit der Elemente der ersten 3 Hauptgruppen in Verbindungen (!) ist immer positiv und entspricht der Hauptgruppennummer!
I -I II -II III -II
z.B.: NaCl ; MgO ; Al2O3
6. Die Wertigkeit der Elemente der Hauptgruppen 5-7 ist in Verbindungen, die auf -id enden immer negativ und wird errechnet durch: Hauptgruppennummer – 8. Aber Vorsicht, endet der Name anders, sind hier auch viele andere Wertigkeiten möglich. Diese muss man dann errechnen!
I -I I -II
z.B.: Natriumclorid: NaCl ; Lithiumoxid: Li2O
Weitere Regeln zu den Wertigkeiten/ Oxidationszahlen:
7. Atome, die Wasserstoff ersetzen erhalten positive Vorzeichen.
I -I I -II
z.B.: NaCl ; Li2O
8. Atome, die Wasserstoff binden erhalten negative Vorzeichen.
I -I I -II -III I
z.B.: HF ; H2S ; PH3
Der Betrag der Wertigkeit ergibt sich aus der Zahl der ersetzten bzw. gebundenen Wasserstoffatome.
9. Bei Ionen entspricht die Wertigkeit der Ionenladung. Somit haben auch Säurereste die der Ladung entsprechende Wertigkeit (diese Regel wird in der 10. Klasse erst benötigt!).
I II III -II
z.B.: Na+ ; Mg2+ ; Fe3+ ; S2-
Aufgaben:
Bestimme alle Wertigkeiten:
H2O, Cu, NH4Cl, HBr, KBrO3, NaCl, H3PO4, Mg, I2, C6H12O6, CO2, HClO4, Al2(SO4)3, H2SO4, BaCl2, AgCl, AgNO3, AlCl3, CaCO3, CaCl2, Br2, Fe2O3, FeCl3, KHSO4, SO2, N2, NaNO3, NH3, KI, HCl, MgO, Al2O3, NaCl, N2, NaOH, NH3, SO2, CaO, H2S, SO3, K2O, Na2CO3 , N2O3, BaO, Cl2O4, SeF6 K2SnO3, H2N2O2, CaB2O4, HOBr, HBrO2, HBrO3, HBrO4, SCl2, PCl3, BCl3, SnH4, SbCl5.
Wie bestimmt man die Formel eines Salzes?
Viele Stoffe im Unterricht sind Salze. Ihre Namen kannst Du auf der Verpackung lesen, aber sie verrät Dir nicht die Formel. Salze bestehen aus Metallionen und Säureresten. Zum Erstellen der Formel muss man die Metallionen und die Säurereste immer so kombinieren, dass die Wertigkeiten (=Oxidationszahl) in ihrem Betrag zueinander passen.
Eine Beispielaufgabe: Welche Formel hat die Verbindung „Magnesiumchlorid“?
Magnesium hat die Wertigkeit +II und wird kombiniert mit Chlorid (Ladung ist nicht eingezeichnet), welches die Wertigkeit -I hat.
II -I
Mg + Cl ---> MgCl
Wie man sieht, passen die Wertigkeiten nicht zueinander. Damit die Summe Null ergibt, muss eine weitere negative Ladung her! Dies erreicht man durch Zugabe eines weiteren Cl.
II -I
Mg + 2Cl ---> MgCl2
Durch das Verhältnis von Mg: Cl = 1: 2 liegt eine weitere negative Wertigkeit vor, so dass die +II des Magnesiums durch 2 mal -I durch zwei Mal Chlor ausgeglichen wird.
=> die Formel für Magnesiumchlorid muss also MgCl2 lauten, da die zwei positiven Wertigkeiten ja durch zwei negative ausgeglichen werden müssen.
Da Chlorid nur eine davon hat, braucht man 2 Chloridteilchen!
Aufgaben mit Lösungen:
- Kombiniere Natrium und Sulfat zu Natriumsulfat.
- Kombiniere Kalium mit Sulfid zu Kaliumsulfid.
- Kombiniere Calciumion und Phosphat zu Calciumphosphat.
- Wozu braucht man die Klammer bei der letzten Formel eigentlich bei den Säureresten?
Zu 1: Zuerst muss man die Formeln der Säurereste und deren Wertigkeiten wissen (deshalb muss man sie auch auswendig lernen!).
Na: Wertigkeit: +I
SO4: Wertigkeit: -II (da es in H2SO4 an zwei Wasserstoffe gebunden ist) => Na2SO4
zu 2:
K: Wertigkeit: +I
S: Wertigkeit: -II (da es in H2S an zwei Wasserstoffe gebunden ist) => K2S
Zu 3: Tipp: kleinster gemeinsamer Nenner ist 6!
Ca Wertigkeit: +II
PO4 Wertigkeit: -III (da es in H3PO4 an drei Wasserstoffe gebunden ist) => Ca3(PO4)2
Zu 4: Säurereste bleiben in der Regel erhalten und zersetzen sich nicht so leicht. Die Wertigkeit gilt somit immer für den ganzen Säurerest. Um dieses zu verdeutlichen und sie nicht einem Element zuzuordnen benötigt man eine Klammer. Außerdem benötigt man den Säurerest zweimal. Deshalb kommt er in Klammern und wird mit zwei mal genommen!
Auf diese Art und Weise kann man jetzt alle Salzformeln leicht bestimmen. Bei Metallen der Nebengruppenelemente findet man die Wertigkeiten (auch Oxidationszahl genannt) im PSE.
Stickstoff bildet verschiedene Oxide
Stickstoff ist ein Element, welches viele verschiedene Oxide bildet. Dies ist nun auch nach dem Gesetz der vielfachen Massenverhältnisse möglich.
|
Wertigkeit |
Formel |
Name I |
Name II |
| + I |
N2O |
Stickstoff-(I)-oxid | Distickstoffmonoxid |
| +II | NO | Stickstoff-(II)-oxid | Stickstoffmonoxid |
| +III |
N2O3 |
Stickstoff-(III)-oxid | Distickstofftrioxid |
| +IV |
NO2 |
Stickstoff-(IV)-oxid | Stickstoffdioxid |
| +IV |
N2O4 |
Stickstoff-(IV)-oxid | Distickstofftetraoxid |
| +V |
N2O5 |
Stickstoff-(V)-oxid | Distickstoffpentaoxid |
Die griechischen Zahlen
mono = 1
di = 2
tri = 3
tetra = 4
penta = 5
hexa = 6
hepta = 7
octa = 8
nona = 9
deca = 10
Übung: Stelle die Wertigkeiten für die folgenden Elemente und Verbindungen auf
Cu, NH4Cl, HBr, KBrO3, H2O, NaCl, H3PO4, Mg, I2, C6H12O6, CO2, HClO4, Al2(SO4)3, H2SO4, BaCl2, AgCl, AgNO3, AlCl3, CaCO3, CaCl2, Br2, Fe2O3, FeCl3, KHSO4, SO2, N2, NaNO3, NH3, KI, HCl
Regeln zum Erstellen von Reaktionsgleichungen
1. Wortgleichung erstellen. Dazu Ausgangsstoffe und Endstoffe aufschreiben:
z.B. Aluminium + Sauerstoff ---> Aluminiumoxid
2. Chemische Symbole darunter schreiben:
z.B. Aluminium + Sauerstoff ---> Aluminiumoxid
Al + O2 ---> AlO
3. Mit Hilfe der Wertigkeit die Anzahlverhältnisse bei Verbindungen festlegen:
z.B. Aluminium + Sauerstoff ---> Aluminiumoxid
0 0 III -II
Al + O2 ---> Al2O3
4. Die Anzahl der Atome auf beiden Seiten ausgleichen:
(Vorsicht, die Formeln selbst dürfen jetzt nicht mehr verändert werden!)
z.B. Aluminium + Sauerstoff ---> Aluminiumoxid
0 0 III -II
4 Al + 3 O2 ---> 2 Al2O3
5. Überlegen, ob Energie benötigt oder freigesetzt wird?
z.B. Aluminium + Sauerstoff ---> Aluminiumoxid
0 0 III -II
4 Al + 3 O2 ---> 2 Al2O3 +E
Tipps:
- Nur Wasserstoff, Stickstoff, Sauerstoff (und die Elemente der 7. HG) kommen als zweiatomiges Element vor: => H2, N2, O2, F2, Cl2, Br2, I2 (es gibt also niemals Fe2 oder Al4!!!)
- Wenn es zu viele Atome sind, um sie im Kopf zu zählen, male für jedes Atom einen Punkt in einer Farbe. Gleiche Elemente haben dabei die gleiche Farbe. Am Ende sollen auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl von Punkten in denselben Farben stehen.
- Überlege Dir immer gut, ob die Formel, die Du jetzt errechnet hast, überhaupt logisch ist und sie Dir bekannt vorkommt. Ein einfaches Zusammenzählen aller Atome ist nämlich nur sehr selten die richtige Lösung: z.B. reagieren CH4 + O2 nicht zu CH4O2, sondern zu CO2 + H2O (Kohlenstoffdioxid und Wasser!).
Reaktionsgleichungen: Ein typischer Schülerfehler...
Der häufigste Schülerfehler beim Erstellen von Reaktionsgleichungen ist, dass Schüler einfach Stoffe und Verbindungen erfinden, da deren Formel gut beim mathematischen Ausgleichen helfen würde!
z.B. Eisenoxid reagiert mit Kohlenstoff zu Eisen und Kohlenstoffdioxid
=> Eisenoxid + Kohlenstoff ---> Eisen + Kohlenstoffdioxid + E
Fe2O3 + C ---> Fe + ??? + E
1. Lösungsweg - waagerecht gelesen - völlig falsch, führt nicht zum Ergebnis!
Der Schüler denkt sich, dass 2 Eisenatome entstehen, weil ja anfangs 2 vorliegen und dazu 3 O freiwerden, welche mit C zu CO3 reagieren. Wäre ja sehr praktisch!
=> Eisenoxid + Kohlenstoff ---> Eisen + Kohlenstoffdioxid
Fe2O3 + C ---> 2Fe + CO3 (Aua)
Was ist passiert? Statt einfach die Formel für Kohlenstoffdioxid hinzuschreiben - die weiß der Schüler doch aus dem Namen(!), wird gleich gerechnet und waagerecht geschaut, was frei wird.
Nun müsste in jedem Buch der Welt die Formel von Kohlenstoffdioxid zu CO3 verändert werden!
Das ist ehrlich gesagt alles Murks! Um eine Formel zu Erstellen, sollte man niemals waagerecht schauen. Entweder kennt man eine Formel oder man schlägt sie nach.
2. Lösungsweg - zuerst senkrecht lesen - richtige Lösung!
Zuerst schreibt man aus der Wortgleichung alle Formel auf. D.h. es wird senkrecht gearbeitet:
Eisenoxid hat die Formel Fe2O3, Kohlenstoff ist C usw...
=> Eisenoxid + Kohlenstoff ---> Eisen + Kohlenstoffdioxid + E
Fe2O3 + C ---> Fe + CO2 + E
Diese Gleichung ist noch nicht ausgeglichen, nun muss gerechnet werden. Dazu gilt: auf beiden Seiten der Gleichung muss die gleiche Anzahl der jeweiligen Atome vorliegen. Wenn das nicht automatisch der Fall ist, müssen einzelne Reaktionspartner mit ganzen Zahlen multipliziert werden.
Wenn also 3 O am Anfang vorliegen und nur 2 entstehen sollen, dann sucht man z.B. den kleinsten gemeinsamen Nenner und erweitert in diesem Fall auf 6!
=> Eisenoxid + Kohlenstoff ---> Eisen + Kohlenstoffdioxid + E
2 Fe2O3 + C ---> Fe + 3 CO2 + E
Jetzt sind auf beiden Seiten 6 O vorhanden, jetzt muss man noch nach Kohlenstoff und Eisen schauen. Es liegen 4 Eisenatome vor, diese müssen also auch entstehen (=> 4 Fe entstehen) und es entstehen 3 CO2, also benötigt man auch 3 C bei den Ausgangsstoffen.
=> Eisenoxid + Kohlenstoff ---> Eisen + Kohlenstoffdioxid + E
2 Fe2O3 + 3 C ---> 4 Fe + 3 CO2 + E
Übung zum Erstellen von Reaktionsgleichungen I
a) Vereinigungen
|
Eisen |
+ |
Schwefel |
----> |
Eisensulfid |
+ |
E |
|
+ |
----> |
FeS |
+ |
E |
||
|
+ |
----> |
Fe2S3 |
+ |
E |
||
|
Kupfer |
+ |
Schwefel |
----> |
Kupfersulfid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Kohlenstoff |
+ |
Sauerstoff |
----> |
Kohlenstoffdioxid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Schwefel |
+ |
Sauerstoff |
----> |
Schwefeldioxid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Phosphor |
+ |
Sauerstoff |
----> |
Phosphoroxid |
+ |
E |
|
+ |
----> |
P4O10 |
+ |
E |
||
|
Eisen |
+ |
Sauerstoff |
----> |
Eisenoxid |
+ |
E |
|
+ |
----> |
FeO |
+ |
E |
||
|
+ |
----> |
Fe2O3 |
+ |
E |
||
|
Kupfer |
+ |
Sauerstoff |
----> |
Kupferoxid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Magnesium |
+ |
Sauerstoff |
----> |
Magnesiumoxid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Aluminium |
+ |
Sauerstoff |
----> |
Aluminiumoxid |
+ |
E |
|
+ |
----> |
Al2O3 |
+ |
|||
b) Bildung der Säuren aus Nichtmetalloxid und Wasser
|
Kohlenstoffdioxid |
+ |
Wasser |
----> |
+ |
E |
|
|
+ |
----> |
+ |
||||
|
Schwefeloxid |
+ |
Wasser |
----> |
+ |
||
|
SO3 |
+ |
----> |
+ |
|||
|
SO2 |
+ |
----> |
+ |
|||
|
Phosphoroxid |
+ |
Wasser |
----> |
+ |
||
|
+ |
----> |
+ |
||||
Übung zum Erstellen von Reaktionsgleichungen II
a) Oxidationen (Vereinigungen)
|
Schwefel |
+ |
Sauerstoff |
----> |
Schwefeloxid |
+ |
E
|
|
+ |
----> |
SO |
+ |
E |
||
|
+ |
----> |
SO2 |
+ |
E |
||
|
----> |
SO3 |
+ |
E |
|||
|
Kohlenstoff |
+ |
Sauerstoff |
----> |
Kohlenstoffdioxid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Kohlenstoff |
+ |
Sauerstoff |
----> |
Kohlenstoffmonooxid |
+ |
E |
|
+ |
----> |
+ |
||||
|
Stickstoff |
+ |
Sauerstoff |
----> |
Stickstoffoxid |
+ |
E |
|
+ |
----> |
NO2 |
+ |
|||
|
+ |
----> |
N2O |
+ |
|||
|
+ |
----> |
N2O4 |
+ |
|||
|
Schwefeldioxid |
+ |
Sauerstoff |
----> |
Schwefeltrioxid |
+ |
E |
|
+ |
----> |
+ |
||||
b) Laugenbildung aus Metalloxid und Wasser
|
Natriumoxid |
+ |
Wasser |
----> |
+ |
E |
|
|
Na2O |
+ |
----> |
NaOH |
+ |
||
|
Calciumoxid |
+ |
Wasser |
----> |
+ |
E |
|
|
CaO |
+ |
----> |
Ca(OH)2 |
+ |
||
c) Neutralisation
|
Salzsäure |
+ |
Natronlauge |
----> |
Wasser |
+ |
Natriumchlorid |
+ |
E |
|
+ |
----> |
+ |
NaCl |
+ |
||||
|
Salzsäure |
+ |
Magnesiumlauge |
----> |
Wasser |
+ |
Magnesiumchlorid |
+ |
E |
|
+ |
----> |
+ |
MgCl2 |
+ |
||||
d) Zersetzungen
|
Kohlenstoffdioxid + E |
----> |
Kohlenstoff |
+ |
Sauerstoff |
|
----> |
+ |
|||
|
Quecksilberoxid + E |
----> |
+ |
||
|
HgO |
----> |
+ |
Übung zum Erstellen von Reaktionsgleichungen III
e) Umsetzungen
|
Zink |
+ |
Salzsäure |
----> |
Zinkchlorid |
+ |
Wasserstoff |
+ |
E |
|
+ |
----> |
ZnCl2 |
+ |
+ |
||||
|
Magnesium |
+ |
Salzsäure |
----> |
Magnesiumchlorid |
+ |
Wasserstoff |
+ |
E |
|
+ |
----> |
+ |
+ |
|||||
|
Zinksulfid |
+ |
Salzsäure |
----> |
Zinkchlorid |
+ |
Schwefelwasserstoff |
+ |
E |
|
ZnS |
H2S |
|||||||
f)Aufgaben für Profis
|
Alkohol |
+ |
Sauerstoff |
----> |
Wasser |
+ |
+ |
E |
|
|
C2H5OH |
+ |
----> |
+ |
+ |
||||
|
Stickstoffmonooxid |
+ |
Sauerstoff |
----> |
Stickstoffdioxid |
+ |
E |
||
|
+ |
----> |
+ |
||||||
|
Stickstoffdioxid |
+ |
Wasser |
----> |
Salpetersäure |
+ |
Stickstoffmonooxid |
+ |
E |
|
+ |
----> |
+ |
+ |
|||||
|
Stickstoffmonooxid |
+ |
Stickstoffdioxid |
----> |
di-Stickstofftrioxid |
+ |
E | ||
|
+ |
----> |
+ |
||||||
|
Stickstoffdioxid |
+ |
Sauerstoff |
----> |
di-Stickstofftpentaoxid |
+ |
E | ||
|
+ |
----> |
+ |
||||||
|
Kohlenstoffmonooxid |
+ |
Wasserstoff |
----> |
Methan |
+ |
Wasser |
+ |
E |
|
+ |
----> |
CH4 |
+ |
+ |
||||
|
Benzin |
+ |
Sauerstoff |
----> |
Wasser |
+ |
Kohlenstoffdioxid |
+ |
E |
|
C8H18 |
+ |
----> |
+ |
+ |
||||
|
Wasserstoff |
+ |
----> |
Chlorwasserstoff |
+ |
E | |||
|
+ |
----> |
+ |
||||||
|
+ |
----> |
Aluminiumchlorid |
+ |
E |
||||
|
+ |
----> |
AlCl3 |
+ |
|||||
|
Magnesium |
+ |
----> |
+ |
Kohlenstoff |
+ |
E |
||
|
+ |
CO2 |
----> |
+ |
+ |
Übung zum Erstellen von Reaktionsgleichungen IV
Bildung von Stickstoffmonoxid aus den Elementen.
Neutralisation von Fluorwasserstoffsäure mit Calciumlauge.
Magnesium reagiert mit Salzsäure zu Magnesiumchlorid (MgCl2) und Wasserstoff.
Bildung von Schwefeltrioxid aus den Elementen.
Neutralisation von Salpetersäure mit Calciumlauge.
Bildung von Di-Stickstofftrioxid aus den Elementen.
Neutralisation von Bromwasserstoffsäure mit Kalilauge.
Bildung von Cl2O7 aus den Elementen.
Neutralisation von Calciumlauge mit schwefeliger Säure.
Verbrennung von H2S2O3 zu Schwefeldioxid und Wasser.
Bildung von Calciumphosphat u.a. aus Phosphorsäure.
Übung zum Erstellen von Reaktionsgleichungen V
-
Erstelle die Reaktionsgleichungen für die folgenden Reaktionen.
-
Kennzeichne abschließend alle Elemente mit einem orangen Strich, alle Moleküle mit einem grünen Strich und alle Salze & Oxide mit einem schwarzen Strich. Säuren werden rot und Laugen blau unterstrichen.
1. Durch Blitze wird die Luft mit Energie aufgeladen. Der sonst so reaktionsträge Luftstickstoff reagiert nun mit Luftsauerstoff zu Stickstoffmonoxid.
2. a) Sauerstoff der Luft oxidiert in einer Reaktion Stickstoffmonoxid zu Stickstoffdioxid.
b) Das Stickstoffdioxid aus Reaktion 2a) wird aufgefangen und dann weiterer Sauerstoff und Wasser zugegeben. Es entsteht Salpetersäure.
3. Saurer Regen enthält schweflige Säure. Kommt diese mit Kalk (Calciumcarbonat) in Kontakt entsteht zuerst Kohlensäure und ein Salz. Die Kohlensäure reagiert in der folgenden Reaktion zu Kohlenstoffdioxid und Wasser. Erstelle beide Reaktionsgleichungen.
4. Wasserstoff kann zur Verwendung in Automotoren und Brennstoffzellen aus glühendem Koks (=Kohlenstoff) und Wasserdampf hergestellt werden. Das zweite Produkt ist ein giftiges Gas.
5. In einer Fabrik wird aus Erdgas Wasserstoff hergestellt. Dieser kann unter anderem als sehr reine Energiequelle genutzt werden. Die Punkte a-d) beschreiben alle ablaufenden Reaktionen. Erstelle die jeweiligen Reaktionsgleichungen.
a) Erdgas enthält fast ausschließlich das Gas Methan (CH4). Reagiert Methan mit Wasser, so entstehen das giftige Gas Kohlenstoffmonoxid und das Dir bekannte Gas Wasserstoff.
b) Das giftige Kohlenstoffmonoxid kann nicht in die Luft gelangen. Man kann es aber mit Sauerstoff zu Kohlenstoffdioxid oxidieren.
c) Das Kohlenstoffdioxid gelangt über einen Schornstein nun in die Luft. Dort kommt es mit Regenwasser in Kontakt. Es entsteht Kohlensäure.
d) Der in a) entstandene Wasserstoff wird zum Heizen eines Hauses in einer Brennstoffzelle verwendet. Dabei reagiert dieser Wasserstoff in einer Vereinigung mit Sauerstoff.
6. Rotes Kupfer oxidiert an der Luft und wird matt-dunkelgrau. Aus der Luft reagieren dabei Kohlenstoffdioxid, Wasser und Sauerstoff gleichzeitig mit Kupfer. Es entstehen Kupfer-(II)-carbonat und Kupfer-(II)-hydroxid.
7. Kohlenmonoxid entreißt in einer chemischen Reaktion Eisen-(II)-oxid den Sauerstoff. Es entstehen ein Gas und ein reines Metall.
8. Kupfer und Säuren: Kupfer reagiert mit Salzsäure kaum. Unter Luftabschluss ist es chemisch inert gegen alle Konzentrationen von Salzsäure sowie gegenüber verdünnter Schwefelsäure. Mit Salpetersäure bzw heißer Schwefelsäure ist jeweils eine Reaktion möglich. Erstelle beide Reaktionsgleichungen.
a) Kupfer + Salpetersäure + H+ reagiert zu Stickstoffdioxid, Kupferionen und Wasser
b) Kupfer + Schwefelsäure reagiert zu Kupfersulfat, Schwefeldioxid und Wasser:
9) Wasserstoff reagiert mit Stickstoff, um Ammoniak zu bilden.
10) Ammoniak wird verbrannt (= oxidiert) und reagiert zu Stickstoffdioxid.
12) Salpetersäure reagiert mit Ammoniak zu Ammoniumnitrat ((NH4)+(NO3)–).
Übung zum Erstellen von Reaktionsgleichungen VI
Benne alle Verbindungen (über der Formel!) und gleiche dann die Reaktionsgleichungen aus.
-
Tipps: Die Formeln sind schon alle korrekt und müssen nicht geändert werden.
-
Für komplett fremde Verbindungen darfst Du die Namen gerne Online raussuchen, indem Du die Formel in eine Suchmaschine oder bei Wikipedia direkt eingibst.
|
FeS |
+ |
O2 |
---> |
Fe3O4 |
+ |
SO2 |
|
CuO |
+ |
C |
---> |
Cu |
+ |
CO2 |
|
FeS |
+ |
O2 |
---> |
Fe3O4 |
+ |
SO3 |
|
CuO |
+ |
Fe |
---> |
Cu |
+ |
Fe3O4 |
|
Cu2 O |
+ |
Zn |
---> |
Cu |
+ |
ZnO |
|
CuO |
+ |
Fe |
---> |
Fe2O3 |
+ |
Cu |
|
Al |
+ |
Cu2 O |
---> |
Al2O3 |
+ |
Cu |
|
Mg |
+ |
Cu2O |
---> |
MgO |
+ |
Cu |
|
Al |
+ |
ZnO |
---> |
Al2O3 |
+ |
Zn |
|
FeS |
+ |
O2 |
---> |
Fe2O3 |
+ |
SO3 |
|
B2O3 |
+ |
H2O |
---> |
B(OH)3 |
||
|
Al2 O3 |
+ |
S |
---> |
Al |
+ |
SO2 |
|
Al2 O3 |
+ |
SO |
---> |
Al |
+ |
SO3 |
|
Al |
+ |
MgO |
---> |
Al2O3 |
+ |
Mg |
|
MgO |
+ |
HCl |
---> |
MgCl2 |
+ |
H2O |
|
Ca(OH)2 |
+ |
CO2 |
---> |
CaCO3 |
+ |
H2O |
|
Mg |
+ |
CO2 |
---> |
MgO |
+ |
C |
|
CO |
+ |
H2O |
---> |
CO2 |
+ |
H2 |
|
Ca |
+ |
H2O |
---> |
Ca(OH)2 |
+ |
H2 |
|
FeS |
+ |
O2 |
---> |
Fe2O3 |
+ |
SO2 |
|
ZnS |
+ |
O2 |
---> |
ZnO |
+ |
SO2 |
|
HgS |
+ |
O2 |
---> |
Hg |
+ |
SO2 |
|
NiO |
+ |
CO + H2 |
---> |
Ni |
+ |
H2O + CO2 |
|
Ni |
+ |
CO |
---> |
Ni(CO)4 |
||
|
FeS2 |
+ |
O2 |
---> |
Fe2O3 |
+ |
SO2 |
|
VO2 |
+ |
O2 |
---> |
V2O5 |
||
|
FeSO4 |
---> |
Fe2O3 |
+ |
SO2 + O2 |
||
Umsetzung von Magnesium mit Salzsäure – wie lautet die Formelgleichung?
Woher wissen Chemiker eigentlich immer genau, wie die Formel einer Verbindung ist? Nachdem Du nun vom Gesetz der vielfachen Massenverhältnisse theoretisch weißt, soll hier gezeigt werden, wie man eine Formel praktisch bestimmt.
V: In diesem Versuch wird Mg in HCl gebracht. Die Produkte werden untersucht. Das Ziel ist, die Formel des entstehenden Salzes zu bestimmen.
B: Wir beobachten, wie sich das Magnesium auflöst und eine heftige Gasentwicklung stattfindet. Die Knallgasprobe ist positiv.
S: Es bildet sich Wasserstoff. Bei der Reaktion wird Energie frei. Das Chlorid hat den Bindungspartner gewechselt. Es fand eine Umsetzung statt.
Die Gleichung ist so noch nicht ausgeglichen. Wenn man es tut, bekommt man zwei Möglichkeiten
Magnesium + Salzsäure ---> Wasserstoff + Magnesiumchlorid + E
Es gibt zwei Möglichkeiten für die Formel des Salzes Magnesiumchlorid - nur eine ist richtig:
a) Mg + 2HCl ---> H2 + MgCl2 + E
oder: b) 2Mg + 2HCl ---> H2 + 2MgCl + E
Das Gesetz der vielfachen Proportionen erklärt, das es möglich ist Atome in vielfachen Massenverhältnissen zusammen zu vereinigen. Doch woher weiß man in der Praxis, wie viele Atome miteinander reagieren?
Wie kann man entscheiden, ob Reaktion 1 oder 2 vorliegt?
Beide Reaktion unterscheiden sich durch das Verhältnis
der Magnesiumatome zu Wasserstoffmolekülen.
=> ein Zusatzversuch ist notwendig!
Quantitative Untersuchung der Reaktion.
Der 2. Versuch ist ungefähr der gleiche Versuch wie V1, nur wird dieses Mal das Produkt aufgefangen und das Volumen bestimmt.

Vorwissen:
1 mg Magnesium enthält 2,48 · 1019 Atome
1 ml Wasserstoff enthält 2,68 · 1019 Wasserstoffmoleküle
|
m (Mg) |
=> Anzahl Mg-Atome |
V (H2) |
Umrechnung auf Normalbedingungen Vo = 0,922 x V |
=> Anzahl H2 -Moleküle |
|
|
V2a |
30,5 mg |
=> 7,564 x 1020 |
30,55 ml |
28,17 |
=> 7,55 x 1020 |
|
V2b |
33,3 mg |
=> 8,26 x 1020 |
33,5 ml |
30,7 |
=> 8,23 x1020 |
Schlussfolgerung:
Anzahl Mg - Atome = 7,564 x 1020 = 1
Anzahl H2 -Moleküle 7,55 x 1020 1
Ein Mg-Atom setzt ein Wasserstoff-Molekül frei. Da ein H2 Molekül aus zwei Atomen besteht,
=> Das Atom-Verhältnis von Mg zu Wasserstoff ist 1:1 => die korrekte Reaktionsgleichung ist
Mg + 2 HCl ---> H2 + MgCl2 + E
Eine Reaktion, bei der gleichzeitig eine Vereinigung des einen Stoffes und eine Zersetzung des anderen stattfindet, nennt man „Umsetzung“.
Wiederholungsspiel II
- Beschreibe die Reaktion von Magnesium mit Salzsäure.
- Beschreibe, was man erhält, wenn man Säure und Lauge gleicher Konzentration mischt.
- Nenne drei Säuren mit Formel.
- Nenne zwei Laugen mit Formel.
- Was sagt der Massenerhaltungssatz aus?
- Was sagt der Energieerhaltungssatz aus?
- Was sagt das Gesetz der vielfachen Massenverhältnisse aus?
- Worin liegt die Erweiterung des Gesetzes der vielfachen Massenverhältnisse im Vergleiche zu den konstanten Massenverhältnissen?
- Stelle die Reaktionsgleichung der Bildung von Fe2O3 auf.
- Stelle die Reaktionsgleichung der Bildung von SO2 auf.
- Stelle die Reaktionsgleichung der Bildung von SO3 auf.
- Stelle die Reaktionsgleichung der Bildung von CO2 auf.
- Welcher Stoff entsteht, wenn man Phosphoroxid und Wasser mischt?
- Welcher Stoff entsteht, wenn man Stickoxid (NO2) und Wasser mischt?
- Welcher Stoff entsteht, wenn man Kohlenstoffdioxid und Wasser mischt?
- Freies Lehrbuch "Anorganische Chemie": 08 Radioaktivität
- Freies Lehrbuch "Anorganische Chemie": 09 Hauptgruppen des PSE
- Freies Lehrbuch "Anorganische Chemie": 10 Nebengruppen des PSE und Metalle
- Freies Lehrbuch "Anorganische Chemie": 11 Redoxreaktionen, Metallgewinnung und Energiediagramm
- Freies Lehrbuch "Anorganische Chemie": 12 Redoxreaktionen der großtechnischen und industriellen Chemie
- Freies Lehrbuch "Anorganische Chemie": 13 Chemisches Rechnen
- Freies Lehrbuch "Anorganische Chemie": 14 Ionen, Salze, Fällungsreaktionen und Ionenbindung
- Freies Lehrbuch "Anorganische Chemie": 15 Die Atombindung (Elektronenpaarbindung)
- Freies Lehrbuch "Anorganische Chemie": 16 Säure - Base - Reaktionen (nach dem Donator-Akzeptor-Prinzip)
- Freies Lehrbuch "Anorganische Chemie": 17 Redoxreaktionen als Elektronenübergänge
- Freies Lehrbuch "Anorganische Chemie": 18 Elektrochemie I
- Freies Lehrbuch "Anorganische Chemie": 19 Das Orbitalmodell als Atommodell
- Freies Lehrbuch "Anorganische Chemie": 20 Physikalische Chemie I - Grundlagen der Thermodynamik und des Energieumsatzes
- Freies Lehrbuch "Anorganische Chemie": 22 Das chemische Gleichgewicht
- Freies Lehrbuch "Anorganische Chemie": 23 Löslichkeit von Salzen & das Löslichkeitsprodukt
- Freies Lehrbuch "Anorganische Chemie": 24 Säure-Base-Gleichgewichte
- Freies Lehrbuch "Anorganische Chemie": 25 Elektrochemie II - Transportable Energie: Batterien, Akkus und Knopfzellen
- Freies Lehrbuch "Anorganische Chemie": 27 Analytik und Ionennachweise