- Details
- Zugriffe: 32701
Kapitel 22: Das chemische Gleichgewicht
![]()
Was ist ein chemisches Gleichgewicht?
1. Einstellung des chemischen Gleichgewichts
V1: Pipettierversuch1: Mit einer Pipette wird immer die gleiche Menge Flüssigkeit aus zwei Standzylindern ausgetauscht. Ein Standzylinder enthält dabei farbiges Wasser.
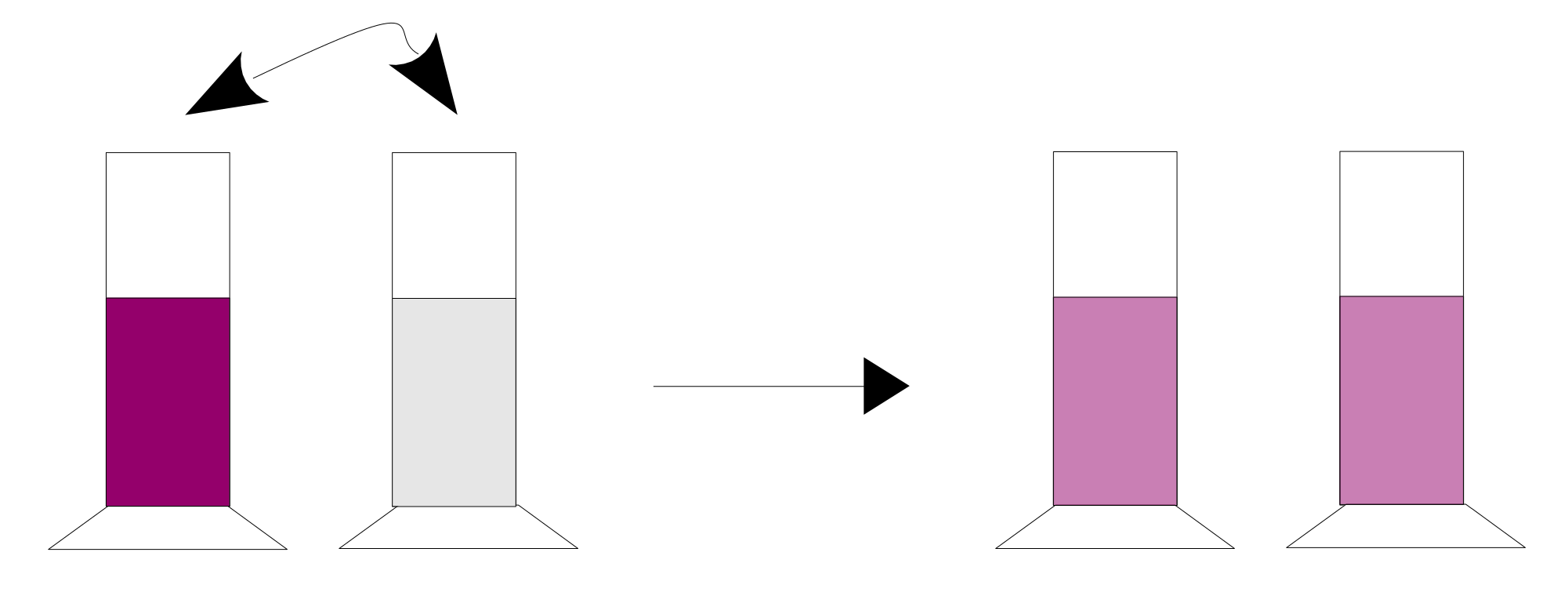
V2: Pipettierversuch 2: Zwischen beiden Standzylindern wird wieder Wasser ausgetauscht, diesmal mit zwei verschieden großen Pipetten.
B: In beiden Fälle stellt sich nach mehreren Austauschvorgängen ein Farbgleichgewicht ein.
S: In den meisten Fällen stellt sich ein Gleichgewicht ein, bei dem Produkte und Edukte nicht im Verhältnis von 1/1 vorliegen wie beim 1. Pipettierversuch. Die Lage des Gleichgewichts ist z.B. auf die Seite der Produkte „verschoben“.

Pipettierversuch 1

Pipettierversuch 2
Chemisches Gleichgewicht I: reversible Reaktionen
Demonstrationsexperiment:
V1: Salzsäure und Ammoniak aus geöffneten Flaschen werden nebeneinander gehalten.
B1: Es bildet sich ein hellgrauer Rauch.
S1: Ammoniumchlorid ist entstanden.
HCl + NH3 ⇌ NH4Cl ΔH < 0
V2: Ammoniumchlorid wird im Reagenzglas erhitzt. An den Rand des Reagenzglases wird angefeuchtetes Indikatorpapier befestigt.
B2: Das Indikatorpapier färbt sich rot.
S2: Ammoniumchlorid zersetzt sich zu Chlorwasserstoff und Ammoniak.
NH4Cl ⇌ HCl + NH3 ΔH > 0
=> Chemische Reaktionen sind (zum großen Teil) umkehrbar (reversibel).
Schülerversuche:
V3: Trocknen von blauem CuSO4 in der Brennerflamme, dann erneute Wasserzugabe (vorher abkühlen lassen).
V4: Zum Calciumoxid wird Wasser gegeben und die Temperatur mit den Händen oder einem Thermometer gemessen. Das Gemisch wird dann in der Brennerflamme erhitzt. Ordne die Begriffe exotherm und endotherm zu!
B: Die Reaktionen bei V3 und V4 sind offensichtlich umkehrbar.
S: (Alle) Reaktionen sind umkehrbar (=reversibel). Allerdings lassen es oft die Umstände nicht zu, eine Reaktion mal einfach so rückgängig zu machen.
Die Reaktionsenthalpien für Hin- und Rückreaktion weisen grundsätzlich umgekehrte Vorzeichen auf. Der Betrag ist dabei exakt gleich!
Chemisches Gleichgewicht II: Das Chromat - Dichromatgleichgewicht, ein Säure-Base-Gleichgewicht
Etwas Kaliumchromat und etwas Kaliumdichromat (erbgutschädigend) werden in Wasser gelöst. Dann wird zur Kaliumchromatlösung Schwefelsäure und zur Kaliumdichromatlösung Wasser zugegeben.
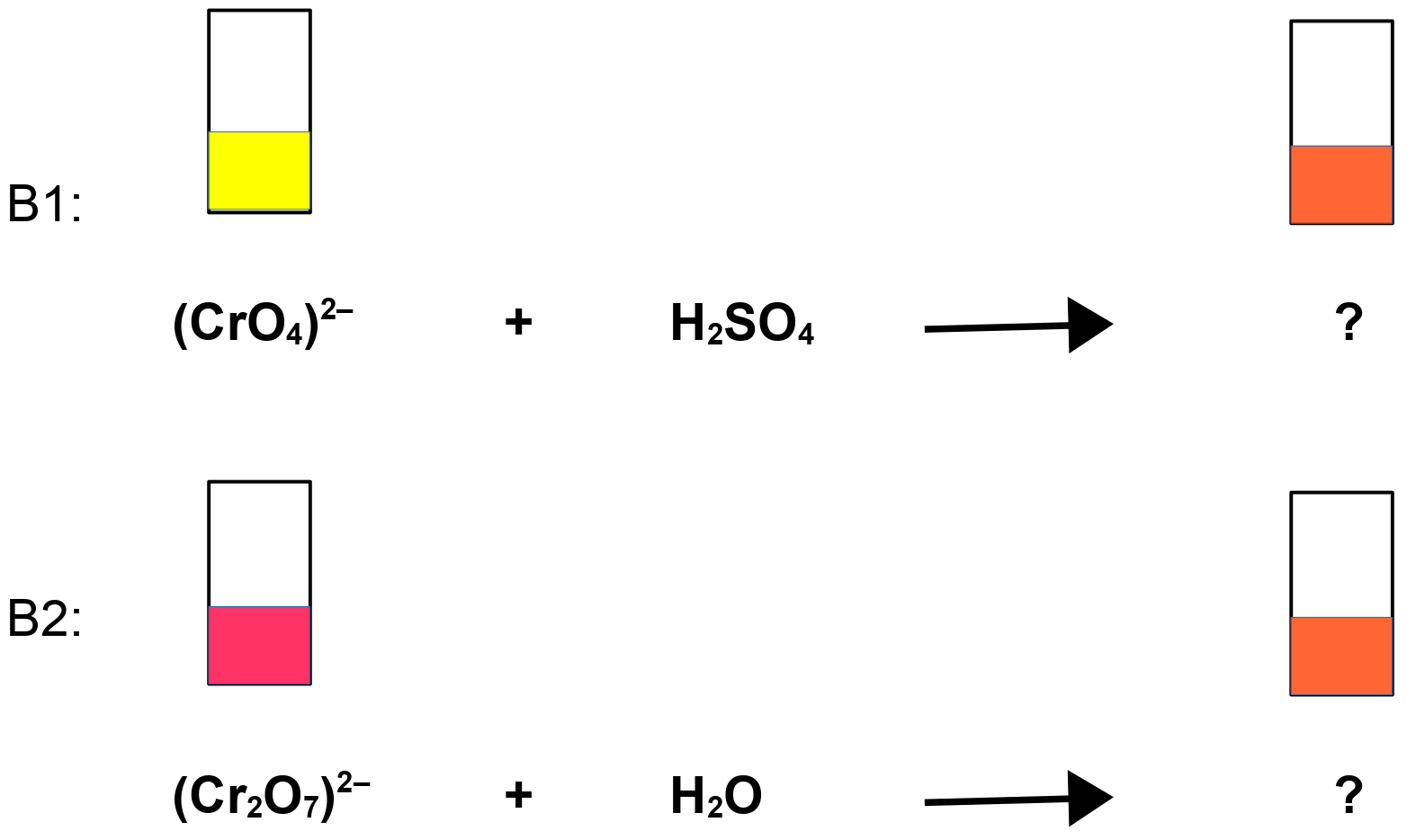
S: Chromationen (gelb) reagieren mit Säure zu Dichromationen (hellrot). Die Reaktion kann durch Zugabe von Wasser umgekehrt werden, d.h. Dichromationen reagieren mit Wasser zu Chromationen. Aber offensichtlich laufen die Reaktionen beide nicht vollständig ab. Es bleibt in jedem Fall auch Edukt in der Produktlösung erhalten. Es kommt zur Mischfarbe orange!
zu V1: 2(CrO4)2- + 2 H3O+ ⇌ (Cr2O7)2– + 3 H2O
gelb orange
Chromation Dichromation
zu V2: (Cr2O7)2- + 2 OH- ⇌ 2(CrO4)2– + H2O
orange gelb
=> Die Reaktion ist umkehrbar (reversibel): 2 (CrO4)2– + 2 H3O+ ⇌ (Cr2O7)2– + 3 H2O
Bei vielen Reaktionen laufen Hin- und Rückreaktion gleichzeitig (und ohne Ende permanent) ab. Es liegt nach einer gewissen Zeit der Einstellung ein Gleichgewicht vor. Ein Kennzeichen von chemischen Gleichgewichten ist das Vorhandensein von Produkten und Edukten!
Hinweis: Chromate und Dichromate sind cancerogen! Zur Entsorgung sollten sie zu den etwas harmloseren Cr3+-Ionen reduziert werden.
Aufgaben:
1. Zeichne die Valenzstrichformeln von (CrO4)2- und (Cr2O7)2-
2. Gibt man zur Dichromatlösung Lauge (OH)- hinzu, so entsteht wieder gelbe Chromatlösung. Kannst Du begründen warum?
3. Eine Aufgabe um Durchblick zu schaffen: Ist es egal, ob man von Dichromat oder Kaliumdichromat spricht - und ist es egal, ob man die Reaktionsgleichung mit Dichromat oder Kaliumdichromat aufstellt?
Chemisches Gleichgewicht III: Bildung von Eisenthiocyanat
1. Versuche
V1a:
Durchführung: Man löst in je 300 ml Wasser:
0,27 g (0,001 mol) Eisentrichlorid
0,29 g (0,003 mol) Kaliumthiocyanat (KSCN)
und gibt die Lösungen zusammen.
Reaktionsgleichung: [Fe(H2O)6]³+ + 3 SCN– ⇌ [Fe(H2O)3(SCN)3] + 3 H2O
vereinfacht Fe³+ + 3 SCN– ⇌ Fe(SCN)3
V1b: Aufteilung der Lösung in drei Reaktionsgefäße:
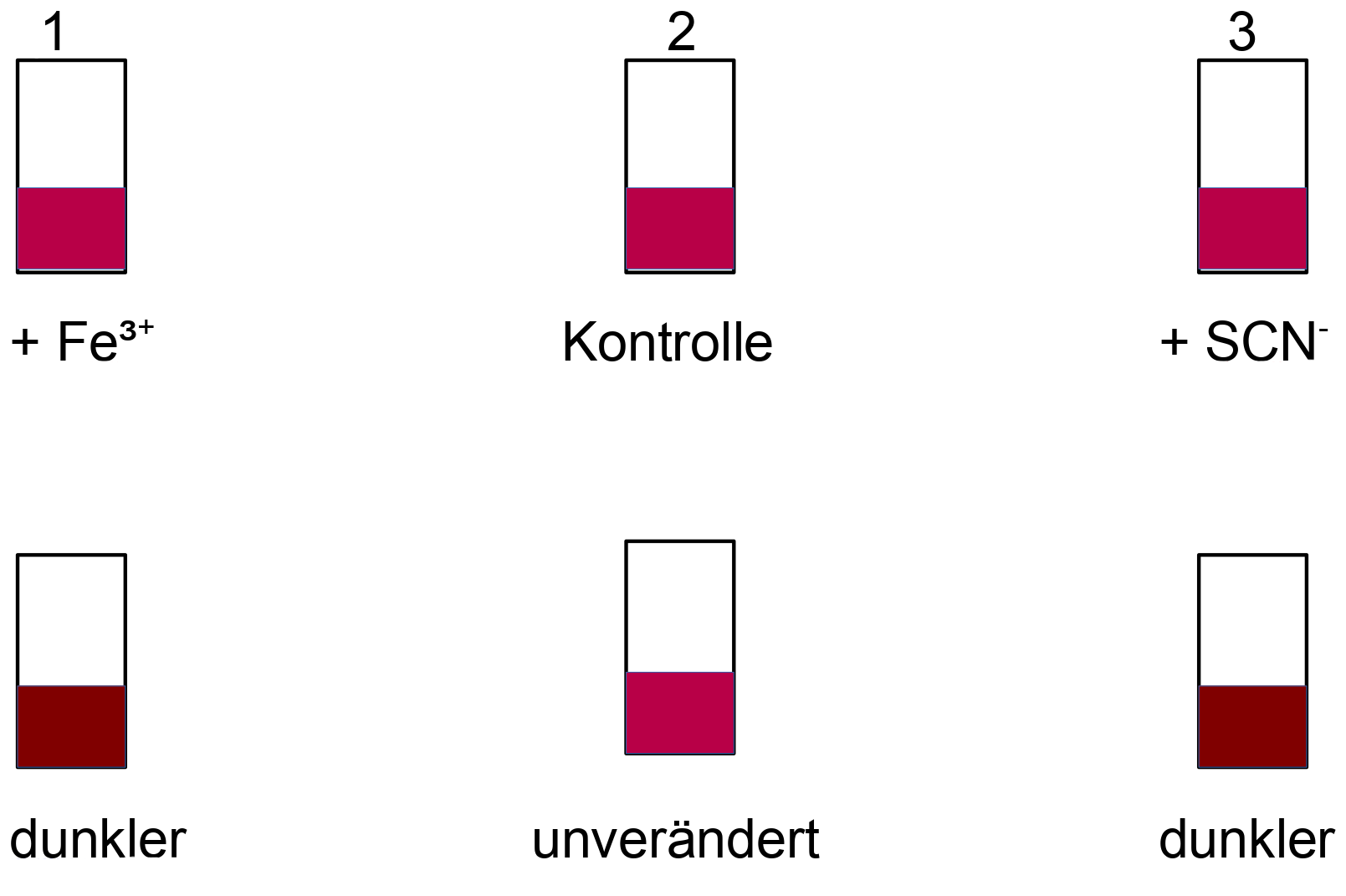
Schlussfolgerungen:
1) In der Lösung 1 müssen noch SCN– vorhanden gewesen sein.
2) In der Lösung 3 müssen noch Fe³+ vorhanden gewesen sein.
=> Die Ausgangsreaktion (I) verlief nicht vollständig !
Begründung: Instabilität des gebildeten Fe(SCN)3-Komplexes !
Der Gleichgewichtspfeil verdeutlicht den Gleichgewichtszustand:
Einzelreaktionen:
Fe³+ + 3 SCN– ---> Fe(SCN)3 Bildung („HIN“)
Fe(SCN)3 ---> Fe³+ + 3 (SCN)– Zerfall („RÜCK“)
=> Neue Schreibweise: Fe³+ + 3 SCN– ⇌ Fe(SCN)3
Chemisches Gleichgewicht IV: NO2 und N2O4 - ein chemisches Gasgleichgewicht
V: Durch die Reaktion von Salpetersäure mit Kupfer wird Stickstoffdioxid hergestellt.
In einem verschlossenen (zugeschmolzenen Reagenzglas wird das Gas NO2 untersucht.
Das Reagenzglas wird leicht erwärmt bzw. abgekühlt.
B: Das Gas NO2 (braun) wird beim Abkühlen immer heller. Bei -11°C ist es farblos und wird fest. Beim Erwärmen wird der Kolbeninhalt dunkler.
=> Es muss neues NO2 gebildet worden sein.
=> Auch bei Raumtemperatur muss noch N2O4 vorhanden gewesen sein (Quelle für neues NO2 ).
2 NO2 ⇌ N2O4 ΔH = -56 kJ/mol
braun farblos
|
N2O4 |
NO2 |
|
|
- 10 °C |
100 % |
0 % |
|
27 °C |
70 % |
30 % |
|
50 °C |
43 % |
57 % |
|
135 °C |
1 % |
99 % |
|
140 °C |
0 % |
100 % |
=> Es liegt ein temperaturabhängiges Gleichgewicht vor. Der Gleichgewichtszustand ist von „beiden Seiten“ erreichbar.
Was geschieht bei Temperaturen unter -10 °C oder über 140 °C? Ist die Reaktion hier zum Stillstand gekommen?
Im Gleichgewichtszustand zerfallen ständig ebenso viele N2O4 -Moleküle wie neue gebildet werden. Die Reaktion kommt also nur von außen gesehen zum Stillstand.
=> es liegt ein dynamisches Gleichgewicht vor
Hin- und Rückreaktion laufen hier gleichzeitig nebeneinander ab und führen (im geschlossenen System) zu einem Gemisch aller an der Reaktion beteiligten Stoffe. Chemische Gleichgewichte stellen sich nicht sofort ein. Sie benötigen (etwas) Zeit zur Einstellung ihres Gleichgewichtszustands.
Einfluss der Temperatur:
Je wärmer es ist, desto schneller geschieht die Einstellung des Gleichgewichtszustandes. Wärme begünstigt den endothermen Reaktionsschritt.
Chemisches Gleichgewicht V: Untersuchung der Bildung von Essigsäuremethylester
Langzeitversuch:
In einen Erlenmeyerkolben werden 0,4 mol Essigsäure (2,4 g/ 2,3ml) und 0,4 mol Ethanol (1,8 g/ 2,2 ml) vermischt und dann wird etwas Schwefelsäure hinzugegeben.
In einem zweiten Kolben werden 0,4 mol Essigsäuremethylester (3,5 g/ 3,9 ml) und 0,4 mol Wasser (7,2 ml) und etwas Schwefelsäure vermischt (Die Reaktion ist langsam und es dauert mehrere Tage, bis sich ein komplettes Gleichgewicht einstellt.).
Konzentrationsbestimmung der gebildeten Produkte:
Durch Pipettieren von entnommenen Probelösungen wird die Konzentration bestimmt.
Dazu verdünnt man die entnommene Lösung mit 120ml Wasser und fügt etwas Universalindikator hinzu.
Aus einer Bürette wird nun so lange Natronlauge zugefügt (c(NaOH) = 1 mol/l), bis ein Farbumschlag eintritt, der eine alkalische Lösung anzeigt.
Ergebnisse der Konzentrationsmessung:
|
Gefäß 1 |
Essigsäure |
Ethanol |
Essigsäureethylester |
Wasser |
|
Vor der Reaktion |
0,4 mol |
0,4 mol |
0 mol |
0 mol |
|
Nach einiger Zeit |
0,14 mol |
0,14 mol |
0,26 mol |
0,26 mol |
|
Gefäß 2 |
Essigsäure |
Ethanol |
Essigsäureethylester |
Wasser |
|
Vor der Reaktion |
0 mol |
0 mol |
0,4 mol |
0,4 mol |
|
Nach einiger Zeit |
0,14 mol |
0,14 mol |
0,26 mol |
0,26 mol |
Es handelt sich um eine umkehrbare Reaktion, eine so genannte Gleichgewichtsreaktion. Bei umkehrbaren Reaktionen laufen Hin- und Rückreaktion gleichzeitig ab (und zwar die ganze Zeit über! Die Reaktion scheint nur optisch zum Stillstand gekommen zu sein).
=> Die Reaktion der Essigsäureethylesterbildung ist eine Gleichgewichtskonzentration. Egal, ob man die Edukte oder die Produkte miteinander mischt - nach einiger Zeit stellt sich ein Gleichgewicht ein, welches in diesem Fall etwas stärker auf der Seite der Produkte liegt.
Wie kann man sich das vorstellen? (siehe auch nochmal dem Pipettierversuch). Bei umkehrbaren Reaktionen kommt es zur Einstellung eines chemischen Gleichgewichts.
Im Gleichgewichtszustand liegen alle Reaktionsteilnehmer (Produkte und Edukte) vor. Ihre Mengen (Konzentrationen) verändern sich praktisch nicht mehr, obwohl die Reaktion weiter fortläuft.
Da Hin- und Rückreaktion weiterhin stattfinden, handelt es sich um ein dynamisches (und nicht um ein statisches) Gleichgewicht! Hin- und Rückreaktion laufen immer gleichzeitig nebeneinander ab und führen (im geschlossenen System) zu einem Gemisch aller an der Reaktion beteiligten Stoffe.
Umkehrbare Reaktionen symbolisiert man mit einem Doppelpfeil:
Allgemeine Reaktion: A + B ⇌ C + D
Bei umkehrbaren Reaktionen stellt sich nach einiger Zeit ein dynamischer Gleichgewichtszustand ein, in dem alle Reaktionsteilnehmer (Produkte und Edukte) vorliegen. Ihre Konzentrationen verändern sich praktisch nicht mehr.
Definition chemisches Gleichgewicht:
Das chemische Gleichgewicht ist eine Reaktion, in der die Gesamtreaktion makroskopisch als beendet erscheint, mikroskopisch aber „Hin“- und „Rück“-Reaktion weiterhin ablaufen.
Die beobachtbare Reaktionsgeschwindigkeit ist null. Dennoch laufen „Hin“- und „Rück“-reaktion) gleich schnell in beide Richtungen weiter. Es handelt sich daher nicht um ein statisches Gleichgewicht, wie es makroskopisch erscheint, sondern um ein dynamisches Gleichgewicht, in dem weiterhin die Reaktionen ablaufen.
Merkmale des chemischen Gleichgewichts:
- Im Gleichgewichtszustand ist der Quotient aus dem Produkt der Konzentrationen der Produkte und dem Produkt der Konzentrationen der Edukte konstant. Dieser Quotient wird auch Gleichgewichtskonstante [k] genannt.
- Im Gleichgewicht sind die Gleichgewichtskonzentrationen genannt.
- Der Wert dieser Gleichgewichtskonstanten ist von mehreren Faktoren (wie der Temperatur, dem Druck usw.) abhängig und für jede Reaktion charakteristisch.
- Hin- und Rückreaktion laufen konstant ab
Dieses Video verdeutlicht den Gleichgewichtszustand: https://www.youtube.com/watch?v=3PZX-Jw9VME
Messprotokoll einer Veresterungs- /Verseifungsreaktion
Erinnere Dich, die Veresterung ist die Reaktion einer Säure mit einem Alkohol. Im Grunde ist es eine Neutralisation, bei der eine Säure mit einer Base reagiert. Es bilden sich ein Ester und Wasser. Die Rückreaktion nennt man auch Verseifung.
Essigsäure + Ethanol ⇌ Essigsäureethylester + Wasser
Schritt 1 (Vorstunde): Planung des Experiments. Wie kann man Gleichgewichtskonzentrationen bestimmen?
Es gibt zwei Möglichkeiten hier die Gleichgewichtskonzentrationen zu bestimmen:
a) Messung des pH-Werts während der Reaktion
b) Entnahme von Flüssigkeit und Titration mit 0,5 mol/l NaOH
Schritt 2: Schülergruppe wird aufgeteilt:
Gruppe a) baut die Apparatur mit Ölbad und Rückflusskühler usw. auf. Sie ist auch später für die Entnahme der Lösungen verantwortlich.
Gruppe b) berechnet mit n=m/M wieviel g Ethanol man abwiegen muss, um eine 1molare Lösung zu erhalten. Wichtig: Zum Schluss werden nur 100ml Lösung benötigt!
Gruppe c) berechnet mit n=m/M wieviel g Essigsäure man abwiegen muss, um eine 1molare Lösung zu erhalten. Wichtig: Zum Schluss werden nur 100ml Lösung benötigt!
Gruppe d) erstellt eine 0,5 mol/l NaOH-Titrationslösung.
Schritt 3: Durchführung:
Ethanol und Essigsäure werden in einem Rundkolben mit Rückflusskühler gefüllt. Dieser sollte eine seitliche Öffnung haben, damit alle 10 Minuten eine Probe von jeweils 5 ml entnommen werden kann.
Damit die Reaktion schnell abläuft (normalerweise dauert sie bei Raumtemperatur ca. 2 Tage!) arbeitet man bei 200°C im Ölbad. Pro Messung entnimmt man 5 ml Lösung, welche sofort in Eiswasser abgekühlt wird.
Zwei Gruppen bekommen eine Titrationsanlage. Sie messen alle 10 min. eine Probe und bestimmen
über eine Volumenmessung (durch Titration mit Natronlauge) im Abstand von 10min die Konzentration von Produkten und Edukten. Die Werte werden an der Tafel notiert.
Aus dem Volumen wird über den folgenden Zusammenhang die Konzentration berechnet:
cSäure · VSäure = cBase · Vbase => cSäure = ( cBase · Vbase) / VSäure
Variation des Experimentes:
Als Variation kann man auch zwei Rückflusskühler aufbauen und folgendermaßen starten:
Gruppe 1 hat als Ausgangslösung 200ml eines Gemisches aus 1 mol Ethanol und 1 mol Essigsäure.
Gruppe 2 hat als Ausgangslösung 200 ml eines Gemisches aus 1 mol Essigsäureethylester und 1 mol Wasser.
|
Zeit [min] |
Gruppe 1: V(Lauge) [ml] |
Gruppe 1 c(Essigsäure) [mol/l] |
Gruppe 2: V(Lauge) [ml] |
Gruppe 1 c(Essigsäure) [mol/l] |
|
10 |
17,8 |
1,2 |
||
|
20 |
14,9 |
2,1 |
||
|
30 |
13,3 |
3,0 |
||
|
40 |
12,4 |
3,8 |
||
|
50 |
11,6 |
4,5 |
||
|
60 |
11,2 |
5,3 |
||
|
80 |
10,3 |
6,6 |
||
|
110 |
9,9 |
8,0 |
||
|
140 |
9,8 |
8,9 |
||
|
170 |
9,6 |
9,3 |
||
|
200 |
9,5 |
9,5 |
||
|
230 |
9,5 |
9,5 |
Zur Auswertung muss folgendes getan werden:
1. Berechne die Konzentration der Essigsäure.
2. Werte beide Messungen aus, indem zuerst ein gemeinsames Koordinatensystem erstellt wird, bei dem die Konzentration an Essigsäure (y-Achse) gegen die Zeit (x-Achse) aufgetragen wird.
3. Überlege: Ist die Reaktion nach 230 min. wirklich zum Stillstand gekommen?
Beispiele für Gleichgewichtsreaktionen
Gleichgewichtstypen
Man unterschiedet grob zwischen:
- Lösungsgleichgewichten
- Gasgleichgewichten
- Säure-Base-Gleichgewichten
- Redox-Gleichgewichte
Wichtige Beispiele für chemische Gleichgewichte
- Iod-Wasserstoff-Gleichgewicht
- Esterbildungs-Gleichgewicht
- Carbonat-Hydrogencarbonat-Gleichgewicht
Merkmale eines chemischen Gleichgewichts
Folgende Merkmale sind für Gleichgewichtsreaktionen typisch:
- Gleichgewichte liegen in geschlossenen Systemen vor.
- Gleichgewichte sind dynamisch, d.h. Hin- und Rückreaktion laufen ständig ab.
=> Das Verhältnis der Konzentrationen von Edukten zu Produkten ändert sich im Gleichgewicht nicht mehr!
- Zur Einstellung des Gleichgewichtes ist es egal, ob dabei von den Edukten aus oder von den „Produkten“ aus gestartet wird.
- Die Reaktionsgeschwindigkeit der Hinreaktion ist im Gleichgewicht gleich der Reaktionsgeschwindigkeit der Rückreaktion.

=> VHinreaktion = VRückreaktion
Gleichgewichtsreaktionen werden so notiert (per Definition), dass sie als exotherme Reaktion aufgestellt werden, also das exotherme Produkt rechts in der Reaktionsgleichung steht. Die Edukte stellen sozusagen die endothermen Produkte der Rückreaktion dar.
A + B ⇌ C + D ΔH < 0
Einstellung des chemischen Gleichgewichtes
Wasserstoff-Iod-Redox-Gasgleichgewicht
Wasserstoffgas und das Element Iod, welches schon bei 30°C beginnt in die Gasphase überzugehen, regieren miteinander zu Iodwasserstoff. Es liegt eine Redoxreaktion vor. Bei höheren Temperaturen stellt sich das Gleichgewicht schneller ein.
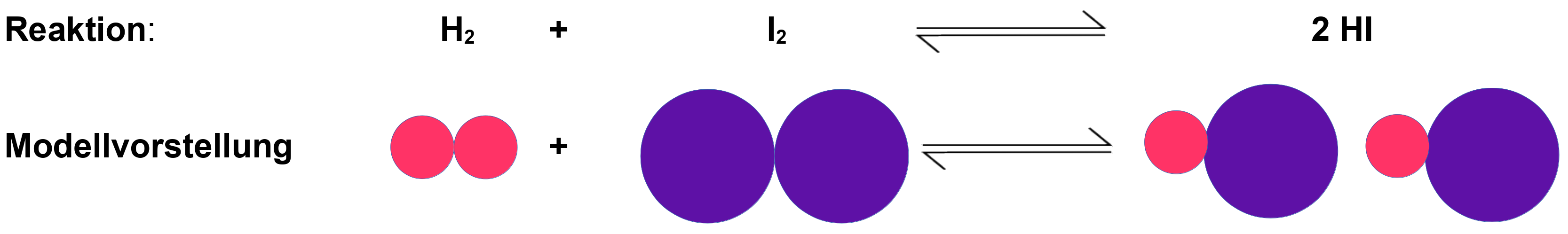
Beispiel: Temperatur = 450 °C
co(HI) = 0 mol/l
co(H2) = co(I2) = 1 mol/l
Im Gleichgewicht: c(H2) = c(I2) = 0,22 mol/lWie ändern sich die Ausgangskonzentrationen von H2, I2 und HI mit der Zeit bis zur Einstellung des Gleichgewichts?
Welche Konzentration von HI liegt im Gleichgewicht vor?
(=> c(HI) = 1,56 mol/l)
Zur Erklärung: Würde die Reaktion komplett ablaufen und 1 (!) mol HI entstehen, wäre das Ergebnis 1. Es bleiben aber 0,22 mol der Edukte zurück => Es würde (1 - 0,22) mol Produkt entstehen. Da aber die doppelte Menge Produkt entsteht (siehe Reaktionsgleichung H2 + I2 2 HI), muss das Ergebnis also mal 2 genommen werden: c(HI) = (2 · (1 - 0,22) = 1,56 mol/l
Wie lautet die Gleichung für die Reaktionsgeschwindigkeit der Hinreaktion?
vhin = khin · c(H2) · c(I2)
vrück = krück · c2(HI)
Ein Reaktion ist dann im chemischen Gleichgewicht, wenn Edukt(e) und Produkt(e) der Reaktion in einem bestimmten und von der Reaktionsdauer unabhängigen Stoffmengenverhältnis pro Volumen vorliegen. Diese Konzentration bleibt dann konstant.
Aufgaben:
- Wie lautet die Gleichung für die Reaktionsgeschwindigkeit der Rückreaktion?
- Zeichne die Konzentrationsänderung im Laufe der Gleichgewichtseinstellung, wenn man von HI als Ausgangsstoff ausgeht.
co(HI) = 2 mol/l
co(H2) = co(I2) = 0 mol/l
T = 450 °C
Das Massenwirkungsgesetz am Beispiel des Iodwasserstoffgleichgewichts
Reaktion: H2 + I2 ⇌ 2 HI
Konzentrationen zu Beginn:
Reaktionsgeschwindigkeit:
Zu Beginn nur Edukte: Δv = vhin = khin · c0(H2) · c0(I2)
Nach Reaktionsbeginn: Verringerung der Konzentration der Edukte, Zunahme der Produktkonzentration.
Δv = vhin - vrück
=> Δv + vrück = vhin
Im Gleichgewicht: Δv + vrück = vhin
Da im Gleichgewicht gilt: Δv = 0
=> vhin = vrück
Im Gleichgewicht gilt also: khin · cGlgw (H2) · cGlgw (I2) = krück · cGlgw2(HI)
Beachte: k = (Reaktions)-Geschwindigkeitskonstante
Auflösung nach den Geschwindigkeitskonstanten:
khin cGlgw2(HI)
——— = Kc = —————————————— = Massenwirkungsgesetz (MWG)
krück cGlgw (H2) · cGlgw (I2)
Beachte: Kc = Gleichgewichtskonstante
Allgemein gilt:
a A + b B ⇌ c C + d D cGlgwc(C) · cGlgwd(D)
Kc = ————————————————
cGlgwa(A) · cGlgwb(B)
[C]c · [D]d
bzw.: —————————
[A]a · [B]b
Kc ist die für eine bestimmte Temperatur gültige Gleichgewichtskonstante.
Sie wird aus den Gleichgewichtskonzentrationen c berechnet.
(Kc für Konzentrationsgleichgewichte, Kp für Gasgleichgewichte, in denen die Partialdrücke bekannt sind.)
Per Definition ist das Gleichgewicht immer so aufgestellt,
dass die Produkte des exothermen Schrittes im Zähler stehen.
Dabei sind c(A), c(B), c(C), c(D) die molaren Gleichgewichtskonzentrationen der Edukte bzw. Produkte. Sie werden auch häufig als [A], [B], [C] und [D] notiert. Im Exponenten finden sich die stöchiometrischen Koeffizienten, also die Anzahl der Teilchen des jeweiligen Stoffes, die für einen Formelumsatz benötigt wird.
Aussagen des MWG
Was bedeutet hohes / niedriges Kc?
Je größer Kc ist, desto weiter ist das Gleichgewicht zu den Produkten verschoben!
(LK) Berechnung für H2 + I2 ⇌ 2 HI bei 450 °C
[1,56 mol/l]2
Kc = ——————— = 50,28
[0,22 mol/l]2
Merke: Liegt ein Reaktionspartner im Gleichgewicht als Feststoff (s) oder als Flüssigkeit (l) vor - vor allem, wenn er im Überschuss vorhanden ist, so ist dessen Konzentration im Gleichgewicht konstant.
Konstante Konzentrationen können bei der Aufstellung des MWG vernachlässigt werden. Für das korrekte Massenwirkungsgesetz, müsste die Konzentration des Kohlenstoffs also einberechnet werden, da sie bei einem Feststoff, im Vergleich zum Gas im Labor sich aber kaum ändern wird, kann sie weggelassen werden.
z.B. 2 CO ⇌ CO2 + C (s)
cGlw (CO2) · cGlw (C)
Kc = —————————————
cGlw2(CO)
=>
cGlw (CO2)
Kc = —————————
cGlw2(CO)
Die Gleichgewichtskonstante macht eine Aussage über die Lage und die Energetik einer Reaktion. Sie gibt keine Information über die tatsächliche Reaktionsgeschwindigkeit oder die Dauer bis zum Einstellen des Gleichgewichtszustandes.
Zusatzinformationen:
http://de.wikipedia.org/wiki/Gleichgewichtskonstante
Das Gleichgewicht im offenen System
Unterscheide:
- Stoff- und Energieaustausch mit der Umgebung => offenes System
- Kein Stoffaustausch mit der Umgebung => geschlossenes System
- Kein Stoff- und Energieaustausch mit der Umgebung => isoliertes System
Ein Beispiel für ein offenes System: Kalkbrennen
ΔT
CaCO3 -----> CO2 + CaO
Da die ganze Zeit das Produkt Kohlenstoffdioxid entweicht, kann sich kein Gleichgewicht einstellen. Die Reaktion kommt also nicht zum Stillstand, die Edukte werden komplett umgesetzt!
Fließgleichgewichte:
Liegt im offenen System eine Reaktion des folgenden Typs vor
A -----> X
X -----> B
und sind VA->X und VX->B gleich groß, so wird von X ebenso viel verbraucht, wie in der gleichen Zeit entsteht.
=> Die Konzentration von X bleibt konstant!
Solche Fließgleichgewichte findet man oft bei biochemischen Reaktionen. Durch sie ist die Konstanz unseres „inneren Milieus“ gesichert.
Der Blutpuffer wäre ein solches Beispiel, da durch ihn, der pH-Wert des Blutes sehr exakt konstant gehalten wird.
Kann man Gleichgewichte beeinflussen?
a) Beispiel 1: Das Eisenchlorid - Eisenthiocyanat - Gleichgewicht
V: Je 50 ml Eisen(III)chloridlösung und Ammoniumthiocyanatlösung werden zusammengeschüttet. Die Lösung wird auf zwei Reagenzgläser verteilt:
a) Lösung 1 wird erwärmt.
b) Lösung 2 wird im Eisbad abgekühlt.
B: Beim Erhitzen wird die Lösung heller, beim Abkühlen wird sie dunkler.
S: FeCl3 + 3NH4(SCN) ⇌ Fe(SCN)3 + 3NH4Cl ΔH<0
(gelb) (rot)
Die hellere Farbe beim Erhitzen deutet auf eine Verschiebung zur Seite der Edukte hin. Der Schritt zur endothermen Reaktionsseite (links) wird begünstigt. Abkühlen hingegen bewirkt eine Verschiebung zur Seite der Produkte. Der exotherme Reaktionsschritt (rechts) wird also durch Abkühlen begünstigt.
Aufgaben:
1. In einigen Chemiebüchern wird die Reaktion folgendermaßen beschrieben:
Fe3+ + 3 SCN– ⇌ Fe(SCN)3
Vergleiche und bewerte die beiden Darstellungsmöglichkeiten.
b) Das Prinzip des kleinsten Zwanges
Für derartige Verschiebungen eines Gleichgewichts formulierte 1888 der franz. Chemiker Le Chatelier das „Prinzip von der Flucht vor dem Zwang“.
Übt man auf ein im Gleichgewicht befindlichen System durch die Änderung äußerer Bedingungen einen Zwang aus, so verschiebt sich das Gleichgewicht in die Richtung, dass diesem Zwang ausgewichen wird, also die Folgen des Zwangs verringert werden.
Ein Zwang kann z.B. eine Änderung der Temperatur, des Drucks oder der
Konzentration der Stoffe sein.
Wenn eine Gleichgewichtsreaktion so notiert ist, dass die exothermen Produkte links stehen, so gilt:
Für exotherme Reaktionen dabei: Eine Temperaturerhöhung verschiebt das Gleichgewicht zu Seite der Edukte (da so ein Teil der Wärmeenergie (also der „Zwang“) in der Rückreaktion umgewandelt wird), eine Temperaturverringerung verschiebt es zur Seite der Produkte.
Für endotherme Reaktionen das Gegenteil, das heißt, eine Temperaturerhöhung bewirkt ein verstärktes Bild der Produkte (da die zusätzliche Wärme die exotherme Reaktion „beflügelt“). Eine Temperaturverringerung verschiebt das Gleichgewicht zu den Edukten.
Allgemein: A + B ⇌ C + D ΔH<0
Temperaturerhöhung: Gleichgewicht nach links (←), das heißt, es entstehen mehr Edukte!
Temperaturverringerung: Gleichgewicht nach rechts (→), das heißt, es entstehen mehr Produkte!
Anwendung:
Lenken / Verschiebung eines Gleichgewichts
z. B. Entfernen eines Produktes => ständige Neueinstellung des Gleichgewichts
=> vollständige Umsetzung
c) Beeinflussung der Gleichgewichtskonstanten K durch Temperaturveränderung
Allgemein: A + B ⇌ C + D ΔH<0
[C] · [D] Temperaturerhöhung => [A] · [B] wird größer => K wird kleiner!
Kc = ——————
[A] · [B] Temperaturverringerung => [C] · [D] wird größer => K wird größer!
d) Beispiel 2: Temperaturabhängigkeit des Stickoxidgleichgewichts
Betrachten wir noch einmal das Stickoxid-Gleichgewicht. In einer verschlossenen Glasampulle liegen beide Gase im Gleichgewicht miteinander vor. Der Inhalt der Ampulle hat eine hellbraune Farbe.
2 NO2 ⇌ N2O4 ΔH = -56 kJ
braun farblos
Wenn man die Reaktionsgleichung so notiert, dass im exothermen Schritt die Produkte entstehen, so liegt immer eine negative Reaktionsenthalpie vor (H < 0)!
Was passiert beim Erwärmen?
Beim Erwärmen kann man beobachten, dass die braune Farbe der Gase zunimmt (=> NO2 - Bildung), d.h. das Gleichgewicht wird nach links, hin zu den Edukten verschoben.
Das System „versucht“, diese Energiezufuhr „abzubauen“. Der endotherme Zerfall des N2O4 wird scheinbar begünstigt.
Beim Abkühlen hingegen nimmt die braune Farbe ab. (=> NO2 - Abbau). Die exotherme (energieliefernde) Bildung des N2O4 wird begünstigt.
Erhitzen begünstigt die endotherme, Abkühlen die exotherme Reaktion. Die Gleichgewichtskonstante ändert sich!
Aufgaben:
- Formuliere mit eigenen Worten: Wie wirken sich Konzentrationsänderungen, Druckänderungen und Temperaturänderungen auf das chemische Gleichgewicht aus?
- Wie ändert sich jeweils die Gleichgewichtskonstante? Vorsicht bei der leichtfertigen Antwort ;-)
- Stelle das MWG für die Ammoniakbildung aus den Elementen auf. Die Reaktion ist exotherm. Wie verschiebt sich das Gleichgewicht bei Temperaturerhöhung/ Temperaturverringerung. Wie ändert sie jeweils die Gleichgewichtskonstante. Würde sich eine Volumenänderung (Druckänderung) auswirken?
Konzentrationsabhängigkeit des Gleichgewichts: Das Kohlenstoffdioxidgleichgewicht
Kohlensäure kennt jeder. Sie ist in vielen Erfrischungsgetränken enthalten. Lässt man eine Flasche aber länger offen stehen, so entweicht sie (offenes System)!
Wird eine Sprudelflasche geöffnet, so entstehen scheinbar schlagartig sehr viele Kohlensäurebläschen. Bei diesem Beispiel liegt sowohl ein Gasgleichgewicht, als auch ein Säure-Base-Gleichgewicht vor, da Kohlensäure als schwache Säure reagiert.
Was genau ist eigentlich Kohlensäure?
Kohlensäure ist eine Säure, welche in ihrer eigentlichen Formel (H2CO3) so im Grunde kaum vorkommt! Sie lässt sich unter üblichen Bedingungen nicht als Reinstoff isolieren. Sie existiert nur gelöst in Wasser, wo sie hauptsächlich zu einen Oxoniumion (H3O+ aus Proton + H2O entstanden) und dem Hydrogencarbonatanion reagiert:
(1) H2CO3 + H2O ⇌ (H3O)+ + (HCO3)–
ca. 1% ca 99%
Es liegt aber noch ein zweites Gleichgewicht vor, welches zum Tragen kommt, wenn eine höhere Sättigung mit Kohlensäure vorliegt:
(2) H2CO3 ⇌ H2O + CO2
Die Umkehrreaktion von (2) entspricht übrigens der Bildung von Kohlensäure, die Du aus der Mittelstufe noch kennst (Nichtmetalloxide bilden mit Wasser Säuren).
Liegt nun sehr viel gelöste Kohlensäure in einer Sprudelflasche vor, so reagiert immer ein Teil der Kohlensäure zu Kohlenstoffdioxid. Ist die Sprudelflasche nun geöffnet, kann das Gas Kohlenstoffdioxid die Lösung verlassen (da nun Platz zum Entweichen ist). Das Kohlenstoffdioxid wird also dem Gleichgewicht entzogen, da es nicht zur Kohlensäure zurück reagieren kann! Folglich entsteht immer mehr CO2, welches weiterhin die Sprudelflasche verlässt. Dies geschieht solange, bis sich keine gelöste Kohlensäure mehr im Wasser befindet.
(3) H3O+ + (HCO3)– ⇌ H2O + CO2
Desweiteren läuft bei geringen Wassermengen noch eine weitere Reaktion ab, die Bildung von Carbonationen. Dies ist z.B. beim Eindampfen von Wasser der Fall. Kalkablagerungen wie Kesselstein werden so begünstigt.
(4) H2O + (HCO3)– ⇌ (H3O)+ + (CO3)2–
Ein chemisches Gleichgewicht kann also durch die Entnahme eines Stoffes (Produkt oder Edukt!) beeinflusst werden. Eine Rückreaktion kann so zum Beispiel verhindert werden und so ein Stoff zur 100% Reaktion (also ohne Rückreaktion) gebracht werden.
Zusatzinformationen zum Thema Kohlensäure:
Erinnere Dich an die Mittelstufe: Nichtmetalloxide und Wasser reagieren zu Säuren! Kohlensäure kann also aus dem Gas CO2 hergestellt werden, indem man es unter Druck in Wasser bläst. Dabei lösen sich, je nach Temperatur ca. 0,2% des Gases, indem es zu Kohlensäure reagiert. Die Reaktionsgleichung entspricht der Gleichung (2).
(2) H2O + CO2 ⇌ H2CO3
Im Labor ist es allerdings gelungen im wasserfreien und metallionenfreien Medium flüssiges H2CO3 herzustellen. Dies ist aber eine Ausnahme.
Kohlensäure kommt also im Grunde in drei verschiedenen Kohlensäureformen und als Kohlenstoffdioxid vor:
- freien Kohlensäure (H2CO3)
- gelöstes CO2
- Hydrogencarbonats
- Carbonats
http://de.wikipedia.org/wiki/Kohlensäure
Aufgaben:
1. Interpretiere die vorliegende Grafik unter dem Aspekt, dass die Weltmeere atmosphärisches Kohlenstoffdioxid speichern können und so dem Treibhauseffekt (also der Erwärmung des Planeten durch hohen Konzentrationen von Kohlenstoffdioxid in der Atmosphäre) entgegenwirkt.

Quelle Bild: Public Domain by Wikicommonsuser Leyo; Thank you; https://commons.wikimedia.org/wiki/File:H%C3%A4gg-Diagramm_Kohlens%C3%A4ure.svg
Wie reagiert das Kohlenstoffdioxidgleichgewicht auf Änderungen?
Druck und Volumenänderung:
Bei einer geschlossenen Flasche ist der Platz über der Flüssigkeit gering. Es liegt ein für Gase geschlossenes System vor.
In einer Sprudelflasche befinden sich über der Flüssigkeit in der Gasphase neben Luft auch CO2-Moleküle. Das Gleichgewicht muss zwangsweise auf der Seite der Edukte (also auf der Seite der Kohlensäure) liegen.
H2CO3 + H2O ⇌ H3O+ + (HCO3)– ⇌ H2O + CO2
sehr wenig ⇌ viel ⇌ wenig
Wird die Sprudelflasche nun geöffnet, so nimmt der Druck über der Flüssigkeit sofort ab, da CO2 entweicht. Durch den herrschenden Druck kann man dies sogar als Zischen hören. Es steht nun genügend freier Platz für Gase zur Verfügung.
Der so entstandene „freie“ Platz kann durch weitere Kohlenstoffdioxidmoleküle gefüllt werden. Diese entstehen sofort aus dem Gleichgewicht mit der Flüssigkeit.
Da der Raum über der Flüssigkeit nun enorm groß ist, dem System dadurch sozusagen also ein Produkt entzogen wird, wird solange neues Kohlenstoffdioxid gebildet, bis kein Edukt mehr vorhanden ist. Die Flüssigkeit ist nun abgestanden.
H2CO3 + H2O ⇌ H3O+ + (HCO3)– ⇌ H2O + CO2 (↑)
sehr wenig ⇌ sehr wenig ⇌ viel
Würde man den Druck in einer Sprudelflasche künstlich mit CO2 erhöhen, so würden mehr Gasmoleküle in die Lösung gehen (da sich ja die Konzentration der Gasmoleküle über der Fläche erhöht!).
=> Das Gleichgewicht reagiert auf Druckänderungen. Bei hohem Druck liegt es eher auf der Seite, die weniger Gase freisetzt. Das Gleichgewicht wird also zugunsten der Seite verschoben, welche die geringe Teilchenanzahl aufweist und somit das kleinere Volumen benötigt.
Somit haben Druck- und Volumenänderungen immer dann einen Einfluss auf das Gleichgewicht, wenn sich die Anzahl der Teilchen (oder das Volumen!)
bei Produkten und Edukten unterscheidet.
Würden bei einer Reaktion zwei Gase miteinander zu zwei neuen Gasen reagieren, so würde eine Druckänderung das Gleichgewicht nicht verschieben.
Das Prinzip des kleinsten Zwanges von Le Chatelier und Braun (1888):
Übt man auf ein chemisches Gleichgewicht einen Zwang in Form von Wärme oder Kälte, Druck- oder Volumenänderung bzw. Entzug oder Zugabe von Stoffen aus,so verschiebt sich das Gleichgewicht auf die Seite,welche die Folgen der Änderung am besten kompensiert (also verringert!).
Das Gleichgewicht „passt sich“ also den Änderungen an.
Aufgabe: Sauerstofflöslichkeit in Wasser
Wasser enthält immer etwas gelösten Sauerstoff. Angler und Aquarienfreunde wissen, dass Fische im Sommer, vor allem in wenig bewegten Tümpeln oder schlecht belüfteten Aquarien ersticken können.
- Ist die Sauerstofflöslichkeit abhängig von der Temperatur? Begründe mit dem Prinzip von Le Chatelier.
- Liegt auch eine Abhängigkeit vom Druck vor? Versuche Beispiele zu finden und begründe die Auswirkungen von Druckänderungen ebenfalls mit Le Chatelier.
Die Sauerstofflöslichkeit ist druck- und temperaturabhängig, je wärmer das Wasser, desto weniger Sauerstoff kann sich im Wasser lösen.
Je höher der Druck, desto mehr Sauerstoff löst sich.
Es liegt ein Gasgleichgewicht zwischen gasförmigen Sauerstoff und gelöstem Sauerstoff vor.
Je höher die Temperatur, desto mehr dehnen sich die Gase im Wasser aus und desto mehr Platz beanspruchen die Gasmoleküle. Irgendwann herrscht sozusagen Platzmangel und die Gase verlassen die Flüssigkeit. Das Gleichgewicht wirkt also der Temperaturerhöhung entgegen, indem „neuer Platz durch Verdunstung geschaffen wird“.
Erhöht man hingegen den Druck, dann wird das Gas komprimiert und nimmt ein kleineres Volumen ein. Gelöst verbraucht es zudem weniger Platz im Lösemittel als in der darüber liegenden Gasphase. Dem Druck wird (im Sinne Le Chateliers) entgegengewirkt, indem sich Gasmoleküle im Wasser lösen.
Zusatzinformationen:
Sauerstoffgehalt im Wasser:
> 6 mg/l Wasser => günstig für Fische
< 4-5 mg/l => eher ungünstig für die meisten Fischarten
< 4 mg/l => meist tödlich für Fische
Aufgaben zum Massenwirkungsgesetz:
- Wie wirkt sich eine Druckänderung auf das Gleichgewicht von Stickstoffdioxid und Di-Stickstofftetraoxid aus?
- Fasse zusammen: Wie kann man ein Gleichgewicht verschieben?
- Erkläre das Gasgleichgewicht in den Lungenbläschen, welches zwischen Luftsauerstoff und gelöstem Sauerstoff im Blut herrscht.
- Ammoniumchlorid und Wasser liegen im Gleichgewicht mit Ammoniak und Oxoniumionen. Stelle die Reaktionsgleichung auf und finde einen Weg, das Gleichgewicht zugunsten des Eduktes (des Produktes?) zu verschieben.
- Die Weltmeere sind bekanntlich der größte Kohlenstoffdioxidspeicher. Erkläre den dahinter liegenden chemischen Vorgang und begründe, warum eine Temperaturerhöhung bzw. eine weitere Zunahme des Kohlenstoffdioxidausstoßes der Menschheit den Kohlenstoffdioxidgehalt der Atmosphäre ansteigen lassen.
- Welche der folgenden Reaktionen reagiert (und in welcher Weise) auf eine Veränderung des Volumens?
C + CO2 ⇌ 2CO
CH4 + H2O ⇌ CO + 3H2
CO + NO2 ⇌ CO2 + NO
CaCO3 ⇌ CaO + CO2
2CH4 + O2 + 4N2 ⇌ 2CO + 4H2 + 4N2
2NO + O2 ⇌ 2NO2
CO + H2O ⇌ CO2 + H2
Zusatzinformationen:
http://de.wikipedia.org/wiki/Kohlenstoffdioxid
Dissoziation der Kohlensäure
Kohlensäure dissoziiert natürlich in zwei Stufen. Diese Dissoziation ist pH-Wert abhängig:
- Dissoziationsstufe: CO2 + 2H2O ⇌ H3O+ + HCO3–
- Dissoziationsstufe: HCO3– + H2O ⇌ H3O+ + CO32–
=> eine pH-Wert Verringerung führt zu einer Verschiebung, die mehr CO2 freisetzt. Grund ist die Zunahme an freiem H+. Eine Erhöhung des pH-Werts verschiebt das Gleichgewicht zugunsten von HCO3–.
Erklärung der y-Achse:
Jeweilige Anteile der Kohlensäureformen: CO2, (HCO3)– bzw. (CO3)2– bezogen auf die Gesamtkonzentration. C Gesamt = C(CO2) + C(HCO3–) + C(CO3)2–
Wie entsteht Kesselstein?
In Gebieten mit „hartem“ Wasser, ist das Leitungswasser besonders kalkhaltig. Dies sieht man dem Wasser nicht an, da der Kalk gelöst ist.
Der Kalk löst sich durch im Wasser enthaltenes Kohlenstoffdioxid. Je mehr Kohlenstoffdioxid in Wasser enthalten ist, desto mehr Kalk kann sich auflösen. Kohlenstoffdioxid bildet mit Wasser Kohlensäure, so dass Hydrogencarbonat entsteht, welches dann zu Calciumhydrogencarbonat reagiert, welches sich viel besser in Wasser löst als das schwerlösliche Calciumcarbonat:
CaCO3 (s) + H2O + CO2 ⇌ Ca(HCO3)2 (aq)
Beim Erhitzen des kalkhaltigen Leitungswassers verschiebt sich aber das Gleichgewicht, da restliches enthaltenes CO2 als Gas verdrängt wird. Erinnere Dich: warmes Wasser kann keine Gase lösen!
Das Gleichgewicht verschiebt sich also nach Le Chatelier auf die Seite der Edukte und Kalk wird frei, der sich am Boden des Gefäßes absetzt und fest wird.
Beeinflussung von chem. Gleichgewichten: Konzentrationsabhängigkeit des Gleichgewichts I
V: Untersuchen wir noch einmal das Eisen(III)chlorid/ Eisenthiocyanatgleichgewicht. Dazu wird eine Lösung aus Eisenchlorid und Ammoniumthiocyanat ins Gleichgewicht gebracht und dann auf vier Reagenzgläser verteilt. Jedes Reagenzglas sollte ungefähr die gleiche Füllhöhe haben.
|
Versuchsdurchführung |
Beobachtung |
Schlussfolgerung |
|
RG1: Zugabe von weiterem FeCl3 |
wird dunkelrot |
Glgw. verschiebt sich auf die Seite der Produkte |
|
RG2: Zugabe von weiterem NH4Cl |
wird dunkelrot |
Glgw. verschiebt sich auf die Seite der Produkte |
|
RG3: Zugabe von weiterem Fe(SCN)3 |
wird hellgelb |
Glgw. verschiebt sich auf die Seite der Edukte |
|
RG4: Blindprobe (zum Vergleich) |
FeCl3 + 3NH4(SCN) ⇌ Fe(SCN)3 + 3NH4Cl ΔH<0
(gelb) (rot)
Erhöht man die Konzentration der Edukte, so verschiebt sich das Gleichgewicht auf die Seite der Produkte.
Eine Konzentrationserhöhung der Produkte hingegen verschiebt das Gleichgewicht auf die Eduktseite.
Was passiert, wenn nur ein Edukt hinzugegeben wird?
Die Zufuhr nur eines Eduktes verschiebt die Reaktion ebenfalls auf die Seite der Produkte, besonders, wenn der zweite Eduktpartner in größerer Menge vorliegt.
Was passiert, wenn Stoffe aus dem Gleichgewicht entfernt werden?
In der chemischen Industrie wird oft so verfahren, dass man bei Gleichgewichtsreaktionen nur das gewünschte Produkt dem Gleichgewicht entzieht. Das Gleichgewicht reagiert, indem mehr Edukte zu einem weiteren Produkt reagieren, und dem Zwang (Produktmangel) somit ausgewichen wird.
=> Wegnahme eines Partners verschiebt das Gleichgewicht in die Richtung, die einen weiteren Teil des fehlenden Partners entstehen lässt.
Für derartige Verschiebungen eines Gleichgewichts formulierte 1888 der franz. Chemiker Le Chatelier das „Prinzip von der Flucht vor dem Zwang“:
Übt man auf ein im Gleichgewicht befindlichen System durch die Änderung äußerer Bedingungen einen Zwang aus, so verschiebt sich das Gleichgewicht derart, dass diesem Zwang ausgewichen wird.
Aufgaben:
1. Wie kann man Gleichgewichte beeinflussen? Nenne die Dir bekannten Möglichkeiten.
2. Wiederhole das Prinzip des kleinsten Zwangs. Finde passende Beispiele!
Beeinflussung von chem. Gleichgewichten: Konzentrationsabhängigkeit des Gleichgewichts II
Schauen wir uns nun nochmal das Chromat-/Dichromationengleichgewicht vom Anfang des Kapitels an:
1. Welche Auswirkungen hat eine Zugabe von Säure zum folgenden Chromat-/ Dichromatgleichgewicht?
2CrO42- + 2H3O+ ⇌ Cr2O72- + 3H2O
(gelb) (orange)
2. Erstelle das passende MWG:
cGlgw(Cr2O72-)
Kc = —————————————————
cGlgw2(CrO42-) · cGlgw2(H3O+)
Lösung:
Im neutralen Milieu liegt das Gleichgewicht weitgehend auf der Seite der Edukte (=> Farbe der Lösung gelb). Durch Zugabe von Säure beobachtet man einen Farbwechsel hin zu Orange. Dies ist ein Hinweis auf eine Verschiebung des Gleichgewichtes hin zu den Produkten:
c(H3O+) steigt!
c(Cr2O72-)
Kc > ———————————————
c2(CrO42-) · c2(H3O+)
Der Wert des Bruches wird kleiner als Kc.
„Um wieder ins Gleichgewicht zu kommen“, läuft die Reaktion so lange nach rechts, bis wieder gilt:
cGl(Cr2O72-)
Kc = ———————————————
cGl2(CrO42-) · cGl2(H3O+)
=> Verschiebung des Gleichgewichts nach rechts
Für derartige Verschiebungen eines Gleichgewichts formulierte 1888 der franz. Chemiker Le Chatelier das „Prinzip von der Flucht vor dem Zwang“.
Übt man auf ein im Gleichgewicht befindlichen System durch die Änderung äußerer Bedingungen einen Zwang aus, so verschiebt sich das Gleichgewicht derart, dass diesem Zwang ausgewichen wird.
=> Es findet eine Verschiebung des Gleichgewichts zu den Produkten statt (also ein Ausweichen des Gleichgewichts (nach Le Chatelier) vor dem Zwang der Säurezugabe!)
Anwendung: Lenken (durch Verschiebung) eines Gleichgewichts zugunsten eines teuren Produktes:
=> Entfernen eines Produktes => ständige Neueinstellung des Gleichgewichts
=> vollständige Umsetzung => maximale Ausbeute an Produkten, bei geringstem Einsatz von Edukten!
Vertiefungsaufgaben:
- In diesem Beispiel liegt ein Ausweichen vor dem Zwang der Säurezugabe vor. Wie wirkt sich denn nun eine Zugabe von OH– Ionen auf das Gleichgewicht aus?
Antwort: Zugabe von OH– führt zur Neutralisation von H3O+-Ionen => Zwang => Verschiebung hin zu den Edukten => Gelbfärbung! - Wie wirkt sich eine Druckerhöhung aus?
Antwort: Die Konzentration der gasförmigen Stoffe steigt im allgemeinen, aber hier liegen keine Gase vor!
=> Da weder bei Edukten noch bei Produkten Gase vorliegen, ändert sich die Konzentrationen der beteiligten Stoffe nicht durch eine Druckerhöhung.
Beeinflussung von chem. Gleichgewichten: Druckabhängigkeit des Gleichgewichts
Betrachten wir die Ammoniaksynthese aus den Elementen:
N2 + 3H2 ⇌ 2NH3
Wie verändert sich das Gleichgewicht, wenn man den Druck auf das System verändert?
Beispiel:
c(N2) = 1 mol/l
c(H2) = 1 mol/l
c(NH3) = 1 mol/l
12 mol2 / l2
=> Kp = ——— · —————
1 · 13 mol4 / l4
Bei Änderung des Volumens auf die Hälfte:
c(N2) = 2 mol/l
c(H2) = 2 mol/l
c(NH3) = 2 mol/l
22 mol2 / l2
=> Kp = ——— · —————
2 · 23 mol4 / l4
allg.: a A(g) + b B(g) ⇌ c C(g) + d D(g)
c + d = a + b keine Auswirkung des Drucks
c + d > a + b Gleichgewicht bei Druckerhöhung nach links verschoben
c + d < a + b Gleichgewicht bei Druckerhöhung nach rechts verschoben
Eine Druckerhöhung verschiebt das Gleichgewicht einer chemischen Reaktion auf die Seite
mit der kleineren Stoffmenge gasförmiger Reaktionspartner.
Die Gleichgewichtskonstante Kp bleibt gleich !
Beeinflussung von chem. Gleichgewichten: Druckabhängigkeit des Stickoxidgleichgewichts
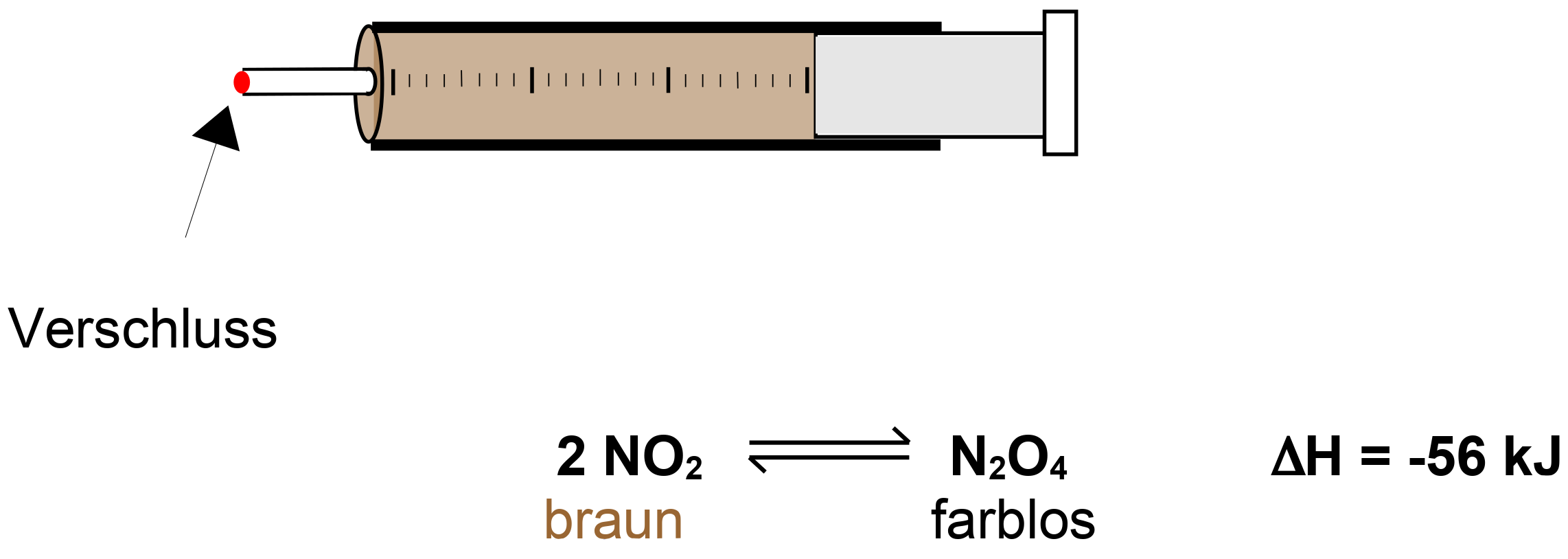
Betrachten wir noch einmal das Stickoxidgleichgewicht. Das Gas wird zur Untersuchung in einen Kolbenprober gefüllt:
2 NO2 ⇌ N2O4 ΔH = -56 kJ
braun farblos
V: Wie verändert das Gleichgewicht seine Lage, wenn in eine Druckveränderung in dem Reaktionsgefäß stattfindet? Zur Überprüfung wird das Gas im Kolbenprober komprimiert.
B: Ein Komprimieren des Gases im Kolbenprober führt zur Entfärbung! Ein Dekomprimieren (also ein Herausziehen des Stempels) führt zur Farbsättigung.
S: Gasteilchen, egal wie groß sie sind, nehmen immer das gleiche Volumen ein (erinnere Dich an das Kapitel zum molaren Volumen: 1 mol eines Gases nimmt bei Standardbedingungen 24,4 Liter und bei Normalbedingungen 22,4 Liter ein.).
Bei einer Druckerhöhung verschiebt sich das Gleichgewicht auf die Seite des N2O4, da sich somit die Teilchenanzahl verringert.
Bei Druckerhöhung verschieben sich Gasgleichgewichte zu der Seite,welche die geringe Teilchenanzahl hat.Eine Druckverringerung verschiebt das Gleichgewicht zu der Seite, welche ein größere Teilchenanzahl hat. Dies ist an den Koeffizienten in der Reaktionsgleichung ablesbar.
Siehe auch: Das heterogene Gleichgewichtssystem FeO/CO und das Boudouard-Gleichgewicht: http://www.chemieunterricht.de/dc2/mwg/g-feo_co.htm
Thermodynamische Überlegungen zum Massenwirkungsgesetzes (LK)
Das Massenwirkungsgesetz ist eine Formel, welche aus den Reaktionsgeschwindigkeitsgesetzen abgeleitet wurde:
Allgemein gilt:
A + B ⇌ C + D
=> V = - k · [A] · [B] sowie V = k · [C] · [D]
Da im Gleichgewichtszustand beide Geschwindigkeiten gleich sind, kann man die Formeln beide gleichsetzten und die beiden k zu einem neuen K zusammenfassen. Das negative Vorzeichen fließt in die neue Konstante mit ein:
- k · [A] · [B] = k · [C] · [D] =>
-k [C] · [D]
— = K = ———————
k [A] · [B]
Eine thermodynamische Betrachtung des Massenwirkungsgesetzes hingegen ist etwas komplizierter.
Man stellt sich dazu vor, dass man die Energiezustände am Ende der Rückreaktion und am Ende der Hinreaktion vergleicht:
Wir nehmen folgendes Gleichgewicht an.
Allgemein gilt:
A + B ⇌ C + D
Die folgende Formel der freien Gibb'schen Energie beschreibt eine Verbindung des ersten und zweiten Hauptsatzes der Thermodynamik:
ΔG = ΔG0 + R · T · ln K
K= Gleichgewichtskonstante
R = 8,314 J/k·mol (allgemeine Gaskonstante)
ΔG0 = ΔG bezogen auf Standardbedingungen (1mol/l, 293,3K, 1013,25hPa)
Für K setzten wir nun das MWG ein:
[C]c · [D]d
ΔG = ΔG0 + RT · ln ————————
[A]a · [B]b
=> liegen im Gleichgewicht alle Konzentrationen bei 1 mol/l, so gilt: ΔG = ΔG0.
Für das chemische Gleichgewicht gilt weiterhin: ΔG = 0, da im Gleichgewichtszustand keine Arbeit mehr geleistet wird und sich freiwilliges Ablaufen und nicht freiwilliges Ablaufen die Waage halten.
Fasst man nun diese Gleichungen zusammen, gilt:
0 = ΔG0 + RT · ln K
ΔG0 = - RT · ln K
Also lässt sich daraus die freie Gibb'sche Energie im Standardzustand berechnen:
Dazu fügen wir die Gleichungen zusammen:
[C]c · [D]d
=> ΔG = - RT · ln K + RT · ln ———————
[A]a · [B]b
Diese Beziehung, die man erhält, gilt für beliebige chemische Reaktionssysteme, welche sich nicht im Gleichgewichtszustand befinden! (= van´t Hoffsche Reaktionsisotherme)
Da Reaktionen nur Ablaufen, wenn ΔG negativ ist, kann man nun mithilfe dieser Gleichung vorhersagen, wie und in welche Richtungen Reaktionen ablaufen.
Übungsaufgaben zum MWG
Tipp zur Vorgehensweise beim Rechnen mit dem Massenwirkungsgesetz:
- Überlege zuerst, welche Größen bereits bekannt sind und welche gesucht sind.
- Reaktionsgleichung aufstellen.
- MWG aufstellen.
- Gleichgewichtskonzentrationen errechnen und einsetzen.
1. Bildung von Chlorwasserstoff aus den Elementen:
Es gilt:
H2 (g) + Cl2 (g) ⇌ 2HCl (g) ΔH = - 278 kJ/ mol
Bei 300°C liegen im Gleichgewicht folgende Konzentrationen vor:
[H2] = 0,5 mol/l,
[Cl2] = 0,5 mol/l
[HCl] = 10 mol/l.
a) Stelle das MWG auf und berechne K.
b) Welche Aussage über das Gleichgewicht kann man dem so berechneten Wert K entnehmen?
c) Durch eine weitere Zugabe von Wasserstoff, liegt nun eine Gleichgewichtskonzentration der Edukte von 1 mol/l Wasserstoff und weiterhin 0,5 mol/l Chlor vor. Berechne die Konzentration an Chlorwasserstoff im Gleichgewicht.
Lösung:
a)
[HCl]2 102 mol2/l2
K= ——————— = —————————— = 400
[H2] · [Cl2] 0,5 mol/l · 0,5 mol/l
b) Das Gleichgewicht liegt deutlich auf Seiten der Produkte
c) K ist konstant
[HCl]2 x2
=> K= ——————— <=> —————————— = 400
[H2] · [Cl2] 1mol/l · 0,5mol/l
<=> x2 = 400 · 1 mol/l · 0,5 mol/l
<=> x2 = 200 mol2/l2
<=> x = √200 = 14,14 mol/l
2. Das Gleichgewicht von Nitrosylchlorid
Nitrosylchlorid (ONCl) kann aus dem Säurerest der salpetrigen Säure und einem Chloridion gebildet werden. Es ist als Gas nicht sehr stabil.
In einem 1 l fassenden Glaskolben wird 1 mol ONCl auf 500K erhitzt. 9% des Gases reagiert zu Stickstoffmonoxid und Chlor.
a) Stelle die Reaktionsgleichung und das MWG auf.
b) Bestimme K.
Lösung:
2ONCl ⇌ 2 NO + Cl2
Vereinfachung: ONCl ⇌ NO + 1/2 Cl2
Da 9% des ONCl dissoziieren, liegen also 91% (0,91 mol) davon vor. 0,09 mol davon reagieren zu den Produkten. Es entstehen also 0,09 mol NO (da das gleiche Anteilverhältnis wie ONCl lauf Reaktionsgleichung vorliegt) und 0,045 mol Chlor.
Alles ins MWG eingesetzt:
[NO]2 · [Cl2] 0,092 mol2/l2 · 0,045 mol/l
K= ——————— = ———————————————— = 4,4 · 10-4
[ONCl]2 0,912 mol2/l2
3. Stickstoffdioxid - Di-Stickstoff-Tetraoxid-Gleichgewicht
Beim Stickstoffdioxid / Di-Stickstoff-Tetraoxid-Gleichgewicht hat man bei 298K die folgenden Konzentrationen gemessen. Bestimme Kc.
[N2O4] = 4,3 · 10-2 mol/l
[NO2] = 1,4 · 10-2 mol/l
Lösung:
2 NO2 ⇌ N2O4 ΔH = -56 kJ
[N2O4] 4,3 · 10-2 mol/l
K= ——————— = ———————————— = 219
[NO2]2 (1,4 · 10-2 )2 mol2/l2
4. Das Schwefelsäure-Kontaktverfahren
Bei 1000K dissoziieren beim so genannten Kontaktverfahren von 1 Liter gasförmigen Schwefeltrioxid (c=0,06mol/l ) 36,7% des Schwefeltrioxids zu Schwefeldioxid und Sauerstoff. ΔH für diese Reaktion ist 198 kJ/mol.
a) Stelle die Reaktionsgleichung und das MWG auf.
b) Bestimme die Gleichgewichtskonzentrationen der beteiligten Substanzen.
c) Bestimme K bei 1000K.
Lösung:
a) Reaktionsgleichung / MWG
2SO3 ⇌ 2SO2 + O2 ΔH = 198 kJ/mol
[A] [B] [C]
cGlgwc(C) · cGlgwd(D)
a A + b B ⇌ c C + d D K = ——————————————
cGlgwa(A) · cGlgwb(B)
Beachten: die Produkte des exothermen Schritts stehen im Zähler!
[SO3]2
=> = —————————
[SO2]2 · [O2]
b) Rechnung
Der Einfachheit halber teilen wir die Reaktionsgleichung nun durch zwei.
2 SO3 ⇌ 2SO2 + O2
SO3 ⇌ SO2 + ½ O2
Das ewige Problem: welche Konzentrationen liegen im Gleichgewicht vor?
Es dissozieren 36,7%, d.h. 63,3% reagieren nicht! Da ich weiß, dass 0,06 mol SO3 vorlagen, folgt daraus, das zum Zeitpunkt des Gleichgewichts folgende Konzentrationen vorliegen:
[SO3] = 0,633 · 0,06 mol/l = 0,03798 mol/l
[SO2] = 0,06mol/l - 0,03798mol/l = 0,02202 mol/l
[O2] = (0,06mol/l - 0,03798mol/l)/2 = 0,01101 mol/l
Erklärung: Im Gleichgewicht liegen die Stoffe natürlich nicht zu 100% vor, da es ja ein Gleichgewicht ist. Das heißt, von den 0,06mol SO3 sind nur noch 63,3% vorhanden. Daraus folgt, dass die Konzentration an SO2 die Differenz von der Ausgangskonzentration minus der nicht reagierten Stoffmenge an SO3 entspricht. Laut Reaktionsgleichung muss die Konzentration an O2 die Hälfte betragen.
Nun noch alles ins MWG einsetzen:
[SO3]2
K = - --------------------
[SO2]2 · [O2]
K = [0,03798 mol/l]2 / [0,02202 mol/l]2 · [0,01101 mol/l]
K = 0,00144 mol/l / 0,0004848mol/l · 0,01101mol/l
K = 271,00 (1 / 3,69.10-3) (einheitenfrei!)
Zum Schluss die Signifikanzbetrachtung:
Die Genauigkeit der Angaben liegt bei nur 2 (!) Nachkommastellen, da die Konzentrationen nur 2 Nachkommastellen vorgaben, obwohl die angegebenen Prozentwerte 3 Nachkommastellen vorgegeben haben.
5. Das Wasserstoff/Iod-Iodwasserstoff-Gleichgewicht
In ein Einlitergefäß wird bei 425°C heißes Iodwasserstoffgas gefüllt. Im Gleichgewicht liegen noch 0,500 mol/l davon vor. K beträgt 54,5. Bestimme die Konzentration der weiteren im Gleichgewicht befindlichen Stoffe.
Lösung:
H2 + I2 ⇌ 2 HI
[HI]2 [HI]2
K= ——————— da aber [H2] = [I2] => ———— = 54,5
[H2] · [I2] [H2]2
[HI]2 (0,500)2 mol2/l2
[H2]2 = ———— = —————————— = 0,0046 mol2/l2
54,5 54,5
[H2] = [I2] = 0,068 mol/l
6. Schwere Aufgabe zum Massenwirkungsgesetz
Ein theoretischer Versuch mit den beiden Stoffen A und B wird durchgeführt. Beide Stoffe reagieren langsam zu dem Produkt C. Es liegt ein Gleichgewicht vor.
A + B ⇌ C
In dem Reaktionsgefäß werden nach der Einstellung des Gleichgewichts die Konzentrationen bestimmt:
cGlgw(A) = 1 mol/l
cGlgw(B) = 1 mol/l
cGlgw(C) = 2 mol/l.
a) Berechne Kc.
b) Nach der ersten Messung wird nun die Konzentration des Stoffes B auf 2 mol/l erhöht. Die Temperatur hat sich nicht verändert. Berechne die neuen Gleichgewichtskonzentrationen der drei Stoffe.
Lösung
a) Gegeben:
cGlgw(A) = cGlgw(B) = 1 mol/l
cGlgw(C) = 2 mol/l
[C]
Kc = ————— = 2 l/mol
[A] · [B]
b) Gesucht: cGlgw´ (X) bei Erhöhung von c(B) auf 2 mol/l
=> neue Ausgangskonzentrationen
co´ (A) = 1 mol/l
co´ (B) = 2 mol/l
co´ (C) = 2 mol/l
Nach Le Chatelier führt eine Zugabe von B zu einer Gleichgewichtsverschiebung hin zu C; da so die Konzentration an B abgebaut wird (und so der Zwang verringert wird).
=> Das Gleichgewicht wird also nach rechts verschoben!
=> Die Konzentration an B nimmt um den Betrag x ab (x mol von B werden bis zur Gleichgewichtseinstellung verbraucht.)
=> Da B immer mit der gleichen Menge A reagiert, nimmt auch dessen Konzentration um den Faktor x ab.
=> Die Konzentration an C nimmt um den Faktor x zu (Achtung nicht 2x, da laut Reaktionsgleichung nur 1 C entsteht!)
=> Die neuen Gleichgewichtskonzentrationen:
cGl´ (A) = (1-x) mol/l
cGl´ (B) = (2-x) mol/l
cGl´ (C) = (2+x) mol/l
2+x mol/l
Nun noch schnell ausrechnen: 2 l/mol = ————————————
(1-x) · (2-x) mol2/l2
<=> 2 ((1-x) · (2-x) ) = 2 + x
<=> 2 (2-x -2x + x2) = 2 + x
<=> 2 (x2 -3x + 2) = 2 + x | -x | -2
<=> 2 x2 - 7 x + 2 = 0 | :2
<=> x2 – 2,3 x + 1 = 0 | :2
p/q-Formel: 1,77 +/- √(1,752 - 1)
=> (x1 = 3,186 - nicht möglich, da B dann negativ wäre!)
=> x2 = 0,314
cGl´ (A) = 1 - 0,314 = 0,686 mol/l
cGl´ (B) = 2 - 0,314 = 1,686 mol/l
cGl´ (C) = 2 + 0,314 = 2,314 mol/l
Weitere Aufgaben
7. Propylsäure-ethylester wird aus der entsprechenden Säure und dem Alkohol gebildet. Die Bildung ist exotherm, K = 4. Berechne die entstehende Stoffmenge an Ester, wenn man 5mol Säure und 3mol Alkohol zusammen mischt?
8. Im Labor wird 1l einer 0,1molarer Ameisensäure hergestellt. Bei 25°C misst man den pH-Wert von 2,38.
a) Stelle die Säuredissoziationsgleichung mit Wasser auf und formuliere das MWG. (Hinweis: c(Wasser) = 1 => Wasser im MWG vernachlässigen!)
b) Berechne K.
c) Wie viel % der eingesetzten Säure sind dissoziiert?
9. Bei 25°C und Normaldruck hat N2O2 zu 20% zu NO reagiert.
a) Stelle die Reaktionsgleichung für diese Dissoziation auf und berechne K.
b) Berechne die prozentuale Dissoziation bei 27°C und 1/10 des Normaldrucks.
10. Bei 420°C reagieren in einem 1l-Glaskolben 1·10-3 mol Wasserstoff mit 1·10-3 mol Iod. Die Reaktion ist exotherm, K = 46. Berechne die Konzentration der einzelnen Stoffe im Gleichgewicht.
Lösungen
7. MWG : K=C(Ester)·C(H2O) / C(Ethanol) · C(Propylsäure)
K soll hierbei gleich 4 sein, damit das so ist, müssen die Stoffe im Verhältnis 4 zu 1 für den Zähler also die Produkte sein.
siehe: K=4/1 = 4
Da beide Stoffe, also Ethanol und Essigsäure im Verhältnis 1:1 reagieren, können nur max. 2mol des Ethanols umgesetzt werden, da für mehr nicht genug Essigsäure vorhanden ist.
Diese 2 mol, die umgesetzt werden, werden im Verhältnis 4 zu 1 umgesetzt , das heißt 1,6 mol werden umgesetzt und 0,4 mol bleiben.
Also 1,6/0,4 = 4/1....
8.
a) H2O + HCOOH ⇌ H3O+ + HCOO–
b) Abgeleitet aus dem MWG gilt folgendes:
[H3O+] · [HCOO–]
Ks = -------------------------
[H2O] · [HCOOH]
[H3O+] = 10-pH = 4.169 · 10–3 mol/l (das ist schon die Konzentration im Gleichgewicht!)
[H3O+] · [HCOO–]
Ks = ------------------------- (MWG mit Wasser = 1, da sich die Konzentration kaum ändert)
1 · [HCOOH]
Ein weiterer Trick hilft: da die beiden Konzentrationen der Produkte gleich sind, kann man sie auch zusammenfassen (als x) [H3O+] = [HCOO–] => [H3O+] · [HCOO–] = x2
x2 [1,738 · 10–5 mol/l]2
=> Ks = -------------------- = ------------------------------------------
[HCOOH]glgw (0,1 mol/l - [4.169 · 10–3 mol/l]) (um den Betrag des H3O+ nimmt ja die Konzentration der Säure ab!)
Ks = 1,813 · 10–4
9. Wenn von 100 N2O2-Teilchen 20 dissoziieren, macht das 40 NO-Teilchen.
Also Summe 120.
Da der Partialdruck zur Stoffmenge proportional ist, folgt daraus: p(N2O2)=2/3 und p(NO)=1/3
Einsetzen und Kp ausrechnen.
10. Reaktionsgleichung:
H2 + I2 ⇌ 2HI
c(H2-GLGW) =10-3 - 0,5x
c(I2-GLGW) =10-3 - 0,5x
c(HI-GLGW) =x
46=x2 / (10-3 - 0,5x)2
x=1,54·10-3
=> c (H2/ I2) = je 2,3 ·10-4 mol/
c (HI) = 1,54·10-3 mol/l
c(H2-GLGW) =10-3 - 0,5x
c(I2-GLGW) =10-3 - 0,5x
c(HI-GLGW) =x
46=x2 / (10-3 - 0,5x)2
x=1,54·10-3
=> c (H2/ I2) = je 2,3 ·10-4 mol/
c (HI) = 1,54·10-3 mol/l
Die Auswirkung von Konzentrationsänderungen der Reaktionsteilnehmer
In dieser Station wirst Du die Gleichgewichtsreaktion von Eisen(III)nitrat und Kaliumthiocyanat kennen lernen. Sie reagieren zum rötlichen Eisen(III)thiocyanat-Komplex:
Fe3+(aq) + 3 SCN– (aq) ⇌ Fe(SCN)3 (aq)
Aufgabe 1: Welche Ionen enthalten die beiden Lösungen?
Aufgabe 2: a) Erstelle das MWG.
b) Wird dem Reaktionsgefäß nach Einstellen des Gleichgewichts neues Fe3+ hinzugefügt, so reagiert das Gleichgewicht. Sage voraus, wie die Reaktion aussehen wird.
c) Was passiert bei Zugabe von weiterem SCN–?
d) Welche Gleichgewichtsverlagerung findet bei einem Entzug von Eisenionen aus der Lösung statt?
e) Überprüfe Deine Vorhersagen experimentell.
Versuch: Gleichgewichtsbeeinflussung durch Konzentrationsänderungen
Material
|
Fe(NO3)3 [0.004 mol/l] KSCN [0.008 mol/l] Gelborange S [1 g/l] Fe(NO3)3, KSCN, NaH2PO4 |
2 50ml Messzylinder 7 Reagenzgläser, Reagenzglasgestell, 3 Tropfpipetten, Pipettenhalter sowie Spatel, Brenner, Spritzflasche destilliertem Wasser, Papiertüchlein |
Beachte: Um Verschmutzungen zu vermeiden, bitte für jede Lösung eine eigene Pipette verwenden. Nicht die Vorratsgefäße mit schmutzigen Spateln verunreinigen!
1.) Messen Sie von den Lösungen der beiden Edukte je 15 ml ab (durch umgießen; Feineinstellung mit Pipette). Vereinigen (und durchmischen) Sie anschließend die beiden Lösungen in einem Messzylinder.
2.) Welche Farben haben die am Gleichgewicht beteiligten Teilchen? Nitrationen sind farblos.
3.) Geben Sie in 6 Reagenzgläser je etwa 5 ml der in (1) erhaltenen Lösung. Das erste Reagenzglas dient als Referenz (damit Sie die Farbe der unveränderten Lösung vor Augen haben). In den anderen 5 Reagenzgläsern werden Sie in den folgenden Schritten das Gleichgewicht verändern.
4.) Geben Sie ins zweite Reagenzglas eine kleine Spatelspitze (nicht einen gehäuften Spatel!) Fe(NO3)3 und schütteln Sie zur Durchmischung. Stimmt die beobachtete Veränderung mit der in Aufgabe 2 vorausgesagten überein?
5.) Welche Veränderung erwarten Sie bei SCN–-Zugabe?
6.) Geben Sie ins dritte Reagenzglas eine kleine Spatelspitze KSCN und schütteln Sie. Wird die Erwartung bestätigt?
7.) NaH2PO4 bildet mit Fe3+ eine Fällung von schwerlöslichem Eisenphosphat. Was erwarten Sie demnach bei NaH2PO4-Zugabe? - Überprüfen sie im vierten Reagenzglas.
8.) Geben Sie in das noch leere Reagenzglas 5ml der Lösung von Gelborange S, einem relativ stabilen organischen Farbstoff. Sie sollte etwa dieselbe Färbung haben wie die noch unveränderte Lösung im fünften Reagenzglas. Verdünnen Sie nun den Inhalt dieser beiden Reagenzgläser mit destilliertem Wasser auf das etwa vierfache Volumen. Was beobachten Sie und wie erklären Sie Ihre Beobachtung (Massenwirkungsgesetz!)?
9.) Bleibt noch das sechste Reagenzglas. Erwärmen Sie es leicht mit dem Brenner (schütteln!). Wie beeinflusst die Temperatur die Gleichgewichtskonstante?
Die großtechnische Erzeugung von Ammoniak: Das Haber-Bosch-Verfahren
Warum brauchen die Menschen Ammoniak?
Pro 100 kg Doppelzentner Weizen werden von den Pflanzen ca. 3 kg Stickstoff dem Boden entnommen und in den Pflanzen gespeichert. Meistens wird Stickstoff in Form von Nitrat aufgenommen.
Dieses Nitrat stammt aus abgestorbenen Pflanzen und Tieren, welche zuerst zu NH3 und NH4-Salzen abgebaut werden. Bakterien stellen dann daraus Nitrat und Nitrit her. In den Pflanzen wird der Stickstoff für Aminosäuren und zum Aufbau der DNA genutzt.
Die natürlichen Mengen an Stickstoff im Boden sind ausreichend für die Natur und die Pflanzen, die darauf wachsen, allerdings nicht für einen intensive Landwirtschaft.
Damit ein Bauer genügend Ernteertrag hat, muss er zusätzlichen Stickstoffdünger zufügen. Doch woher kommt dieser? Bis zum Ende des Ersten Weltkriegs war Deutschland abhängig von Salpeterimporten aus Chile. Salpeter ein älterer Ausdruck für Nitratsalze.
Wissenschaftler hätten damals schon gerne den Stickstoffdünger selbst hergestellt. Schließlich befinden sich in der Luft 78 % N2!
Kann die folgende Reaktion genutzt werden?
N2 + 3 H2 ⇌ 2 NH3 ΔH = -92,5 kJ
Während Wasserstoff eine hohe Reaktivität besitzt, ist Stickstoff extrem reaktionsträge. Es wird ja auch deswegen als Inertgas verwendet!). Einer der Gründe liegt in der sehr festen N - N Dreifachbindung!
Das Problem der Reaktion ist also, dass das Gleichgewicht bei Normalbedingungen und Normaldruck nahezu vollständig auf der linken Seite bei den Edukten liegt. Luftsauerstoff reagiert im Grunde nicht bei diesen Temperaturen!
Wie kann also die Ausbeute erhöht werden?
Ammoniak dient als Rohstoff für die Produktion von
- Dünger (3/4)
- Pflanzenschutzmitteln
- Kunststoffen
- Farbstoffen
- Sprengstoffen
- Medikamenten
Die theoretisch optimalen Versuchsbedingungen mit einer hohen Ausbeute an NH3 wären:
tiefe Temperatur, da es eine exotherme Reaktion ist. Das Problem: die Reaktionsgeschwindigkeit wird zu gering (die Aktivierungsenergie muss überwunden werden !)
hoher Druck, da bei der Reaktion eine Verminderung der Teilchenzahl erfolgt
Das Problem bei zu hohem Druck ist die Explosionsgefahr bei Ermüdung des Materials
geschlossenes System, da eine Reaktion mit gasförmigen Edukten und Produkten vorliegt!
Methoden zur Erhöhung der Ausbeute:
Eine Erhöhung der Temperatur würde die Ausbeute kaum erhöhen, denn dieser Schritt führt zur Verlangsamung der Reaktion, da sie exotherm ist!
Eine Erhöhung des Drucks hingegen ist eine gute Methode, da aufgrund der geringeren Teilchenanzahl bei den Produkten eine Druckerhöhung diesen Schritt begünstigt und somit die Produktausbeute erhöht
c²(NH3)
Kc = -------------------
(N2) · c³(H2)
Vergleiche mit der Knallgasreaktion:
- bei 10°C dauert es 108 Jahre bis zur Gleichgewichtseinstellung,
- bei 730 °C dauert es 10-5 Sekunden.
Fritz Haber (1868-1934) - NH3-Synthese:
Haber und Bosch haben das eigentliche Verfahren zur Produktion von Ammoniak dann letztlich erfunden, da sie passende Katalysatoren (einen Osmiumkatalysator) zufügten und alles als Kreisprozess aufbauten.
|
Ammoniak- |
Ammoniak- |
||||
|
Synthese |
Abscheidung |
||||
|
Rückführung von N2 und H2 |
|||||
Patentanmeldung 1909 mit einer Apparatur für 80 g/h
Erinnere Dich, was ein Katalysator ist: Katalysatoren erhöhen die Reaktionsgeschwindigkeit, indem sie die Aktivierungsenergie herabsetzen, wodurch sich das chemische Gleichgewicht schneller einstellt, es kommt jedoch zu keinerlei Gleichgewichtsverschiebung, Kc bleibt unverändert.
Insofern war das Einsetzten eines Katalysators auch eine gute Idee. Es beschleunigt die Einstellung des Gleichgewichts, Ammoniak wird also schneller produziert. Die Lage des Gleichgewichts bleibt unverändert.
BASF produziert ab 1913 Ammoniak:
- Ab 1913 lief die erste Großtechnische Produktion Ludwigshafen mit 30 t/Tag.
- Bereitstellung der Ausgangsstoffe (Das Synthesegas)
- Stickstoff aus der Luft (80%)
- Wasserstoff durch Steam-Reforming („Dampfspaltung“):
a) Primär-Reforming:
CH4 + H2O ---NiO2 / Al2O3----> CO + 3 H2
b) Sekundär-Reforming (Verwertung nicht umgesetzten Methans)
CH4 + O2 ----> 2 CO
c) Konvertierung des Kohlenstoffmonoxids
CO + H2O (g) ⇌ CO2 + H2
Hinweise:
- CO2 wird ausgewaschen (mit CaCO3-Lsg.)
- Katalysatorgifte: Reste von CO und CO2 lässt man mit H2 zu Methan und Wasser reagieren.
Aufgaben:
- Welches Volumen an N2 und H2 sind für die Produktion einer t NH3 nötig? (Bei Normalbedingungen)
- Wie wird heute aus Wasser Wasserstoff gewonnen?
- Wie wirkt sich ein Katalysator auf das chemische Gleichgewicht aus ?
Massenwirkungsgesetz bei Gasen
Für ideale Gase gilt folgender Zusammenhang:
Ideales Gas: p · V = n · R · T R= 8,314 J/mol K (R = ideale Gaskonstante)
c = n/V
p = R · T · n/V => p = konst. · c (in einem geschlossenen System !)
Reaktion: H2 + I2 ⇌ 2HI
p² (HI)
Kp = ----------------
p(H2) · p(I2)
allgemein: aA + bB --> cC + dD
pc(C) · pd(D)
Kp = ------------------
pa(A) · pb(B)
Zusammenfassung: Einflüsse auf das chemische Gleichgewicht
Nicht vergessen: Die Reaktionskoeffizienten gehen immer als Exponenten in das MWG ein!
1) Temperaturänderung und chemisches Gleichgewicht
Eine Temperaturerhöhung bewirkt eine Verschiebung des Gleichgewichts in Richtung der endothermen Reaktion (K)
Eine Temperaturerniedrigung verschiebt das Gleichgewicht in Richtung der exothermen Reaktion.
Die Gleichgewichtskonstante ändert sich durch Temperaturänderungen.
=> Kc ist temperaturabhängig
2. Stoffmengenänderung (Konzentrationsänderung) und chemisches Gleichgewicht
Für Gleichgewichte gilt: A + B <==> C + D
Entzieht man einen Reaktionspartner (z.B. C) aus einer Gleichgewichtsreaktion, kommt es zu einer Verschiebung des Gleichgewichts in Richtung der entsprechenden Seite (hier: „Nachbildung“ von C => Verschiebung in Richtung Produkte).
Fügt man einen Reaktionspartner hinzu (z.B. C), kommt es zur Verschiebung in die Richtung der entgegengesetzten Seite (hier: Umsetzung von C => Verschiebung in Richtung Edukte).
=> Die Erhöhung der Konzentration eines Reaktionsteilnehmers begünstigt die Reaktion, bei der dieser verbraucht wird. Eine Erniedrigung der Konzentration begünstigt die Reaktion, bei der eine Nachbildung erfolgt.
Der Wert von Kc ändert sich nicht.
=> Kc ist nicht konzentrationsabhängig!
Wenn die Konzentrationen der Edukte oder der Produkte verändert werden, verschiebt sich das Gleichgewicht, aber Kc bleibt gleich!
3. Druckänderung (Volumenänderung) und chemisches Gleichgewicht
Drucke spielen nur eine Rolle bei Reaktionen mit beteiligten Gasen!
Bei konstanter Temperatur bewirkt eine Druckerhöhung (Volumenverkleinerung) eine Verschiebung des chemischen Gleichgewichts in Richtung geringerer Teilchenzahl.
Eine Druckminderung (= Volumenvergrößerung) verschiebt das Gleichgewicht in Richtung der größeren Teilchenzahl.
Der Wert der Konstanten Kc ändert sich nicht.
=> Kc ist nicht druckabhängig!
Wenn die Partialdrücke der Edukte oder der Produkte verändert werden, verschiebtsich das Gleichgewicht, aber Kc bleibt gleich! Der Druck definiert (molares Volumen) die Anzahl der Teilchen pro Raumeinheit! Das heißt, je höher der Druck, desto größer die Konzentration!Druckänderungen wirken daher wie Konzentrationsänderungen.
Wiederholungsaufgaben zum Thema chemisches Gleichgewicht
- Erkläre das Eisenthiocyanatgleichgewicht.
- Definiere chemisches Gleichgewicht.
- Warum kann man sagen, dass chemische Gleichgewichtsreaktionen äußerlich zum Stillstand gekommen sind?
- Warum sind chemische Gleichgewichte dynamisch?
- Nenne das Prinzip von Le Chatellier.
- Nenne zu jeder der vier Arten von Gleichgewichtsreaktionen je ein Beispiel:
(Lösungsgleichgewicht, Gasgleichgewicht, Säure-Base-Gleichgewicht, Redox-Gleichgewicht). - Erkläre das Chromat/ Dichromatgleichgewicht genau.
- Erkläre das Stickoxidgleichgewicht genau.
- Das Iodwasserstoffgleichgewicht ist ein gutes Beispiel für Le Chatellier. Wende sein Prinzip auf dieses Gleichgewicht an und erkläre Auswirkungen, wenn man Druck bzw. Temperatur verändert.
- Was ist das MWG? Wie stellt man es auf und welche Aussage trifft K?
- Erkläre, warum Mineralwasser in einer Sprudelflasche nach einiger Zeit kein „Sprudel“ mehr enthält.
- Fasse zusammen: Wie kann man ein Gleichgewicht verschieben?
- Erkläre das Gasgleichgewicht in den Lungenbläschen, welches zwischen Luftsauerstoff und gelöstem Sauerstoff im Blut herrscht.
- Beschreibe die Ammoniaksynthese. Bei welchen Bedingungen findet sie statt? Warum gerade bei diesen Bedingungen?
- Beschreibe das Boudouard-Gleichgewicht.
- Welche Gleichgewichte spielen bei der Produktion von Schwefelsäure ein Rolle?
- Rechne alle Gleichgewichtsaufgaben im Buch
- Welche der folgenden Reaktionen reagiert (und in welcher Weise) auf eine Veränderung des Volumens?
C + CO2 ⇌ 2CO
CH4 + H2O ⇌ CO + 3H2
CO + NO2 ⇌ CO2 + NO
CaCO3 ⇌ CaO + CO2
2CH4 + O2 + 4N2 ⇌ 2CO + 4H2 + 4N2
2NO + O2 ⇌ 2NO2
CO + H2O ⇌ CO2 + H2 - a) Beschreibe die Reaktion von Wasserstoff mit Iod.
b) Es ist eine umkehrbare Reaktion. Nenne drei Möglichkeiten der Einstellung des Gleichgewichts.
c) Wie verändert sich die Konzentration mit der Zeit ? - Was ist das Massenwirkungsgesetz?
- Stelle das MWG für die Reaktion der Ammoniaksynthese aus den Elementen auf.
- Für eine Reaktion werden Wasser, Eisen(III)nitrat und Kaliumthiocyanat gemischt.
a) Welche Ionen enthalten die beiden Lösungen?
b) Welche Ionen spielen für die Reaktion nur eine Rolle.
c) Erstelle das MWG
d) Was geschieht bei einer Zugabe von Natriumthiocyanat? - Ein Gefäß mit V = 0,5 l enthält bei 700 K im Gleichgewicht:
0,0069 mol HI
0,0010 mol I2
0,0009 mol H2.
Berechne Kc.
- Freies Lehrbuch "Anorganische Chemie": 23 Löslichkeit von Salzen & das Löslichkeitsprodukt
- Freies Lehrbuch "Anorganische Chemie": 24 Säure-Base-Gleichgewichte
- Freies Lehrbuch "Anorganische Chemie": 25 Elektrochemie II - Transportable Energie: Batterien, Akkus und Knopfzellen
- Freies Lehrbuch "Anorganische Chemie": 27 Analytik und Ionennachweise
