Kapitel 24: Säure-Base-Gleichgewichte

Der Säure- Base-Begriff im historischen Wandel
Entdeckt wurden Säuren als „Stoffe, die Pflanzenfarbstoffe (wie z.B. Tee oder Rotkohl) in ihrer Farbe verändern“ - Robert Boyle (1627 - 1691). Der Chemiker Antoine Laurent de Lavoisier (1743 – 1794) vermutete im 18. Jahrhundert, dass Säuren Stoffe sind, welche Sauerstoff abgeben. Daher rührt vermutlich auch der deutsche Name „Säure“.
Der Darmstädter Justus von Liebig (1803-1873) stellte aber bald klar, dass alle Säuren Wasserstoffverbindungen sind. Aber auch diese Annahme ist nicht 100%ig richtig, wie der folgende Versuch schnell zeigt:
V1: Benzin + Blaukrautsaftindikator (bzw. Lackmus oder Universalindikator)
B1: Keine Farbänderung - trotz Wasserstoff
S1: Benzin ist keine Säure, obwohl es viel Wasserstoff enthält!
Erst der Schwede Svante Arrhenius (1859-1927) sorgte für endgültige Klarheit:
Nur Wasserstoff-Verbindungen deren Moleküle Wasserstoffionen abgeben, sind Säuren. Laugen hingegen sind wässrige Hydroxidlösungen (also (OH)–).
V2: Von Wasser sowie Wasser mit etwas zugegebener Säure wird die Leitfähigkeit gemessen.
B2: Säuren leiten in Verbindung mit Wasser den elektrischen Strom
S2: In Säuren liegen frei bewegliche Ionen vor.
Der Däne Johannes Nicolaus Brønsted (1879 -1947) (ausgesprochen „Brönsted“) ging in seinen Definitionen noch einen Schritt weiter.
Teilchen, die bei Reaktionen Protonen (also H+) abgeben, nennt man Säuren (=Protonendonatoren).
In Wasser bilden Säuren immer das Oxoniumion (H3O)+.
=> Eine Säure muss mindestens 1 Wasserstoffatom besitzen, das als Proton abspaltbar ist.
Bsp.: HCl, H2SO4, H2CO3
Teilchen, die bei Reaktionen Protonen aufnehmen, bezeichnet man als Basen (=Protonenakzeptoren).
=> Eine Base muss mindestens 1 freies e–-Paar besitzen, um ein Proton kovalent binden zu können.
Bsp.: OH-, NH3, CO32-
Diese Definition ist die heute noch gebräuchlichste. Allerdings wurde auch sie noch erweitert.
Eine weitere übliche Definition ist das Säure-Base-Konzept des Amerikaners Gilbert Newton Lewis (1875-1946). Er forschte sein ganzes Leben an Valenzelektronen und chemischen Bindungen. So werden Valenzstrichformeln auch „Lewis Formeln“ genannt. Er versuchte auch das Konzept der Atombindungen auf Säuren und Basen zu übertragen:
Eine Lewis-Säure ist ein Elektronenpaarakzeptor (lagert also Elektronenpaare an).
Eine Lewis-Base ist ein Elektronenpaardonator (stellt also Elektronenpaare zur Verfügung).
Mit diesem Konzept können auch saure Eigenschaften von beispielsweise Metallchloriden (wie dem FeCl3) erklärt werden, welche aber keine Protonendonatoren im Sinne Brønsteds sind.
Zu den Lewis-Säuren zählen beispielsweise:
- Moleküle ohne Edelgaskonfiguration wie: B(CH3)3, BF3, AlCl3
- Atome ohne Edelgaskonfiguration wie z.B. Co3+
- Metallionen, die als Zentralatome in chemischen Komplexen auftreten.
- Moleküle mit polarisierten Doppelbindungen, z. B. CO2, SO3
Das Lewis-Konzept findet in der Schule aufgrund seiner Komplexität allerdings kaum Beachtung.
Aufgaben:
1. Ist Natronlauge eine Base?
2. Was versteht man unter einer Lauge?
3. Wo kommen denn die Protonen her die eine Base aufnimmt?
Zusatzinformationen:
- http://de.wikipedia.org/wiki/Antoine_Laurent_de_Lavoisier
- http://de.wikipedia.org/wiki/Justus_von_Liebig
- http://de.wikipedia.org/wiki/Gilbert_Newton_Lewis
- http://de.wikipedia.org/wiki/Brönsted
- http://de.wikipedia.org/wiki/Svante_Arrhenius
- http://de.wikipedia.org/wiki/Lewis-Säure
- http://de.wikipedia.org/wiki/Säure-Base-Konzepte
- http://de.wikipedia.org/wiki/Säuren
- http://de.wikipedia.org/wiki/Alkalische_Lösung
Weitere Säure-Base-Konzepte: https://de.wikipedia.org/wiki/Säure-Base-Konzepte
Säuren und Basen
Die erste Säure, die man schon im Altertum kannte, war Essig. Im Mittelalter kannte man schon weitere Säuren (z.B. Salzsäure, Salpetersäure und Schwefelsäure). Säuren waren schon damals dafür bekannt, dass sie sogar Metalle auflösen konnten.
Die Gegenspieler sind die Basen. Mit den Basen konnten die Säuren neutralisiert werden. Diese können aus den Oxiden von Metallen durch Gabe von Wasser gewonnen werden. Natriumhydroxid und Kaliumhydroxid sind bekannte Vertreter.
|
Die wichtigsten Säuren und ihre Säurereste |
|
Säure: |
Säurerest: |
||
|
HF |
Fluorwasserstoffsäure |
F- |
Fluorid |
|
HCl |
Chlorwasserstoffsäure |
Cl- |
Chlorid |
|
HBr |
Bromwasserstoffsäure |
Br- |
Bromid |
|
HI |
Iodwasserstoffsäure |
I- |
Iodid |
|
H2S |
Schwefelwasserstoff(säure) |
S2- |
Sulfid |
|
H2O |
Wasser (Sonderfall!) |
O2- |
Oxid |
|
HCN |
Blausäure |
CN- |
Cyanid |
|
HNO3 |
Salpetersäure |
(NO3)- |
Nitrat |
|
H2SO4 |
Schwefelsäure |
(SO4)2- |
Sulfat |
|
H2CO3 |
Kohlensäure |
(CO3)2- |
Carbonat |
|
H3PO4 |
Phosphorsäure |
(PO4)3- |
Phosphat |
|
HNO2 |
Salpetrigesäure |
(NO2)- |
Nitrit |
|
H2SO3 |
Schwefeligesäure |
(SO3)2- |
Sulfit |
|
H3PO3 |
Phosphorigesäure |
(PO3)3- |
Phosphit |
|
Die wichtigsten Laugen |
|
Lauge: |
|
|
NaOH |
Natronlauge |
|
KOH |
Kalilauge |
|
Ca(OH)2 |
Calciumlauge (=Kalkwasser) |
|
Ba(OH)2 |
Bariumlauge (=Barytwasser) |
c) Weitere anorganische Säuren
Kieselsäure: H2SiO3 ⇌ H+ + (HSiO3)– ⇌ 2H+ + (SiO3)2–
Hydrogensilikat Silikat
Arsensäure: H3AsO4 ⇌ 3H+ + (AsO4)3–
Arsenat
Hypochlorige Säure (=Chlor(I)-säure): HClO ⇌ H+ + (ClO)–
Hypochlorit
Chlorige Säure (=Chlor(III)-säure): HClO2 ⇌ H+ + (ClO2)–
Chlorit
Chlorsäure (=Chlor(V)-säure): HClO3 ⇌ H+ + (ClO3)–
Chlorat
Perchlorsäure (=Chlor(VII)-säure): HClO4 ⇌ H+ + (ClO4)–
Perchlorat
d) Organische Säuren
Essigsäure: H3C-COOH Säurerest: Acetat
Zitronensäure: Säurerest: Citrat

Ameisensäure: HCOOH Säurerest: Formiat
Oxalsäure: HOOC-COOH Säurerest: Oxalat
Äpfelsäure: Säurerest: Malat
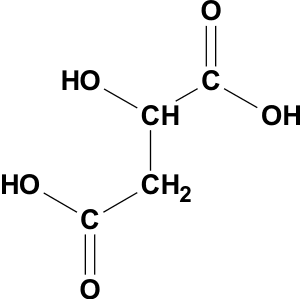
Ascorbinsäure (=Vit C): Säurerest: Ascorbat

Bernsteinsäure: HOOC-CH2-CH2-COOH Säurerest: Succinat
Acetylsalicylsäure Säurerest: Acetyl-Salicylat

Aufgaben:
1. Sind folgende Verbindungen Säuren oder Basen?
- H3PO4
- F–
- HN3
- Cl–
- OH–
- CH3CO2H
- NO3–
- H3O+
- HF
- OCl–
Quelle Grafiken: (alle public domain)
Zitronensäure: Wikipediauser Neurotiker, http://de.wikipedia.org/wiki/Bild:Zitronens%C3%A4ure_-_Citric_acid.svg
Äpfelsäure: Wikipediauser Jkrieger, http://de.wikipedia.org/wiki/Bild:Apfelsaeure.png
Ascorbinsäur: Wikipediauser Dschanz, http://de.wikipedia.org/wiki/Bild:Ascorbinsaeure.png
Acetylsalicilsäure: Wikipediauser Booyabazooka, http://de.wikipedia.org/wiki/Bild:Aspirin-skeletal.svg
Einstiegsversuche
V1: Messe die pH-Werte und bestimme den Säuregrad einiger Säuren mithilfe von pH-Papier.
V2: Reaktion von Magnesium und Säure: Gib einen Streifen Magnesium in Salzsäure und beobachte. Versuche das Gas mit einem Kolbenprober aufzufangen und führe eine Knallgasprobe durch.
V3: Bestimme die Leitfähigkeit von konzentrierter Essigsäure (Eisessig). Dann gib etwas Wasser hinzu und messe erneut.
V4: Bestimme die Leitfähigkeit von NaOH-Lösung und von Kalkwasser.
V5: Messe die Leitfähigkeit von Leitungswasser und von dest. Wasser.
Schlussfolgerungen:
Versuche alle Beobachtungen mit Deinem Wissen aus den vergangenen Jahren zu schlussfolgern.
Labortipp für die Praxis für konzentrierte Säuren:
- [H2SO4] = 18mol/l
- [HCl] = 12 mol/l
Was ist eine Säure - Base Reaktion?
a) Protolyse
Du hast bereits gelernt, dass der Übergang eines Protons1 (H+) von einem Partner auf einen anderen Protolyse genannt wird. Man spricht auch von einer klassischen Säure-Base Reaktion.
Als Protolyse bezeichnet man den Übergang eines Protons (von einem Molekül auf ein anderes)
Die soll am Beispiel der Salzsäurebildung aus dem Gas HCl und H2O nachvollzogen werden. Beide Stoffe sind Dipole. Das HCl-Wasserstoffatom wird aufgrund der Dipol-Dipol-Wechselwirkungen leicht vom Elektronenpaar des H2O - Sauerstoffatom angezogen. Es kann den Bindungspartner wechseln.
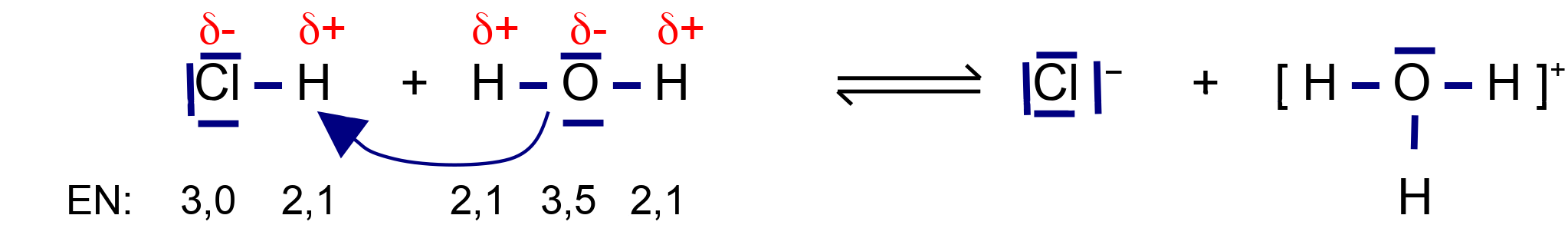
Der Sauerstoff des Wassers ist partial negativ geladen. Er übt so eine Anziehungskraft auf das Wasserstoffatom des HCl aus. Man könnte vereinfacht sagen, das Sauerstoffatom des Wassers „flirtet“ mit dem H (der HCl), welches in „Versuchung“ geführt wird und seinen Partner „verlässt“.
Die Konsequenz ist, dass HCl heterolytisch getrennt wird. Dabei wird dem elektronegativeren Atom das Elektronenpaar „zugeteilt“. Es entstehen H+ und Cl–.
Auch das kann man sich vereinfacht vorstellen: bei der Trennung von H und Cl bleibt das gemeinsame Eigentum (also die Elektronen) bei dem Verlassenen. Das Proton (H+) verbindet sich sogleich mit dem freien Elektronenpaar und bildet ein Oxoniumion (H3O+).
HCl ist also erst in Verbindung mit Wasser eine Säure. Säure ist demnach nicht eine Stoffeigenschaft, sondern erst das Ergebnis einer Reaktion, bei der Oxoniumionen2 entstehen.
Was jetzt für Dich vielleicht neu ist:
Es handelt sich bei allen Säure-Base-Reaktionen um Gleichgewichtsreaktionen! Es ist tatsächlich so,
dass immer auch ein Teil der Produkte wieder zu den anfänglichen Edukten reagiert!
b) Mehrstufige Protolysen
Säuren, welche mehrere Protonen enthalten wie z.B. Schwefelsäure oder Phosphorsäure geben diese Protonen nacheinander ab:
H2SO4 + 2H2O ⇌ (HSO4)– + H3O+ + H2O ⇌ (SO4)2– + 2H3O+
Schwefelsäure Hydrogensulfat Sulfat
Mit Phosphorsäure sind sogar drei Protolysestufen möglich:
H3PO4 + 3H2O ⇌ (H2PO4)– + H3O+ + 2H2O ⇌ (HPO4)2– + 2H3O+ + H2O ⇌ (PO4)3–+ 3H3O+
Dihydrogenphosphat Hydrogenphosphat Phosphat
1 Da H+ keine Elektronen hat und nur ein Proton (und kein Neutron), wird es unter Chemiker auch als Proton bezeichnet!
2 Oxonium wurde früher auch Hydroniumion genannt. Der Ausdruck Hydroxonium ist ebenso veraltet!
c) Neutralisation
Ein Sonderfall der Protolyse ist die Neutralisation. Hierbei werden auch Protonen ausgetauscht, aber die eines der Produkte ist Wasser, das zweite ein Salz.
Vereinfachte Neutralisation: OH– + H3O+ ⇌ 2H2O + E
Neutralisation von Natronlauge mit Salzsäure:
NaOH + HCl ⇌ NaCl + H2O + E
Säuren und Basen sind „Gegenspieler“. Bei gleicher Konzentrationen, heben sich gegenseitig in ihrer ätzenden Wirkung auf, d.h. sie sind neutralisiert.
Erinnerung: Alle Salze bestehen aus einem Metallion und einem Säurerest.
Zweistufige Neutralisation am Beispiel der Reaktion von Natronlauge mit Schwefelsäure:
1. Stufe: NaOH + H2SO4 ⇌ NaHSO4 + H2O + E
2. Stufe: NaOH + NaHSO4 ⇌ Na2SO4 + H2O + E
Salz + Wasser
Gesamtgleichung: NaOH + H2SO4 ⇌ Na2SO4 + 2 H2O + E
Zusatzinformationen:
http://de.wikipedia.org/wiki/Neutralisation_%28Chemie%29
d) Die Autoprotolyse des Wassers
Wasser reagiert mit sich selbst in sehr geringem Maße zu Hydroxid- und Oxoniumionen.
H2O + H2O ⇌ H3O+ + OH–
Allerdings ist in neutralem Wasser die Konzentration der Oxoniumionen nur 0,000 0001mol/l [10-7 mol/l]. Dies erklärt auch die (wenn auch geringe) Leitfähigkeit von destilliertem Wasser.
Auch reines Wasser leitet den Strom, welches ein Beweis für die Autoprotolyse des Wassers ist. Dabei entstehen sehr geringe Konzentrationen an Oxoniumionen (H3O+) und Hydroxidionen (OH-).
e) Bildung von Säuren und Laugen aus den Oxiden
Erinnere Dich an die Mittelstufe. Ein Metalloxid mit Wasser eine Lauge:
z.B.: Na2O + H2O ---> 2NaOH
oder: CaO + H2O ---> Ca(OH)2
Ein Nichtmetalloxid reagiert hingegen mit Wasser zu einer Säure!
z.B.: SO3 + H2O ---> H2SO4
Säure-Base-Reaktionen im Detail - das korrespondierende Säure-Base-Paar
Schaut man sich die Reaktion von Natronlauge mit Salzsäure genauer an und ordnet nun den Stoffen die Begriffe Säure und Base zu, so erlebt man eine Überraschung:
(OH)– + HCl ⇌ Cl– + H2O + E
Base Säure ⇌ Base Säure
H-Säurerestanion + Base ⇌ Anion + H-Base
Säure 1 + Base2 ⇌ Base 1 + Säure 2
Andere Schreibweise: Allgemeine Säurereaktion: HA + B ⇌ A– + BH+
Allgemeine Basenreaktion mit Wasser: A– + H2O ⇌ OH– + HA
Bei Säure-Base-Reaktionen wird immer ein Proton übertragen. Es liegt also immer eine Protolyse vor. Des Weiteren sieht man, dass die Base dabei zu einer Säure reagiert und die Säure zu einer Base. Man spricht also immer von einem korrespondierendem Säure-Base-Paar.
Als Faustregel kann man sich dabei merken:
Aus Säuren entstehen bei Protonenabgabe Basen,
aus Basen entstehen bei Protonenaufnahme Säuren.
Starke Säuren reagieren dabei zu schwachen Basen, starke Basen reagieren zu schwachen Säuren.
Aufgaben:
1. Stelle die Protolysegleichungen mit vollständigen Strukturformeln der folgenden Reaktionen auf:
a) Fluorwasserstoff (=Flusssäure) + Chlorwasserstoff
b) Wasser + Ammoniak
c) Salzsäure + Ammoniak
2. Vervollständige die korrespondierenden Säure-Base-Paare:
|
Säure |
H3PO4 |
HSO4– |
H2O |
NH3 |
||||||
|
Base |
HCO3– |
S2– |
(CO3)2– |
H2O |
Cl– |
HPO42– |
Ampholyte: Ist Ammoniak eine Base oder eine Säure?
Vergleiche mal die drei folgenden Reaktionen und ordne den Stoffen jeweils zu, ob sie Säure oder Base sind:
HCl + H2O ⇌ H3O+ + Cl–
NH3 + H2O ⇌ NH4+ + OH–
Cl– + NH3 ⇌ NH2– + HCl
Ist Wasser eine Säure oder Base? Und ist Ammoniak nun eine Säure oder eine Base?
Wie man sieht und durch Messungen des pH-Werts auch untersuchen kann, reagiert Wasser im ersten und dritten Beispiel als Base und im zweiten als Säure!
Man kann also nicht generell sagen, ob ein Stoff sauer oder alkalisch IST, man kann nur sagen, dass eine Reaktion mit einem bestimmten Partner sauer oder alkalisch verläuft (bzw. dass der Stoff sauer / alkalisch reagiert hat).
Der saure oder basische Charakter einer Substanz hängt vom Reaktionspartner ab.
Er ist keine Stoffeigenschaft!
Stoffe, die sowohl als Säure, als auch als Base reagieren können, nennt man Ampholyte. Ampholyte zeichnen sich dadurch aus, das sie (je nach Partner) Protonen aufnehmen und abgeben können.
Bekannte Ampholyte: H2O, NH3, HS-, HSO4–, H2PO4–, HPO42–, HCO3–
Darstellung von Chlorwasserstoff (HCl)
Material: Gasentwicklungsapparatur, Thermometer, Leitfähigkeitsmessung
V1: Konzentrierte H2SO4 wird aus einem Tropftrichter auf feuchtes NaCl getropft (Reakton1).
V2: Das entstehende Produkt wird über einen Schlauch über eine Glaswanne (gefüllt mit Wasser) geleitet. Die Stromstärke und der pH-Wert werden gemessen (Reakton2).
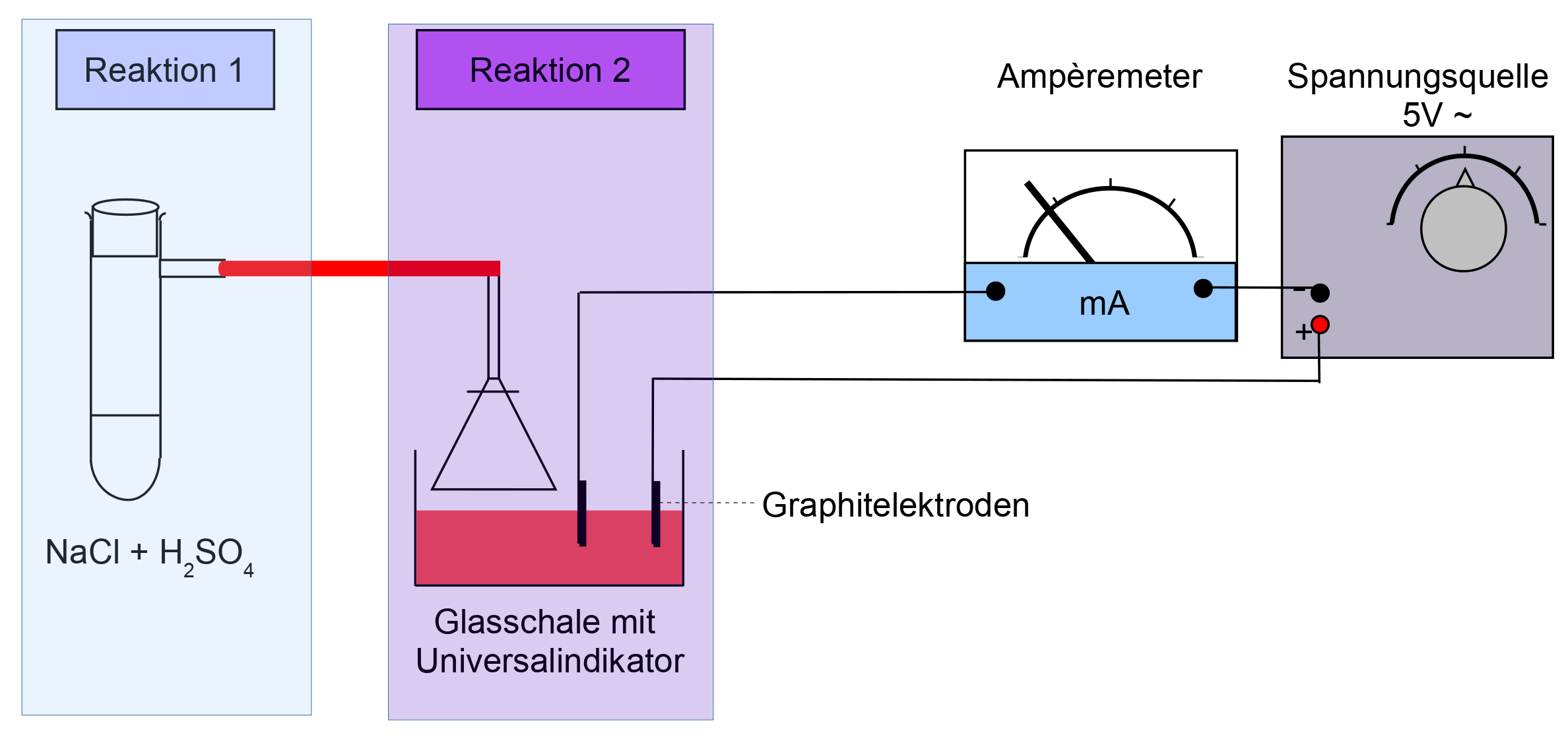
|
B1 |
S1 |
|
Es bildet sich ein Gas |
HCl ist ein Gas! Säuren können in allen Aggregatzuständen vorkommen. |
|
Das Gefäß wird heiß |
Bei der Bildung von HCl wird viel Energie frei. |
=> H2SO4 + NaCl ⇌ HCl + Na2SO4 + E
Aus der starken Schwefelsäure wird Chlorwasserstoff gebildet. Dazu gibt es eine Faustregel, welche besagt, dass bei einer solchen Konkurrenzreaktion um das Proton die schwächere Säure gewinnt, da die stärkere das Proton abgibt und als Säure reagiert:
Die stärkere Säure treibt die schwächere Säure aus ihrem Salz (hin zur Säure).
|
B2 |
S2 |
|
Das Gas löst sich im Wasser |
HCl löst sich ausgesprochen gut in Wasser1. Es findet eine Reaktion statt. |
|
Universalindikator färbt sich rot |
=> es hat sich eine Säure gebildet. |
|
Die Temperatur steigt |
=> es liegt eine exotherme Reaktion vor. |
|
Die Leitfähigkeit steigt |
=> es bilden sich Ionen - Ursache muss eine heterolytische (=ungleiche) Spaltung des HCl in Ionen sein. |
Wie kann man feststellen, welche Ionen in der Glasschale enthalten sind?
Man gibt Silbernitratlösung zu und provoziert eine Fällungsreaktion. Die Zugabe von AgNO3 zeigt eine weiße Trübung.
=> Es sind Chloridionen enthalten, es bildet sich das schwerlösliche Salz Silberchlorid.
=> HCl + H2O ⇌ Cl– + H3O+
Beachte:
- Sauerstofffreie Säuren herzustellen ist etwas aufwändiger als sauerstoffhaltige Säuren herzustellen. Sauerstoffhaltige Säuren entstehen in der Regel leicht durch die Reaktion von Nichtmetalloxiden (also verbrannten Nichtmetallen) und Wasser.
- Für Salzsäure (HCl) ist es hingegen so, dass das Gas HCl mit Wasser reagieren muss. Dazu leitet man das entstehende Gas über Wasser.
HCl „löst“ sich sehr gut in Wasser, da es schnell zu Oxoniumionen und Chlorid reagiert:
Herstellung gasförmiges HCl: H2SO4 + 2 NaCl ⇌ 2 HCl + Na2SO4 - HCl wird, solange es nicht mit Wasser reagiert immer Chlorwasserstoff genannt. Der alte Ausdruck „Wasserstoffchlorid“ ist komplett falsch, da keine Chloridionen (Cl‒) vorliegen. Stattdessen liegt eine Atombindung zwischen den beiden Atomen vor: H‒Cl
- Im zweiten Teil entsteht dann die eigentliche Salzsäure:
HCl + H2O ⇌ Cl‒ + H3O+ - Die Produkte dieser Reaktion, also Chloridionen und Oxoniumionen werden zusammen Salzsäure genannt.
- Da diese Reaktion eine Gleichgewichtsreaktion ist, kann das Gleichgewicht nicht weiter als zu 37% Produkte verschoben werden. Es gibt also keine stärker konzentrierte Salzsäure als 37% Salzsäure. (Die Sauerstoffsäuren „Schwefelsäure“ und „Salpetersäure“ können hingegen 100%ig vorkommen).
Der Springbrunnenversuch
V: Ein Rundkolben wird mit gasförmigem HCl gefüllt und dann mit einem durchbohrtem Stopfen verschlossen. Im Stopfen steckt ein kleines, sich nach oben verjüngendes Glasrohr. Der Rundkolben wird mit der Öffnung nach unten in ein Wasserbad gestoßen (so das etwas Wasser hineinläuft).
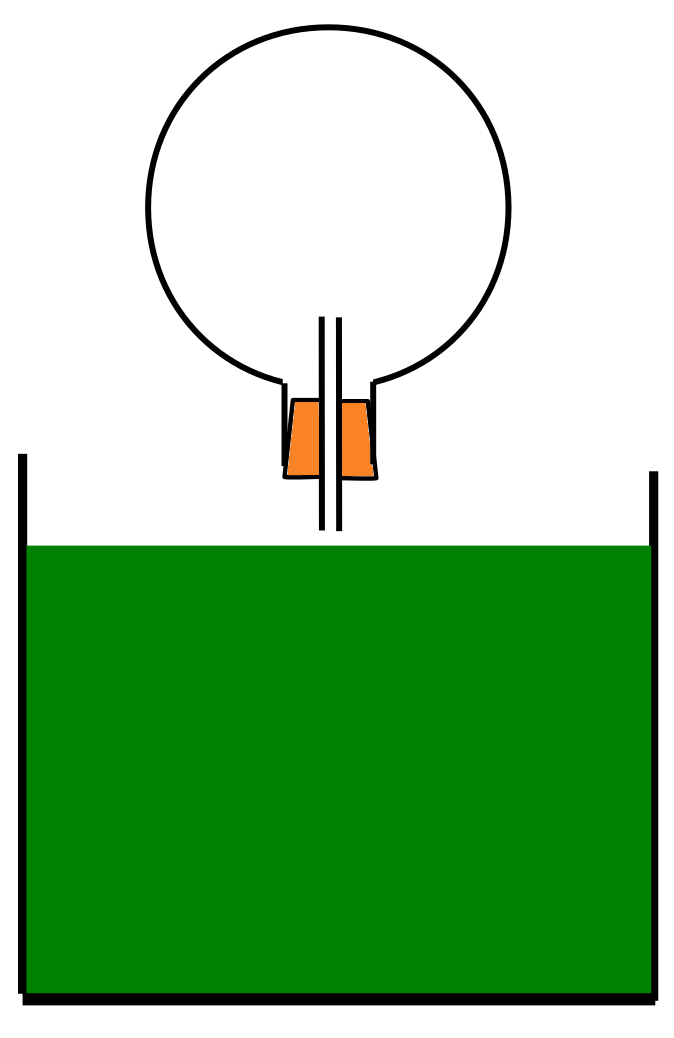
B: Das Wasser wird in das Gefäß hineingesaugt.
S: Chlorwasserstoff ist ein sehr gut in Wasser lösliches Gas. Im Gefäß regiert das erste eintretende Wasser sofort mit dem Gas HCl und löst sich im Wasser. Dadurch entsteht ein Unterdruck, welcher weiteres Wasser hineinsaugt. 507 Liter HCl lösen pro Liter Wasser bei 0°C!
Der gleiche Versuch gelingt auch mit gasförmigem Ammoniak.
Das Gas HCl ist stark wasserlöslich!
Das Ionenprodukt des Wassers
Aus der Autoprotolyse des Wassers folgt: 2H2O ⇌ H3O+ + OH–
Stellt man nun das MWG auf und berücksichtigt, dass sich die Konzentration des Wassers kaum ändert (und sie folglich gleich 1 setzt), ergibt sich:
[H3O+] · [OH–]
k = ————————————
[H2O]2
Die Konzentration von Wasser in die Konstante KW einbezogen: KWasser = [H3O+] · [OH–]
Das Ionenprodukt des Wassers ist das in wässrigen Lösungen konstante Produkt aus der Oxoniumionenkonzentrationen und der Hydroxidionenkonzentration. KW ist (wie üblich bei Gleichgewichten) von der Temperatur abhängig.
Bei 25°C hat es den Wert Kw = 10-14 mol2/l2.
Bei Standardbedingungen gilt also:
KWasser = [H3O+] · [OH–] = 10-14 mol2/l2
Wie hoch ist die Konzentration von H3O+-Ionen in reinem Wasser?
[H3O+] = [OH–] = √KW = (10-7 mol/l)
Aufgabe: Wie groß ist die Masse an H3O+ (bzw. OH–) in 1l Wasser?
n = m/M
<=> n · M = m
<=> m(H3O+) = 19,0 · 10-7g
<=> m(OH–) = 17,0 · 10-7g)
Das entspricht 19g H3O+ (17g OH–) in 10.000t Wasser!
Frage: Was passiert bei Zugabe von Salzsäure zu „neutralem“ Wasser?
=> [H3O+] steigt an.
=> [OH–] muss sinken, da KW eine Konstante ist.
Aus dem Ionenprodukt kann man nun leicht den pH-Wert ableiten:
|
saure Lösungen |
c(H3O+) > 10-7 mol/l |
pH < 7 |
|
neutrale Lösungen |
c(H3O+) = 10-7 mol/l |
pH = 7 |
|
alkalische Lösungen |
c(H3O+) < 10-7 mol/l |
pH > 7 |
Wie verhält sich jeweils die Konzentration an OH–-Ionen?
pH + pOH = 14
=> pOH = 14- pH
Definition des pH-Werts
Der pH-Wert dient vor allem dazu, in einer einfachen Weise die Konzentration an Oxoniumionen anzugeben. Definiert ist der pH-Wert mathematisch:
Der pH-Wert gibt die Konzentration von Oxoniumionen an.
Er ist definiert als negativer dekadischer Logarithmus der Konzentration an Oxoniumione.
=> pH = - lg [H3O+]
Konsequenzen:
- Das Besondere an der pH-Wert Skala ist, dass der Unterschied zwischen einem pH-Wert und dem nächsten das 10-fache beträgt:
- Das bedeutet, dass z. B. eine Säure mit pH = 2 zehnmal so sauer wie eine Säure mit pH = 3 ist und hundertfach so sauer wie eine Säure mit pH = 4 ist.
- Vom pH-Wert kann man nun auch logischerweise die Konzentration an [H3O+] berechnen: [H3O+] = 10-pH mol/l
- pH + pOH = 14 (Bei Standardbedingungen, also 25°C)
Hier einige Beispiele von pH-Werten bei Alltagsstoffen:
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
HCl |
Magensäure,
Kalkreiniger
Batterie- säure
|
Zitronensaft |
Essig
Zitronenlimonade
Apfelsaft |
Cola
Sauerkraut |
Haut
Shampoo
O-Saft
Kaffee
saurer Regen |
saure Milch
Speichel |
Leitungs-wasser |
Darmmilllieu
Nordsee- Wasser
Backpulverlösung |
Seife |
nasser Zement |
Waschmittellösung
Ammoniak |
Kernseife |
Abfluss-frei
|
sehr sauer schwach sauer neutral schwach alkalisch sehr alkalisch
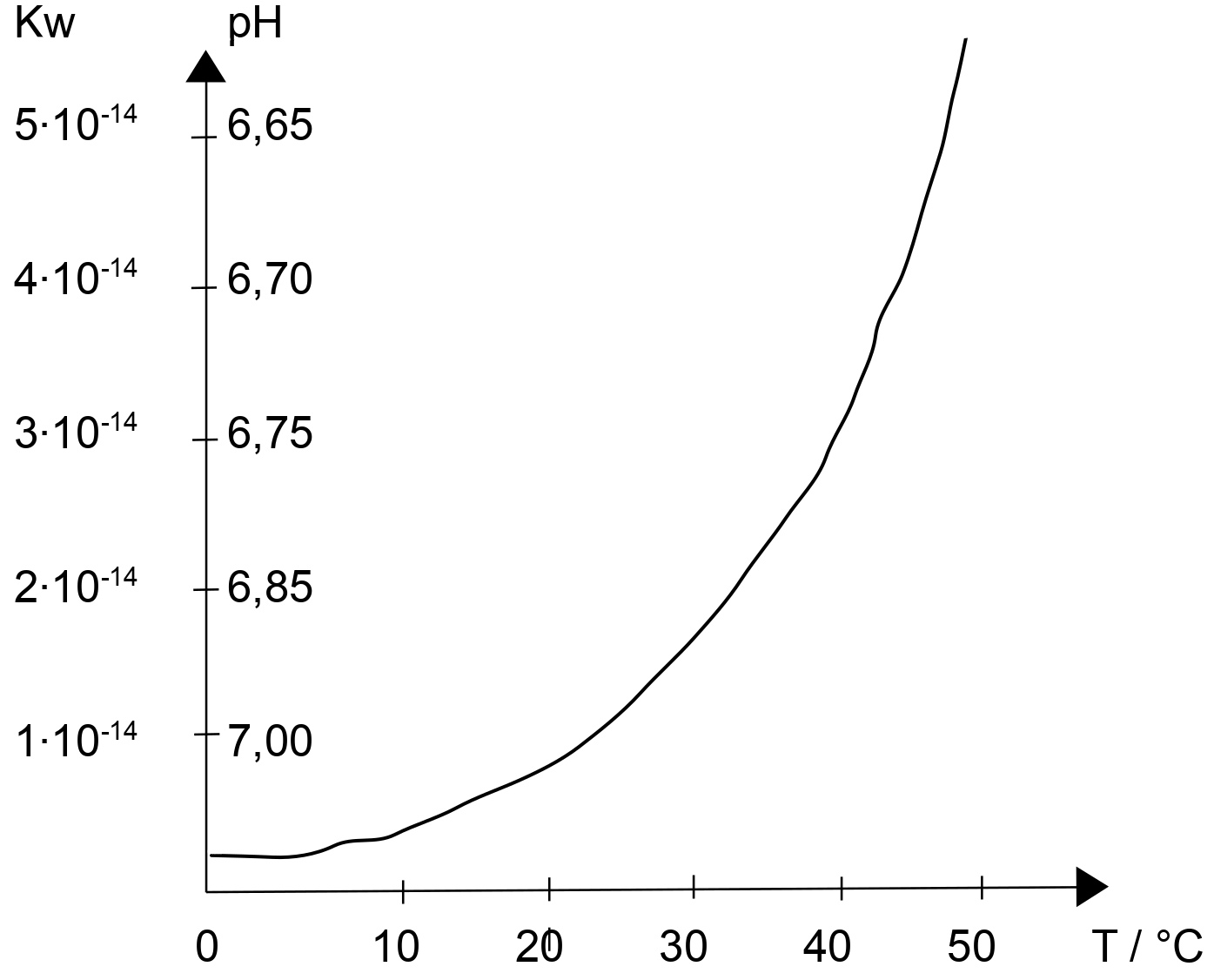
Temperaturabhängigkeit des Ionenproduktes von Wasser
Übung - pH-Wert Bestimmung
V: Bestimmung verschiedener pH-Werte:
|
Substanz |
Gruppe 1 |
Gruppe 2 |
Gruppe 3 |
Gruppe 4 |
Gruppe 5 |
Gruppe 6 |
Mittelwert |
|
NaCO3-Lsg. |
|||||||
|
Zitronensaft |
|||||||
|
Wein |
|||||||
|
Schmelzwasser |
|||||||
|
Milch |
|||||||
|
Essig |
|||||||
|
Waschmittel |
|||||||
|
Backpulver |
|||||||
|
Kaffee |
|||||||
|
KOH (30 %) |
Protolysereaktionen von Salzen: Auch Salze reagieren als Säure oder Base
Test verschiedener Salze auf ihren pH-Wert bzw. Indikator + Salz:
Na2CO3 + H2O [Reaktionsgleichung: (CO32- + H2O ⇌ HCO3- + OH-)]
NH4+ + H2O ⇌ NH3 + H3O+
Aufgaben:
- Eine wässrige Lösung von Natriumhydrogensulfat (NaHSO4) reagiert sauer, eine Lösung von Natriumhydrogencarbonat (NaHCO3) dagegen alkalisch.
Formuliere die Protolysegleichungen und benenne jeweils Säure und Base! (Überlege zuerst, welche Ionen eine saure bzw. alkalische Lösung anzeigen, und dann, wie diese Ionen entstehen könnten!) - Natriumphosphat (Na3PO4) zeigt in wässriger Lösung eine alkalische Reaktion. Erkläre unter Mitverwendung einer Gleichung diese Reaktion!
- Wieviel mal höher ist die Konzentration an Protonen?
a) pH 6 zu pH 7
b) pH 7 zu pH 10
Erlaubt der Protolysegrad eine Aussage zur Säurestärke?
a) Warum ist der pH-Wert für Aussagen zur Säurestärke ungeeignet?
In manchen Büchern wird der pH-Wert mit der Säurestärke gleichgesetzt. Dies ist jedoch nicht richtig! Der pH-Wert gibt die aktuelle Konzentration an [H3O+] an. Damit ist nichts darüber ausgesagt, ob eine Säure generell stark ist.
Zum Vergleich: eine verdünnte Schwefelsäure kann schwächer wirken als die schwache (aber konzentrierte) Zitronensäure.
Eine starke Säure ist immer eine starke Säure, egal wie gerade der aktuelle pH - Wert ist. (Ein Sportwagen ist auch immer ein Sportwagen, auch wenn er mit 30 durch ein Wohngebiet fährt!)
Um dem ganzen Phänomen der Säurestärke etwas näher zu kommen, betrachten wir die Reaktion von Magnesiumband in einer starken und einer schwachen Säure:
V: Mg-Band wird mit konzentrierter HCl bzw. mit Essigsäure versetzt.
B: Mit konzentrierter Salzsäure ist die Reaktion viel heftiger. In beiden Fällen entsteht ein brennbares Gas.
S: => HCl ist eine stärkere Säure, Essigsäure ist eine schwache Säure. Die Konzentration an Oxoniumionen in Salzsäure ist höher als in der Essigsäure.
=> Salzsäure ist stärker protolysiert.
Magnesium + Salzsäure ⇌ Magnesiumchlorid + Wasserstoff
Magnesium + Essigsäure ⇌ Magnesiumacetat + Wasserstoff
V2: Die Säure HCl wird mit viel Wasser verdünnt und in Mg eingeworfen. Der Versuch wird mit Essigsäure wiederholt
B2: Beide Reaktionen laufen ähnlich langsam ab
S2: Man kann Säuren in ihrer Wirkung abschwächen. Man kann also starke Säuren mit Wasser verdünnen, ihre Wirkung ist dann weniger stark. Dennoch bleiben sie starke Säuren.
Nicht alle Säuren sind gleich stark oder gleich ätzend. Man unterscheidet grob gesagt zwischen starken und schwachen Säuren.
Einer Säure kann man nicht anhand ihres pKS-Werts ansehen, wie stark sie bei einer bestimmten Verdünnung protolysiert.
Der Protolysegrad gibt genau darüber Auskunft. Er ist von der Verdünnung abhängig. Er steigt mit zunehmender Verdünnung an.
[H3O+]
Protolysegrad α = —————
[HA]0
[HA]0 = Ausgangskonzentration der Säure
Was passiert bei Zugabe von Wasser zu Säure?
Die Zugabe von Wasser stellt einen Zwang auf das Gleichgewicht dar. Das Gleichgewicht wird dadurch auf die Seite der Produkte verschoben!
Salzsäure in Wasser: HCl + H2O ⇌ H3O+ + Cl–
=> pH-Wert und Protolysegrad sind für Aussagen über die Säurestärke ungeeignet, da sie keine feststehenden Stoffeigenschaften und von der Verdünnung abhängig sind.
Die Säurestärke
| starke Säuren | schwache Säuren | |||
| Salzsäure | HCl | Kohlensäure | H2CO3 | |
| Salpetersäure | HNO3 | Zitronensäure | ||
| Flusssäure | HF | Essigsäure | HAc / H3C-COOH | |
| Schwefelsäure | H2SO4 | Ameisensäure | ||
| Phosphorsäure | H3PO4 | Äpfelsäure, Milchsäure usw... |
b) Säure- und Basenkonstanten
Um also eine feststehende Aussage zu treffen bedarf es eines Bezugssystems. Dieses stellt wiedereinmal das Massenwirkungsgesetz dar. Als Reaktion dient immer die Protolyse mit Wasser (Da Wasser ein universeller Stoff ist und gleichzeitig ein Ampholyt)!
Salzsäuredissoziation in Wasser: HCl + H2O ⇌ H3O+ + Cl–
Allgemeine Gleichung der Säuredissoziation: HA + H2O ⇌ H3O+ + A–
(A = (Säurerest)-Anion)
Massenwirkungsgesetz: Einbeziehung des Wassers in die Konstante:
[H3O+] · [A–] [H3O+] · [A–]
=> k = ————————— => KS = k · [H2O] = —————————
[HA] · [H2O ] [HA]
KS = Säurekonstante
Unabhängig also von der Verdünnung, gibt der KS - Wert die tatsächliche Säurestärke an. Man bezeichnet ihn auch als Säurekonstante. Bei starken Säuren ist KS besonders groß.
Allgemeine Gleichung der Basendissoziation: H2O + B ⇌ OH– + HB+
Massenwirkungsgesetz: Einbeziehung des Wassers in die Konstante:
[OH–] · [HB+] [OH–] · [HB+]
=> k = ————————— => KB = k · [H2O] = —————————
[B] · [H2O ] [B]
KB = Basenkonstante
Zur besseren Übersicht wird (wie beim pH-Wert) häufig der negative dekadische Logarithmus als pKS - Wert verwendet.
Je geringer dabei der pKS-Wert, desto stärker die Säure.
pKS = - lg (KS)
pKB = - lg (KB)
Zusatzinformationen:
Zusammenhänge und Tipps zur Vereinfachung
Umrechnungen vom pK-Wert auf K:
KS = 10–pKS
KB = 10–pKB
Zusammenhang zum Ionenprodukt des Wassers (bei Standardbedingungen, 25°C!):
KS · KB = [H3O+] · [OH–] = KW = 10–14 mol2/l2
=> pKS + pKB = pKW = 14
Aus den letzten beiden Gleichungen folgt, dass eine starke Säure logischerweise eine schwache Base ist (und umgekehrt). Weiterhin folgt daraus, dass eine starke Säure zu einer schwachen korrespondierenden Base reagiert:
Faustregel: Starke Säuren reagieren zu schwachen Basen, starke Basen zu schwachen Säuren.
Merke:
- sehr starke Säure: pKS < -1,74
- starke Säure: pKS - 1,74 - 4
- schwache Säure: pKS 4 - 9
- sehr schwache Säure: pKS > 9
Übungsaufgabe zur Herleitung von pKS + pKB = 14
Welche Gesetzmäßigkeit gilt, wenn man die pKS- und pKB-Werte von korrespondierenden Säuren und Basen addiert? Leite dies mithilfe des MWG mathematisch her.
Musterlösung:
Allgemeine Säurereaktion mit Wasser: HA + H2O ⇌ A– + H3O+
=> MWG Säurereaktion:
[A–] · [H3O+] [A–] · [H3O+]
k = ———————————— => KS = k · [H2O] = —————————
[HA] · [H2O ] [HA]
Allgemeine Basenreaktion mit Wasser: A– + H2O OH– + HA
=> MWG Basenreaktion:
[OH–] · [HA] [OH–] · [HA]
k = ——————————— => KB = k · [H2O] = —————————
[A–] · [H2O ] [A–]
Multiplikation von KS mit KB:
[A–] · [H3O+] [OH–] · [HA]
KS · KB = ——————— · ———————— = [H3O+] · [OH–] = KW
[HA] [A–]
=> logarithmieren: pKS + pKB = pKW = 14
Das unterschiedliche Verhalten von starken und schwachen Säuren
Die Wirkung einer starken Säure beruht darauf, dass sie in Wasser zu 100% dissoziiert ist. Das Gleichgewicht liegt also völlig auf der Seite der Oxoniumionen (H3O+).
=> Starke Säuren zeigen in der gleichen Menge Wasser also immer den gleichen pH-Wert, egal, um welche Säure es sich handelt.
=> Das Oxoniumion ist in Wasser die stärkste Säure.
HA + H2O ⇌ H3O+ + A–
Die vollständige Dissoziation hat bei starken Säuren (pKS-Wert < -1,74) die Konsequenz, dass im Grunde kein Gleichgewicht mehr vorliegt. Eine genaue Bestimmung von KS-Werten ist somit im Grunde nicht möglich!
Gleiches gilt für sehr starke Basen (pKB-Wert < -1,74). Auch hier lassen sich keine genaueren (pKB-Werte mehr bestimmen.
=> Sehr starke Basen sind in wässrigen Lösungen vollständig protoniert.
Die stärkste Base in wässrigen Systemen ist das Hydroxidion:
H2O + O2– ⇌ OH– + OH–
Konsequenzen:
a) pH-Wert Berechnung bei starken Säuren:
Die starke Säure reagiert vollständig mit Wasser:
HA + H2O ---> H3O+ + A–
=> Die Konzentration [A–] ist nach der Reaktion gleich der Anfangskonzentration c0 der Säure [HA]
=> Aufgrund des enormen Größenunterschieds, kann man die Oxoniumionenkonzentration der Autoprotolyse des Wassers (10-7 mol/l) vernachlässigen.
=> Die Konzentration von Oxoniumionen entspricht der an Anionen: [H3O+] ≈ [A–]
=> Der pH-Wert kann also vereinfacht aus der Ausgangskonzentration der Säure berechnet werden:
pH = - lg c0 (HA)
Als starke Säuren gelten anorganische Säuren wie Schwefelsäure, Salzsäure, Salpetersäure und Phosphorsäure. Organische Säuren hingegen sind in der Regel schwach (Essigsäure, Citronensäure, Ameisensäure usw.).
b) pH-Wert Berechnung bei schwachen Säuren:
Da eine schwache Säure nur in geringem Maßstab dissoziiert, ist die Gleichgewichtskonzentration der Säure c(HA) kaum von der Ausgangskonzentration c0[HA] verschieden.
HA + H2O ⇌ H3O+ + A–
=> c(HA) ≈ C0(HA)
Werden wieder die Oxoniumionen der Autoprotolyse vernachlässigt, gilt also auch:
[H3O+] ≈ [A–]
Der pH-Wert ist also:
[H3O+] · [A–] [H3O+]2
KS = ————————— = ———————— => [H3O+] = KS · c0[HA]
[HA] [HA]
=> pH = - lg [H3O+]
=> pH = ½ (pKS - lg c0[HA])
Als Näherung kann also die Anfangskonzentration der Säure c0[HA] verwendet werden, wenn man keine Aussagen über die tatsächliche Gleichgewichtskonzentration cGlgw[HA] treffen kann. Genauere Ergebnisse erhält man natürlich durch Rechnen mit cGlgw[HA].
Für Basen und die Berechnung der pOH-Werte gilt entsprechendes!
Aufgaben:
1. Berechnen Sie den pKS-Wert der Essigsäure (Ethansäure). Die Messung einer 0,1 molaren (0,1 mol/l) Essigsäure zeigt einen pH-Wert von 2,88.
Lösung:
Beachte, man muss nicht die Anfangskonzentrationen, sondern die Gleichgewichtskonzentrationen in die Formel eingeben! (Tipp zur Schreibweise - Essigsäure (H3C-COOH) wird oft mit HAc abgekürzt. Ac steht dabei für den Säurerest Acetat (H3C-COO-)
c0(H3O+) = unbekannt cGlgw(H3O+) = berechenbar durch den pH-Wert
c0(Ac-) = unbekannt cGlgw(Ac-) = cGlgw(H3O+)
c0(HAc) = 0,1 mol/l cGlgw(HAc) = c0(HAc) - cGlgw(H3O+) (Das ist wichtig zu verstehen!)
Aus dem pH berechnet man nun die cGlgw(H3O+) (welche gleich der cGlgw(Ac-) ist)
=> cGlgw(H3O+) = 10 -2,88 = 0,0013 mol/l
cGlgw(H3O+) · cGlgw(Ac-)
=> KS = ——————————————
c0(HAc) - cGlgw(H3O+)
cGlgw(H3O+)2
KS = —————————————— = 0,0000174 bzw. 1,74 · 10-5 => pKS = 4,75
0,1 mol/l - 0,0013 mol/l
pKS und pKB -Werte
|
Säurestärke |
pKs |
Säure |
Formel |
kspd. Base |
pKb |
Basenstärke |
|||
|
sehr stark |
−10 |
Perchlorsäure |
HClO4 |
+ H2O |
ClO4− |
+ H3O+ |
24 |
sehr schwach |
|
|
−10 |
Iodwasserstoff |
HI |
+ H2O |
I− |
+ H3O+ |
24 |
|||
|
−6 |
Chlorwasserstoff |
HCl |
+ H2O |
Cl− |
+ H3O+ |
20 |
|||
|
−3 |
Schwefelsäure |
H2SO4 |
+ H2O |
HSO4− |
+ H3O+ |
17 |
|||
|
stark |
0 |
Oxoniumion |
H3O+ |
+ H2O |
H2O |
+ H3O+ |
14 |
schwach |
|
|
−1,3 |
Salpetersäure |
HNO3 |
+ H2O |
NO3− |
+ H3O+ |
15,3 |
|||
|
1,9 |
Hydrogensulfat |
HSO4− |
+ H2O |
SO42− |
+ H3O+ |
12,1 |
|||
|
2,1 |
Phosphorsäure |
H3PO4 |
+ H2O |
H2PO4− |
+ H3O+ |
11,8 |
|||
|
3,1 |
Fluorwasserstoff |
HF |
+ H2O |
F− |
+ H3O+ |
10,7 |
|||
|
3,8 |
Ameisensäure |
HCOOH |
+ H2O |
HCOO− |
+ H3O+ |
10,3 |
|||
|
mittelstark |
4,8 |
Essigsäure |
CH3COOH |
+ H2O |
CH3COO− |
+ H3O+ |
9,3 |
mittelstark |
|
|
6,5 |
Kohlensäure |
H2CO3 |
+ H2O |
HCO3− |
+ H3O+ |
7,5 |
|||
|
6,9 |
Schwefelwasserstoff |
H2S |
+ H2O |
HS− |
+ H3O+ |
7,1 |
|||
|
7,2 |
Dihydrogenphosphat |
H2PO4− |
+ H2O |
HPO42− |
+ H3O+ |
6,8 |
|||
|
schwach |
9,2 |
Amoniumion |
NH4+ |
+ H2O |
NH3 |
+ H3O+ |
4,8 |
stark |
|
|
9,4 |
Cyanwasserstoff (Blausäure) |
HCN |
+ H2O |
CN− |
+ H3O+ |
4,6 |
|||
|
10,4 |
Hydrogencarbonat |
HCO3− |
+ H2O |
CO32− |
+ H3O+ |
3,6 |
|||
|
12,4 |
Hydrogenphosphat |
HPO42− |
+ H2O |
PO43− |
+ H3O+ |
1,6 |
|||
|
13,0 |
Hydrogensulfid |
HS− |
+ H2O |
S2− |
+ H3O+ |
1,0 |
|||
|
14 |
Wasser |
H2O |
+ H2O |
OH− |
+ H3O+ |
0 |
|||
|
sehr schwach |
15,9 |
Ethanol |
CH3CH2-OH |
+ H2O |
CH3-CH2-O− |
+ H3O+ |
−1,9 |
sehr stark |
|
|
23 |
Ammoniak |
NH3 |
+ H2O |
NH2− |
+ H3O+ |
−9 |
|||
|
34 |
Methan |
CH4 |
+ H2O |
CH3− |
+ H3O+ |
−20 |
- Starke Säuren haben einen geringen pKS - Wert.
- Starke Säuren dissoziieren in verdünnter wässriger Lösung vollständig.
- Starke Basen haben einen geringen pKB - Wert.
- Starke Basen sind in Wasser vollständig protoniert.
Zusatzinformationen:
http://de.wikipedia.org/wiki/Säurekonstante#pKs-_und_pKb-Werte_einiger_Verbindungen
pKS-Werte der mehrprotonigen Säuren
Man kann mit diesem Wissen nun jedem Protolyseschritt einen pKS-Wert zugewiesen. Am Beispiel der dreistufigen Protolyse von Phosphorsäure soll dies einmal verdeutlicht werden:
H3PO4 + H2O ⇌ H2PO4- + H3O+ pKS1 = 2,13 KS1 = 7,4 · 10–3
H2PO4- + H2O ⇌ HPO42- + H3O+ pKS2 = 7,20 KS2 = 6,3 · 10–8
HPO42- + H2O ⇌ PO43- + H3O+ pKS3 = 12,36 KS3 = 4,4 · 10–13
Kleine Hilfe zur Erinnerung:
Die pKS-Werte der einzelnen Protolysestufen unterscheiden sich in der Regel um den Potenzwert 5.
pKS-Werte einiger organischer Säuren
pKS(Methansäure) = 3,75
pKS(Ethansäure) = 4,76
pKS(Propansäure) = 4,88
pKS(Butansäure) = 4,82
Wasser: KW-Werte und pKW bei verschiedenen Temperaturen
|
Temperatur in °C |
KW [ mol²/l²] |
pKW |
|
0 |
1,14 ּ 10-15 |
14,944 |
|
5 |
1,85 ּ 10-15 |
14,734 |
|
10 |
2,92 ּ 10-15 |
14,535 |
|
15 |
4,51 ּ 10-15 |
14,346 |
|
20 |
6,81 ּ 10-15 |
14,167 |
|
25 |
1,01 ּ 10-14 |
13,997 |
|
30 |
1,47 ּ 10-14 |
13,833 |
|
40 |
2,92 ּ 10-14 |
13,535 |
|
50 |
5,47 ּ 10-14 |
13,262 |
|
60 |
9,61 ּ 10-14 |
12,917 |
|
70 |
21,2 ּ 10-14 |
12,670 |
|
80 |
35 ּ 10-14 |
12,460 |
|
90 |
53 ּ 10-14 |
12,280 |
|
100 |
73 ּ 10-14 |
12,140 |
Quantitative Säure - Base Titration
Das Ziel einer Säure-Base-Titration ist es, die Stoffmengenkonzentration [c] in mol/l einer Säure bzw. Base unbekannter Konzentration zu bestimmen. Man nutzt dabei die Idee, dass sich eine saure und eine basische Lösung bei einem bestimmten Mengenverhältnis vollständig neutralisieren. Der pH-Wert der Lösung geht dabei gegen 7.
Durch die Titration wir weit mehr bestimmt als der Punkt, an dem eine Lösung neutral ist:
- Bei Säuren unbekannter Konzentration kann durch Titrieren mit einer Base bekannter Konzentration die Säurekonzentration genau ermittelt werden (oder umgekehrt, d.h. eine unbekannte Laugenkonzentration kann bestimmt werden).
z.B. mit einer Natriumlauge bekannter Konzentration wird eine Salzsäure titriert. Das Volumen der Säure wird vorher festgelegt (z.B. 20ml). Nun ergibt sich am Neutralpunkt ein bestimmtes benötigtes Volumen an Natronlauge. Es gilt:
cNaOH · VNaOH = n(OH–) = n(HCl) - Aus der Titrationskurve lassen sich dann Äquivalenzpunkt und pKS-Werte bestimmen und so unter Umständen sogar unbekannte Säuren sogar eindeutig identifiziert werden.
Durch diese genauen Neutralisationreaktionen lassen sich also wichtige Aussagen ableiten und damit gehört die Titration zu den Verfahren der quantitativen Analyse.
Wird eine Säure mit einer Base bekannter Konzentration (Maßlösung) titriert, nennt man dieses Verfahren auch Alkalimetrie. Im umgekehrten Fall, Titration einer Base mit einer Säure, spricht man von Acidimetrie.
Beispiel: Es wird zu Salzsäure unbekannter Konzentration aus einer Bürette Natronlauge mit bekannter Konzentration hinzugetropft. Aufgrund der Menge der eingesetzten Salzsäurelösung und verbrauchten Menge an Natronlauge kann unter Zuhilfenahme der Reaktionsgleichung die Konzentration der Salzsäure bestimmt werden.
Um den Äquivalenzpunkt (vollständige Neutralisation von Säure und Base) der Titration festzustellen, gibt es verschiedene Möglichkeiten. Auf den folgenden Seiten werden die wichtigsten vorgestellt:
a) Titration mit Indikator
20 ml Natronlauge sollen mit Salzsäure neutralisiert werden. Die Konzentration der Salzsäure ist bekannt (0,1 mol/l), die der Natronlauge ist unbekannt. Bestimme die Konzentration der Natronlauge.
Variation: die Schüler sollen die Natronlauge selbst abwiegen (ca. 2g/50ml entspricht 1mol/l) und eine 1 molare NaOH herstellen. Das ganze wird mit einer 1molaren HCl titriert. Werden 20ml Lauge vorgelegt, so sollten im Idealfall 20ml Säure notwendig sein. Anhand der Differenz kann der Fehler berechnet werden.
V: Eine Bürette wird mit 50ml Salzsäure gefüllt. 20ml Lauge werden darunter in ein Becherglas gegeben und nach Möglichkeit auf einen Magnetrührer gestellt. In die Lauge wird etwas Universalindikator gegeben.
B: Nach Zugabe von 30ml Säure ist die Lauge neutralisiert. Dies ist erkennbar am Farbumschlag des Universalindikators von blau nach grün.
S: In der Chemie unterscheidet man erstens zwischen qualitativen Verfahren, bei denen die Stoffe, die an einer Reaktion teilnehmen, an sich bestimmt werden oder die dabei entstehen und zweitens quantitativen Verfahren, bei denen die Stoffmenge von bekannten Stoffen bestimmt wird.
Berechnung der Konzentration von NaOH:
HCl: V= 30ml (=0,03l)
c= 0,1mol/l
n= ?
Die Stoffmenge n ist leicht zu berechnen:
n
cHCl = ——— => n = c · V
V
=> nHCl = 0,1 mol/l · 0,03l
= 0,009mol HCl
NaOH: V=20ml (=0,02l)
c= ?
n= ?
Da wir die Konzentration nicht kennen, kann diese nur durch die Stoffmenge n berechnet werden! Nur wie groß ist die?
Bei der Neutralisation werden alle Oxoniumionen durch Hydroxid der Lauge unschädlich gemacht. Es muss also gelten:Im Neutralpunkt ist die Stoffmenge von Oxoniumionen und Hydroxidionen gleich
nHCl = nNaOH
=> die Stoffmenge an Hydroxid (und somit auch an NaOH) ist auch 0,009mol!
=> cNaOH = n/V = 0,009mol/ 0,02l = 0,45 mol/l
Damit nun alle Eventualitäten berechnet werden können, ersetzen wir „n“ in der Gleichung
durch „c · V“:
nHCl = nNaOH
cSäure · VSäure = cLauge · Vlauge
Zusatzinformationen:
http://de.wikipedia.org/wiki/Stoffkonzentration
http://de.wikipedia.org/wiki/Titration
b) Titration mit pH-Messelektrode
Die Titration mit einer pH-Messelektrode funktioniert im Grunde genauso, nur dass anstelle des Universalindikators eine pH-Messelektrode den pH-Wert elektrisch bestimmt.
Messreihe: 20 ml einer Essigsäure unbekannter Konzentration werden mit Natronlauge (c= 0,1 mol/l) titriert.
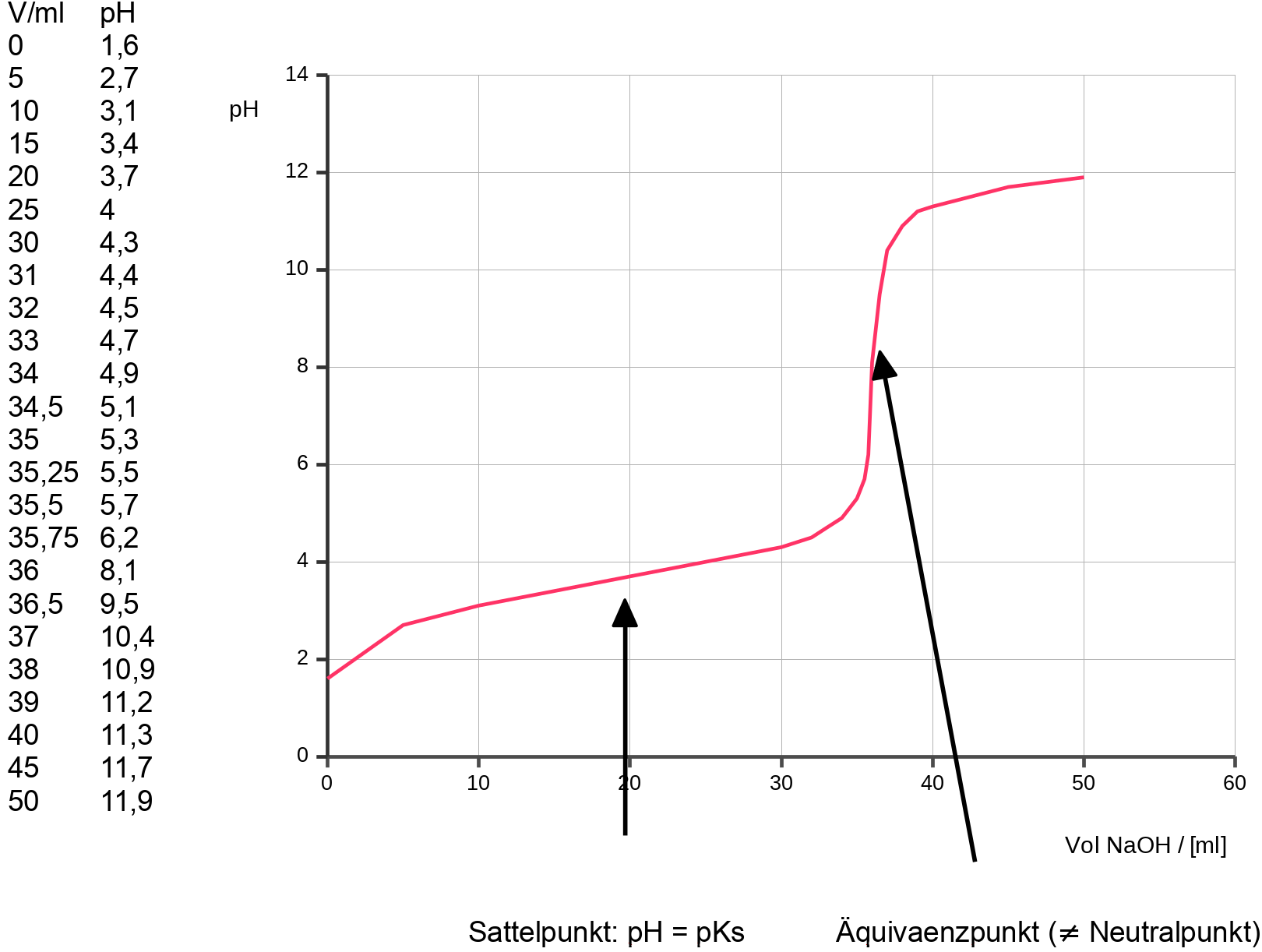
- am Sattelpunkt: pH = pKs
- der Äquivaenzpunkt ≠ Neutralpunkt
c) Leitfähigkeitstitration
V: Zu 20ml Barytwasser (kaltgesättigt!) wird verdünnte Schwefelsäure getropft (+Universalindikator). Die Leitfähigkeit wird gemessen. Wenn der Neutralpunkt erreicht ist (Farbumschlag), tropft man weiter hinzu!
B: Die Leitfähigkeit der Lösung nimmt erst ab, dann zu.
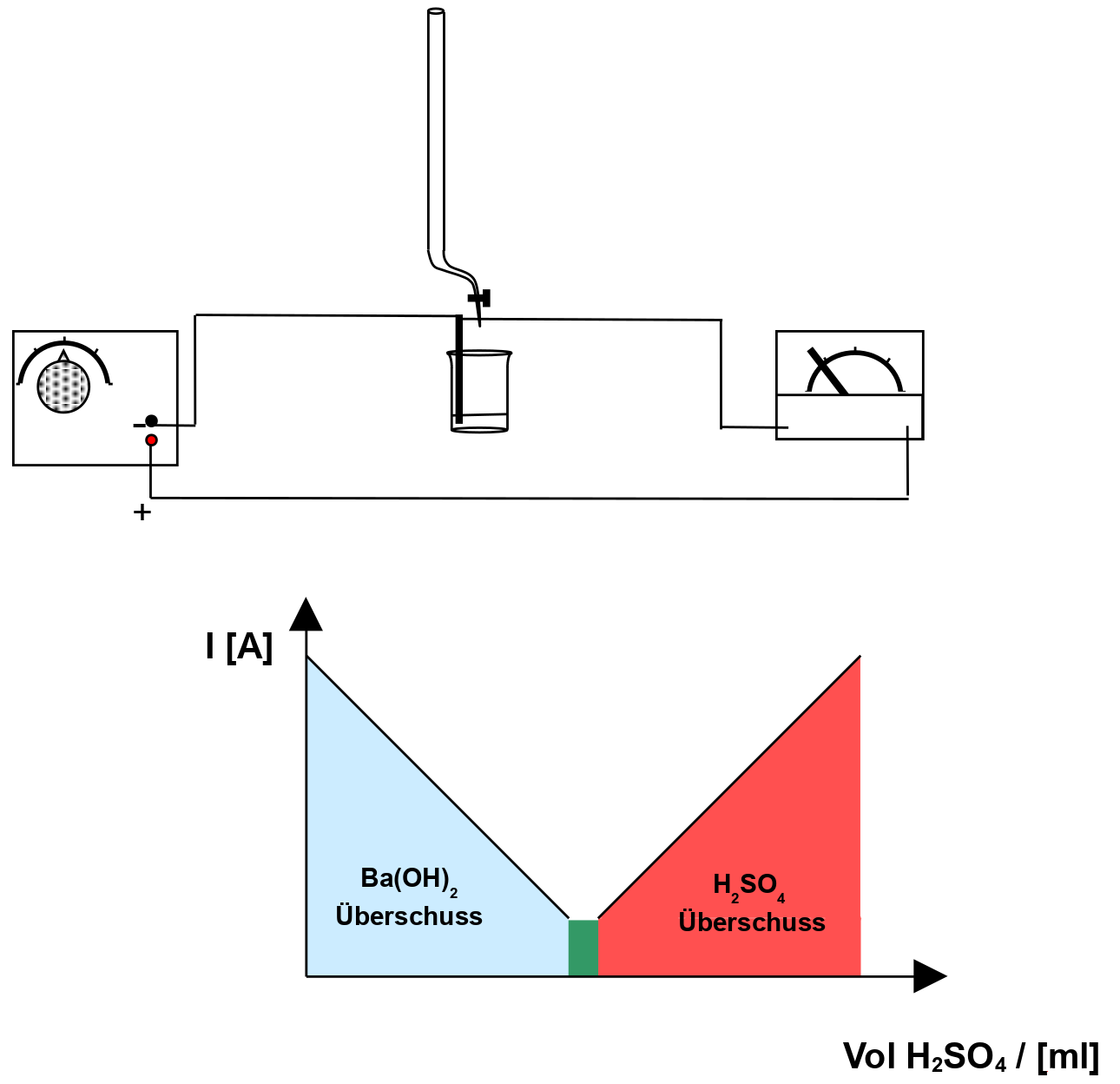
S:
1. Warum leitet Bariumhydroxidlösung den e– Strom?
In wässriger Lösung zerfällt jedes Molekül Ba(OH)2 in drei Ionen: Ba2+ und 2 OH-
Diese transportieren die elektrischen Ladungen.
2. Warum verringert sich die Leitfähigkeit durch Zugabe von H2SO4?
Ba2+(OH)-2 + H+2SO42- ---> 2 H2O + Ba2+SO42–
1. Ursache: Am Anfang liegen drei Ionen vor. Durch Zugabe von Schwefelsäure verringert sich die Anzahl auf zwei, da zusätzlich Wasser gebildet wird, welche nicht aus Ionen aufgebaut ist.
2. Ursache: Es bildet sich das schwerlösliche Salz BaSO4. Diese leitet nicht den Strom, da es nicht gelöst vorliegt.
3. Warum ist die Leitfähigkeit am Neutralpunkt minimal?
Es liegen keine freibeweglichen Ionen vor.
4. Warum nimmt die Leitfähigkeit dann wieder zu?
Die weitere Zugabe von H2SO4 erhöht die Leitfähigkeit, da dessen Ionen den Strom leiten.
2 H+ + SO42– + Ba2+ + 2 OH– ---> 2 H2O + BaSO4
S: Es bildet sich das schwerlösliche Salz Bariumsulfat, dadurch sinkt die Leitfähigkeit anfangs. Die Protonen werden neutralisiert. Nach Erreichen des Neutralpunktes steigt die Leitfähigkeit, da nun immer mehr Oxonium und Sulfationen hinzukommen, da verdünnte Schwefelsäure fast vollständig in Ionen zerfallen ist.
Aussagen einer Titrationskurve
a) Titration einer starken Säure mit einer starken Base
Bei staken Säuren und Laugen ist die Titration unauffällig. Geht man von Zugabe von Base zur Säure aus, erhält man die unten abgebildete (blaue) Kurve. Sie ist bei allen starken Säuren sehr ähnlich.
Man erhält eine Titrationskurve, welche zuerst fast parallel zur x-Achse verläuft und sich über einen weiten Bereich kaum ändert. Dann kommt es zu einem rapiden Anstieg und dann erneut wieder zu einem fast parallelen Kurvenverlauf. Der Wendepunkt der Kurve entspricht dem Äquivalenzpunkt, welcher in der Regel deckungsgleich mit dem Neutralpunkt ist.
Der langsame Anstieg des pH-Werts ist zum Teil auf die logarithmische Auftragung (erinnere Dich, der pH ist logarithmische definiert!) zurückzuführen.
Der Äquivalenzpunkt (ÄP) entspricht dem Wendepunkt der Titrationskurve und ist als der Punkt definiert, bei dem die Stoffmengen von Säure und Base gleich sind. Dies entspricht bei starken Säuren dem Neutralpunkt (NP) (pH=7). An diesem Punkt liegt also eine neutrale Salzlösung vor.
Die weitere Zugabe an Base entspricht also der Zugabe von Base zu Wasser. Das heißt, die Lösung wird immer alkalischer.
Unterschied von schwachen und starken Säuren bei der Titration
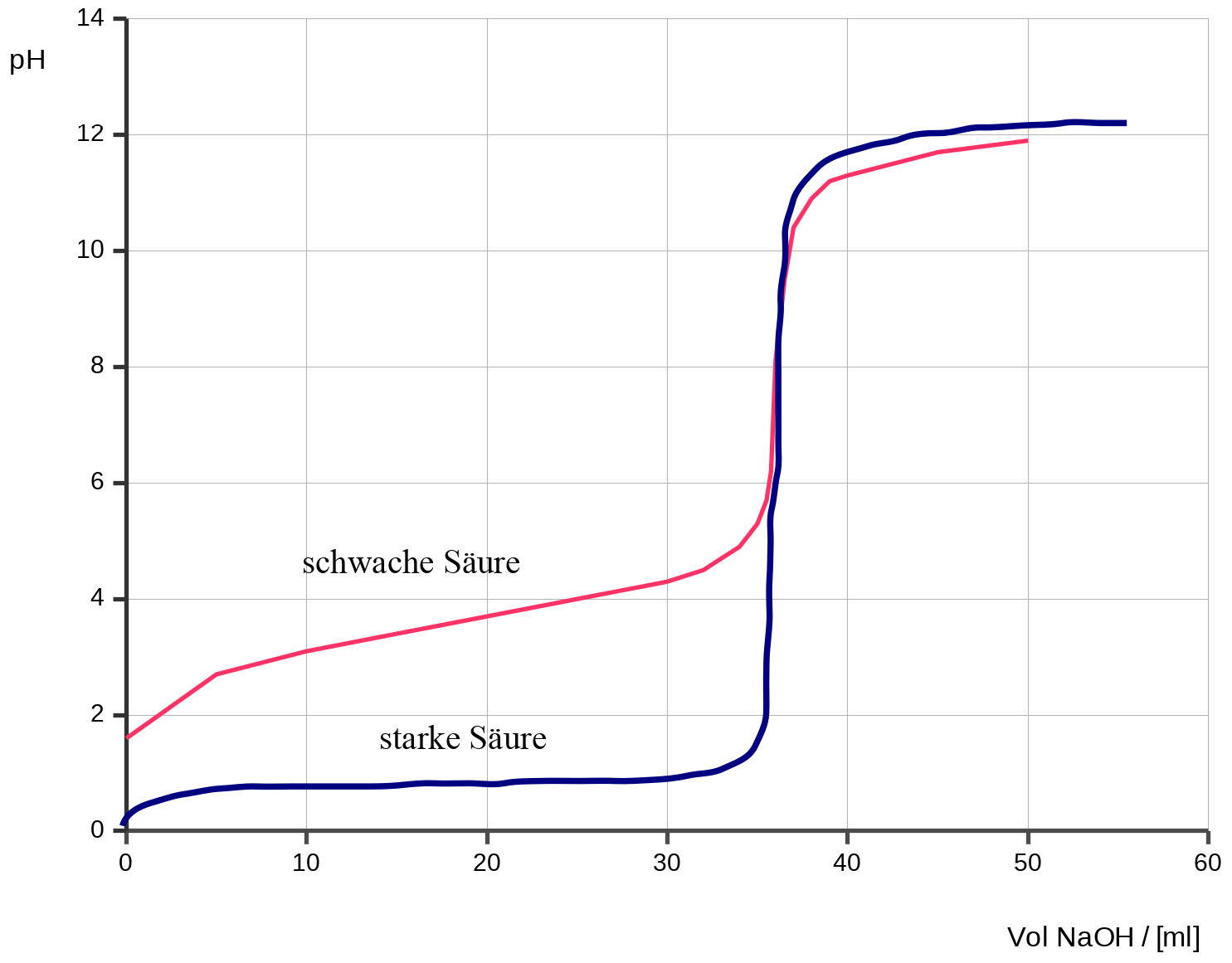
b) Titration einer schwachen Säure mit einer starken Base
Wird nun eine schwache Säure mit Base titriert so fallen einige Besonderheiten auf:
- Die Kurve startet bei höherem pH-Wert, da nicht die komplette Säure im Gleichgewichtszustand zur Produktseite reagiert hat. Mit anderen Worten, die Säure ist nicht komplett dissoziiert.
- In der ersten Phase, dort wo man den pKS-Wert ablesen kann, verläuft sie ebenfalls flach, aber man kann oft besser einen Wendepunkt erkennen. Dieser erste Wendepunkt entspricht dem pKS-Wert.
Hintergrund ist die ständige Reaktion des Gleichgewichts auf die Störung von außen durch die Zugabe von Base. Das Gleichgewicht kompensiert diese Störung nach Le Chatelier, indem es die Protonen/ Oxoniumionen auf Produktseite, die nun durch die Base gebunden werden nachbildet:
Beispiel: Titration von Essigsäure:
CH3COOH + H2O ⇌ CH3COO– + H3O+
H3O+ + OH– (aus der Base) ⇌ 2 H2O - Die Steigung um den Äquivalenzpunkt ist meist etwas weniger Steil (hängt auch von der verwendeten Basenkonzentration ab!)
- Der Anfangs-pH-Wert kann leicht berechnet werden:
verwendet man zum Beispiel eine Essigsäure und hat am Ende bestimmt, dass ihre Konzentration 0,1 mol/l ist, so gilt:
pH = 1/2·(pKS - lg [Säure]0) = 1/2·(4,8 + 1) = 2,9 - Bei schwachen Säuren sind Äquivalenzpunkt und Neutralpunkt nicht gleich!
Der neutralpunkt ist immer bei 7 und der Äquivalenzpunkt kann über die Formel für schwache Basen bestimmt werden: pH Äquivalenzpunkt = 14 - 1/2·(pKB - log [Base]0) = 14 - 1/2·(9,2 - lg 0,05) = 8,7.
Alle Aussagen gelten immer auch für den umgekehrten Fall, also die Titration einer schwachen Base mit einer starken Säure.
Titratonskurve einer mehrprotonigen Säure
Phosphorsäure
Der einzige Unterschied, der bei mehrprotonigen Säuren berücksichtigt werden muss, ist die Tatsache, dass mehrere abspaltbare Protonen vorliegen. Demzufolge hat man auch mehrere Äquivalenzpunkte.
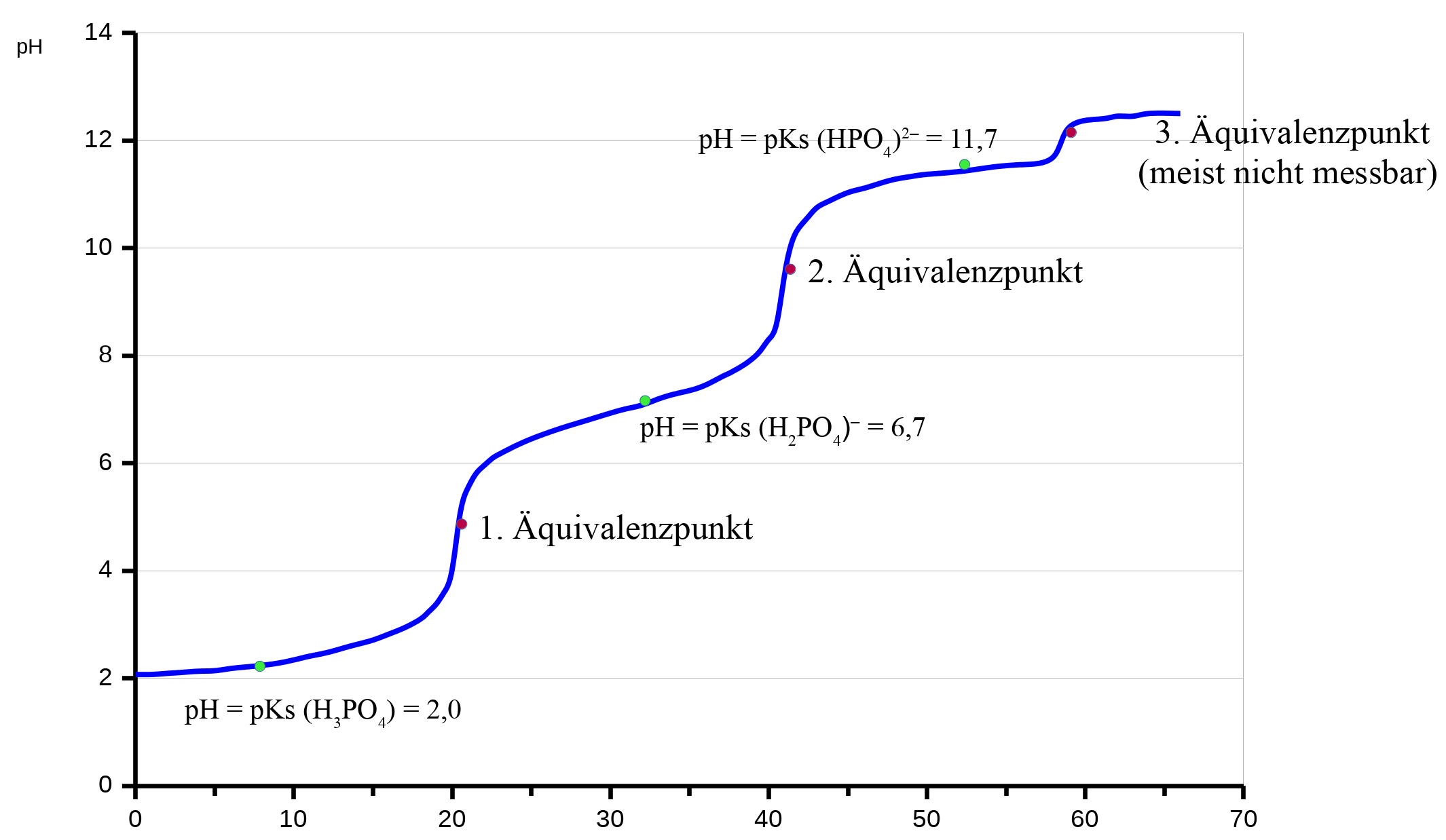
Titrationskurve: 3 Äquivalenzpunkte bei Phosphorsäure
Fehlerbetrachtung: Fehlerquellen bei der Titration
- Falsches Einwiegen der Natronlauge zur Herstellung der Lauge.
- Falsches Abmessen der Flüssigkeiten
- Falsches Ablesen der Messinstrumente (inklusive Büretten, Messzylinder)
- Flüssigkeitsmengen wurden mit dem Becherglas und nicht mit dem Messzylinder bestimmt.
- Es wurde nicht ausreichend gerührt (besser elektrisch rühren!)
- Die graphische Auftragung erfolgte falsch/ ungenau.
- Versehentlich wurde die Lösung mit dem Magnetrührer erhitzt (Säure-Base-Gleichgewichte sind temperaturabhängig!)
- Die pH-Elektrode misst ungenau, da sie ausgetrocknet war oder das pH-Messgerät war unzureichend geeicht.
- Ablesen der Bürette durch falsche Position
Zusatzinformationen:
- http://de.wikipedia.org/wiki/Titration
- http://de.wikipedia.org/wiki/Äquivalenzpunkt
- http://de.wikipedia.org/wiki/Halbäquivalenzpunkt
- http://de.wikipedia.org/wiki/Bild:Titolazione.gif (schöne animierte Grafik)
Aufgaben zur Säure Base Titration und zum pH-Wert
1. Für die Neutralisation von 50ml Schwefelsäure benötigt man 15ml Natronlauge mit der Konzentration 0,1mol/l. Bestimme die Konzentration der Schwefelsäure.
2. Es sollen 10ml Salzsäure (c= 0,001 mol/l) mit Kalkwasser neutralisiert werden. (Kalkwasser ist eine wässrige Lösung von Calciumhydroxid).
a) Stelle die Reaktionsgleichung auf.
b) Bestimme die notwendige Stoffmenge an Calciumhydroxid.
c) Zur Calciumhydroxid Herstellung liegt Calciumoxid vor. Wie stellt man aus Calciumoxid Calciumhydroxid her (mit Reaktionsgleichung)? (Bedenke: Calciumoxid ist ein Metalloxid)
d) Welche Masse an Calciumoxid muss abgewogen werden, damit die notwendige Stoffmenge an Calciumhydroxid vorliegt?
e) Statt Salzsäure werden 10ml Phosphorsäure (c= 0,001mol/l) verwendet. Berechne die notwendige Masse an CaO.
3. 50ml Salzsäure werden mit 30ml Natronlauge (c=0,01mol/l) neutralisiert. Welchen pH-Wert hatte die Salzsäure?
4. Wie viel Natronlauge (c=0,01mol/l) ist zum Neutralisieren eines Liters Mineralwasser notwendig, wenn der pH-Wert 6,0 beträgt?
5. 0,05 mol einer Schwefelsäure werden auf ein Volumen von 250ml verdünnt. Welche Stoffmenge an Natronlauge ist zur Neutralisation notwendig? ;-)
6. Bei einem Experiment bleiben 1,2l Schwefelsäure über. Der pH-Wert ist 1. Wie viel ml Natronlauge (c=0,5 mol/l) sind zum Neutralisieren notwendig?
7. Wie groß ist der pH-Wert (und der pOH-Wert) einer Salzsäure, die eine Konzentration von
a) 1 mol/l hat
b) 0,1 mol/l hat
c) 0,01 mol/l hat
d) 0,001 mol/l hat
8. Wie ist die Konzentration einer Schwefelsäure, welche einen pH-Wert von 4 hat?
9. a) Wie viele Oxoniumionen und wie viele Hydroxidionen befinden sich in 5l Blut, wenn Du weißt, dass Blut einen pH-Wert von 7,4 hat?
b) Wie viele befinden sich in Magensäure (pH-Wert = 1)?
10. a) Welche pH-Wert hat eine Lösung mit einer Konzentration von 7,1 ·10-3 mol/l?
b) Wie viele Oxoniumionen befinden sich dann in 50ml dieser Lösung?
11. 100ml HCl mit dem pH-Wert=3 werden mit 100ml HCl mit dem pH-Wert 4 zusammen geschüttet. Wie ist der anschließende pH-Wert?
12. Für die Neutralisation von 100ml Kalkwasser steht eine 1molare Phosphorsäure bereit. Es werden genau 22ml benötigt. Bestimme die Konzentration und anschließend den ursprünglichen pH-Wert des Kalkwassers.
13. Eine Waschseife ruft bei einem sensiblen Menschen mit sehr zarter Haut, nach mehrmaligem dauernden Einseifen eine minimale Rötung der Haut hervor. Alarmiert von diesem doch betrüblichem Befund, misst er den pH-Wert einer Seifenlösung und stellt erschrocken fest, dass er pH = 8,9 ist. Wie groß ist die Konzentration an Oxoniumionen?
14. Eine Ammoniaklösung hat den pH-Wert von 12,3. Bestimme die Konzentration an Oxoniumionen.
15. 3g Natriumhydroxid werden in 150ml Wasser gelöst.
a) Welchen pH-Wert wird die Lösung haben?
b) Wie ändert sich der pH-Wert bei Verdünnung auf einen Liter Lösung?
16. 50ml einer 2,5molare Salzsäure werden auf 200ml verdünnt. Welcher pH-Wert wird zu messen sein?
17. Reagieren alle Salze gelöst in Wasser neutral? Begründe mithilfe einer Reaktionsgleichung, warum Ammoniumchlorid nicht neutral reagiert.
18. Ammoniumchlorid reagiert mit Natronlauge. Es entsteht ein stechend riechendes Gas. Benenne es.
19. Natriumacetat reagiert mit Schwefelsäure unter Bildung von Essig. Erstelle die Reaktionsgleichung und ordne die korrespondierenden Säuren und Basen zu.
20. Natriumhydrogencarbonat kann als Ampholyt reagieren. Formuliere die jeweiligen Säure-Base-Reaktionen, welche mit HCl bzw. NaOH ablaufen.
21. Eine verdünnte Salzsäure wird mit pH-Wert 4 gemessen. Bestimme die Konzentration an Oxoniumionen und Hydroxidionen.
22. Erstelle die Reaktionsgleichung (in Valenzstrichformeln) der Autoprotolyse von Wasser, der (wasserfreien!) Autoprotolyse von Ammoniak und der (wasserfreien!) Autoprotolyse von Salpetersäure. Kennzeichne jeweils den Protonenübergang mithilfe von Pfeilen.
23. Berechne die Konzentration an Wasser in neutralem Wasser. :-)
24. 0,2 mol konzentrierte Propansäure werden auf einen Liter verdünnt. Der pH-Wert beträgt 2,8. bestimme den pKS-Wert.
25. Eine 0,7 molare Ammoniaklösung wird mit pH-Wert 11,5 gemessen. Berechne den pKB Wert.
26. Eine verdünnte Essigsäure (pKs = 4,75) wird mit pH-Wert 2,6 gemessen. Berechne ihre Ausgangskonzentration c0.
27. Eine auf 0,1 mol/l verdünnte Ammoniaklösung (pKB = 4,63) wird mit einem pH-Meter gemessen. Was wird die Anzeige anzeigen, wenn das Gerät genau geeicht ist (also, wie bei uns im Labor ;-)?
28. Welcher pH-Wert stellt sich ein, wenn man zu folgenden Stoffen jeweils einen Liter Wasser gibt:
a) 2,5g Natriumhydroxid b) 0,5g Chlorwasserstoff c) 3g Bariumhydroxid
29. 3Liter Schwefeldioxid werden bei Standardbedingungen in einem Liter Wasser gelöst.
a) Stelle die RG auf und benenne das Produkt.
b) Das Produkt hat einen pKS-Wert von 1,8 - bestimme den pH-Wert.
30. Zu 40ml reiner Essigsäure wird soviel Wasser zugegeben, bis ein Liter verdünnte Säure entsteht. Die Dichte der Essigsäure beträgt 1,044 g/ml, der pKS-Wert beträgt 4,65.
a) Berechne die Masse der 40ml Essigsäure und dann die enthaltene Stoffmenge.
b) Welche Konzentration hat die Lösung?
c) Welcher pH-Wert wird sich einstellen?
31. 10ml einer Natronlauge werden mit 250ml Wasser verdünnt. Aus diesem Gemisch entnimmt man 10ml verdünnte Lauge. Man führt eine Neutralisation durch und benötigt dazu 3,5ml einer 0,1 molaren Salzsäure. Wie konzentriert ist die Lauge?
Musterlösung Aufgabe 1
Für die Neutralisation von 50ml Schwefelsäure benötigt man 15ml Natronlauge mit der Konzentration 0,1mol/l. Bestimme die Konzentration der Schwefelsäure.
1. Notieren, was gegeben ist, was gesucht ist:
n H2SO4 = ? n NaOH =
c H2SO4 = ? c NaOH = 0,1 mol/l
V H2SO4 = 0,05l V NaOH = 0,015l
2. Reaktionsgleichung aufstellen
H2SO4 + 2NaOH ⇌ Na2SO4 + 2H2O + E
3. Bestimmen der Stoffmengenverhältnisse im Neutralpunkt
Im Neutralpunkt ist laut Reaktionsgleichung die Stoffmenge der Natronlauge doppelt so hoch wie die der Schwefelsäure. Da die Schwefelsäure zweiprotonig ist, liegt die doppelte Menge H3O+ vor:
Stoffmengenverhältnis:
n H2SO4 1
————— = ― | · 2
n NaOH 2
2 n H2SO4
=> —————— = 1 | · n NaOH
n NaOH
=> 2n H2SO4 = n NaOH
4. Einsetzten der Formel: n = c · V
=> 2 (c H2SO4 · V H2SO4) = cNaOH · VNaOH | : 2 V H2SO4
=> c H2SO4 = cNaOH · VNaOH / 2V H2SO4
=> c H2SO4 = 0,1 mol/l · 0,015l / 2 0,05l = 0,015 mol/l
Puffersysteme I: Allgemeine Einführung
Lehrerdemonstration von zwei Gefäßen mit zwei unbekannten Flüssigkeiten A und B. Beide Lösungen werden jeweils zur Hälfte aufgeteilt, sodass man insgesamt vier Gefäße mit Lösungen (A, A & B, B) hat.
Zu Lösung A und B werden jeweils die gleiche Menge Säure zugegeben. Der pH-Wert wird bestimmt.
Zu den alternativen Lösungen A und B werden jeweils die gleiche Menge an Natronlauge zugefügt.
Ergebnis:
Lösung A: pH: = 6,5 Zugabe von Lauge: pH= 11
Zugabe von Säure: pH = 4
Lösung B: pH: = 6,5 Zugabe von Lauge: pH= 7
Zugabe von Säure: pH = 6
=> Der pH-Wert in Lösung A ändert sich jeweils um ca. 3 pH-Wertstufen.
Der pH-Wert im Lösung B ändert sich nur minimal.
Die zweite Lösung scheint die Zugabe (selbst größerer Mengen) von Säure oder Lauge besser abzufedern. Man nennt solche Lösungen „Pufferlösungen“.
Auflösung:
Lösung A ist Leitungswasser. Es zeigt das bekannte Verhalten. Die Zugabe von Säure führt zur Bildung von verdünnter Säure. Die Zugabe von Lauge führt zur Bildung verdünnter Lauge.
Die zweite Lösung (B) bestand aus einem Dihydrogenphosphat-/ Hydrogenphosphat-Puffer.
Ein solches Puffersystem hat als Grundlage ein chemisches Gleichgewicht aus einer Säure und ihrem entsprechendem Anion (Säurerest). Entsprechend dem Gesetz von Le Chatellier weicht dieses Gleichgewicht der jeweiligen Zugabe von Säure oder Lauge aus. Die Konsequenz ist ein Abpuffern der Hydroxidionen bzw. der Oxoniumionen.
Die Wirkung von Puffern im Detail:
H2PO4− + H2O ⇌ HPO42− + H3O+
Der gemessene pH-Wert liegt bei ca. 7,0. Dabei misst man die Konzentration an Oxoniumionen (H3O+).
Möglichkeit 1 – Säurezugabe:
Gibt man nun weitere Säure (Säuren setzten in Wasser H3O+-Ionen frei!) zu diesem Gleichgewicht hinzu, so vergrößert sich anfangs die Konzentration an Oxoniumionen. Da es eine Gleichgewichtsreaktion ist, reagiert das Gleichgewicht entsprechend Le Chatelier, indem mehr Edukte, also Wasser und Dihydrogenphosphat gebildet werden. Die Konzentration an Oxoniumionen sinkt in der Folge ungefähr auf den vorherigen Wert ab und der pH-Wert bleibt bei ca. 7.
Möglichkeit 2 – Basenzugabe:
Gibt man nun eine Lauge oder eine Base hinzu, entstehen mit Wasser zusammen immer Hydroxidionen (OH−). Dieser reagieren mit den Oxoniumionen und bilden Wasser: OH− + H3O+ ⇌ 2H2O
Die Konsequenz ist das a) die Wasserkonzentration der Edukte steigt und b) die Oxoniumionenkonzentration der Produkte sinkt. In beiden Fällen reagiert das Gleichgewicht identisch, indem es sich auf die Seite der Produkte verschiebt. Dies geht so lange, bis dem Zwang entgegengewirkt ist und ungefähr wieder die vorherige Oxoniumionenkonzentration vorliegt. Der pH-Wert bleibt also auch in diesem Fall bei ca. 7.
Das Gleichgewicht kann also beide Störungen „abpuffern“, was so lange gelingt, wie beide Salze vorliegen. Die beste Abpufferung hat man, wenn beide Salze in gleicher (hoher) Konzentration vorliegen.
Allgemein: Jede Pufferlösung besteht aus einer schwachen Säure (HA) (oder Basen B) und ihrem Anion A– (bzw. Kation BH+) - also ihrer korrespondierenden Base.
=> Allgemeine Form: H2O + HA ⇌ H3O+ + A–
Lösungen, deren pH-Wert sich bei der Zugabe von Säure oder Base nur wenig verändert werden als Pufferlösungen bezeichnet. Zugrunde liegt ein konjugiertes Säure-Base-Paar aus der Säure und ihrem Anion.
Generell gilt:
Gute und wirksame Puffer bildet man am besten mit:
- schwachen Säuren mit ihrem Salz (z.B. Essigsäure / Natriumacetat)
- schwachen Basen mit ihrem Salz (z.B. Ammoniumchlorid / Ammoniak)
Die Zugabe von Säure und Base in der allgemeinen Darstellungsform:
H3O+ + A– ⇌ H2O + HA
OH– + HA ⇌ A– + H2O
Es gibt auch Puffer mit starken Säuren (z.B. HCl-Puffer) - diese puffern nur innerhalb eines engen Bereiches.
Puffersysteme II: Die Berechnung von Pufferlösungen nach Henderson und Hasselbalch
Aus der allgemeinen Protolysegleichung wird das Massenwirkungsgesetz für KS aufgestellt.
HA + H2O ⇌ H3O+ + A–
[H3O+] [A–]
KS = ———————
[HA]
[HA]
=> [H3O+] = KS · ———
[A–]
[HA]
=> -lg [H3O+] = -lg KS - lg ————
[A–]
[HA]
=> pH = pKS - lg ———— (Henderson-Hasselbalch-Gleichung)
[A–]
Aus der Henderson und Hasselbalchgleichung lassen sich nun folgende Aussagen ableiten:
- Die Pufferwirkung ist am Besten, wenn das Verhältnis von Säure zu Anion bzw. von Base zum Basenkation 1:1 beträgt.
- Möchte man einen Puffer genau auf einen bestimmten pH-Wert einstellen, z.B. um damit eine Messelektrode zu eichen, oder empfindlichen Tropenfischen im Aquarium einen genau definierten pH-Wert geben, so kann man die notwendigen Konzentrationen leicht bestimmen.
- Die beste Pufferwirkung liegt vor, wenn der Puffer so eingestellt ist, das gilt: pH = pKS
Ein Tipp zur Vereinfachung beim Rechnen:
Da sich die Anionen und die Säure aus der oben genannten Formel ja in einem Gefäß befinden und in diesem sich das Volumen nicht ändert, kann man gleich mit Stoffmengen rechnen (da sich das Volumen rauskürzt):
n(HA)
————
V(HA) n(HA)
———————— = ————
n(A–) n(A–)
————
V(A–)
Schülerversuch: Herstellen von 100 ml eines Puffers mit pH=7
Um einen Puffer mit pH=7 herzustellen, liegen die beiden Salze KH2PO4 und Na2HPO4·2H2O vor (die 2 H2O bedeuten, dass im Salzkristall etwas Kristallwasser enthalten ist. Es muss bei der Berechnung der molaren Masse (M) berücksichtigt werden (also zum Wert 2·18g/mol hinzufügen).
Es soll folgendes Gleichgewicht zugrunde liegen:
H2PO4− + H2O ⇌ HPO42− + H3O+ pKS = 7,2
Die Schüler sollen einen Puffer mit dem pH-Wert 7 herstellen. Die Konzentration des einen Salzes wird bereits vorgegeben. [Na2HPO4] = 0,1 mol/l
Die einzuwiegende Massen der beiden Salze sollen nun bestimmt werden.
a) Bestimmung der Konzentration von [KH2PO4]:
[HA] [KH2PO4]
pH = pKS - lg ————— = pKS - lg ——————
[A–] [Na2HPO4]
[KH2PO4]
<=> lg —————— = pKS - pH
[Na2HPO4]
<=> lg [KH2PO4] = pKS - pH + lg [Na2HPO4]
<=> [KH2PO4] = 10pKS - pH · [Na2HPO4]
<=> [KH2PO4] = 10 7,2 - 7 · 0,1 mol/l
<=> [KH2PO4] = 0,158 mol/l
b) Bestimmung der Masse von KH2PO4 und Na2HPO4:
Wenn man nun die Konzentration von KH2PO4 kennt, kann man über die Formel n= m/M leicht die Masse bestimmen. Das Volumen soll 100ml betragen.
M= Na + MNa + MH + MP + MO + MO + MO + MO + MH + MH + MH + MH + MO + MO (weil 2 H2O!)
m(Na2HPO4) = n · M = 0,1mol/l · (23+23+1+31+16+16+16+16+1+1+1+1+16+16 g/mol) = 17,8g/l
=> für 100ml wird nur 1/10 verwendet: m = 1,78g
m(KH2PO4) = n · M = 0,158 mol/l · 39,1+1+1+31+16+16+16+16) = 21,5g/l
=> für 100ml wird nur 1/10 verwendet: m = 2,15g
Beide Salze werden abgewogen und dann zusammen in 100ml Wasser aufgelöst. Der Puffer kann dann mit pH-Papier überprüft werden.
Zusatzaufgabe:
1. Wie viel HCl muss nun in diesen Puffer hinzugegeben werden, damit er sich auf pH=6 absenkt? Die zur Verfügung stehende HCl hat eine Konzentration von 0,5mol/l.
Puffersysteme II: Der Blutpuffer
Im Blut liegt ein Kohlensäure/ Hydrogencarbonat-Puffersystem vor.
H2O + H2CO3 ⇌ H3O+ + HCO3–
Was passiert nun bei Zugabe von Lauge?
Die Hydroxidionen werden sowohl von den Kohlesäuremolekülen (a) als auch von den Oxoniumionen (b) neutralisiert:
(a) OH– + H2CO3 ⇌ H2O + HCO3–
(b) OH– + H3O+ ⇌ 2H2O
Was passiert bei Zugabe von Säure zum Gleichgewicht?
Die Oxoniumionen reagieren mit den Hydrogencarbonationen und zu Kohlensäure und Wasser.
H3O+ + HCO3– ⇌ H2O + H2CO3
=> Der pH-Wert einer Pufferlösung ändert sich bei der Zugabe einer Säure oder Base kaum.
Puffersysteme III: Der Essigsäure-Natriumsalz-Puffer

Säurezugabe:
Gleichgewicht: H2O + H3C-COOH ⇌ H3O+ + H3C-COO–
Allgemeine Form: H2O + HA H3O+ + A–
Die Acetationen fangen weitere H3O+-Ionen ab. Das Gleichgewicht weicht dem Zwang aus und reagiert zugunsten der Edukte Wasser und Säure => der pH-Wert ändert sich nicht.
Basenzugabe:
Gleichgewicht: H2O + H3C-COO– ⇌ OH– + H3C-COOH
Allgemeine Form H2O + B ⇌ OH– + BH+
Die zugegebenen OH– -Ionen der Base werden von der Essigsäure neutralisiert. Das Gleichgewicht reagiert zu den Edukten => der pH-Wert ändert sich nicht.
Weitere Puffer:
- Ammonium/ Ammoniak-Puffer
- Dihydrogenphosphat/ Hydrogenphospaht-Puffer
Aufgaben:
1. Das menschliche Blut löst unter anderem Kohlenstoffdioxid. Dadurch müsste es saurer werden. Dennoch schwankt der pH-Wert des Blutes kaum! Er liegt immer zwischen 7,35 und 7,45! Würde dieser Bereich unter- oder überschritten werden, fällt der Mensch ins Koma. Damit dies nicht passiert, liegt ein chemisches Gleichgewicht zwischen Kohlensäure und Wasser auf der einen Seite und Hydrogencarbonationen und Oxoniumionen auf der anderen Seite vor.
a) Formuliere das Massenwirkungsgesetz und die Gleichgewichtsreaktionsgleichung.
b) Stelle für diese Gleichgewichtsreaktion die Formel zur Berechnung des KS-Wertes auf.
c) Forme diese Gleichung nach der Oxoniumionenkonzentration um.
d) Entwickel für dieses spezielle Gleichgewicht, mit Hilfe dieser Gleichung, eine Formel zur Berechnung des pH-Wertes.
e) Welcher Teil Eurer neu aufgestellten Berechnungsformel ändert sich direkt bei Zugabe von Säure (bzw. Base)?
f) Wie stark wirkt sich diese Änderung auf den pH-Wert dieser Lösung aus? Bedenke dazu, welche mathematischen Ausdrücke in dieser Formel enthalten sind und wie sie sich auswirken.
2. Erkläre über die Reaktionsgleichung den allgemeinen Zusammenhang zwischen Kohlensäure und dem Hydrogencarbonation.
Formelspickzettel: Säure-Base-Reaktionen
Berechnung pH-Wert:
pH = - lg [H3O+] => [H3O+] = 10–pH
Berechnung pOH-Wert:
pOH = - lg [OH–] => [OH–] = 10–pOH
=> pH + pOH = 14
=> pOH = 14- pH
Berechnung Protolysegrad:
[H3O+]
α = —————
[HA]
Berechnung KS und KB
[H3O+] · [A–]
KS = k · [H2O] = —————————
[HA]
[OH–] · [HB+]
KB = k · [H2O] = —————————
[B]
Berechnung Säurestärke:
pKS = - lg (KS)
pKB = - lg (KB)
pKS + pKB = pKW = 14 (KS · KB = [H3O+] · [OH–] = KW = 10–14 mol2/l2)
pH-Wert Berechnung bei schwachen Säuren
pH = ½ (pKS - lg c0[HA])
pH-Wert Berechnung bei starken Säuren:
pH = - lg c0 (HA)
Titration:
nHCl = nNaOH
cSäure · VSäure = cLauge · Vlauge
Henderson-Hasselbalch-Gleichung:
[HA]
=> pH = pKS - lg ———
[A–]
Übungsaufgaben zu Protolysen, pH- und pK-Werten
1. Stelle die Protolysegleichungen mit vollständigen Strukturformeln der folgenden Reaktionen auf:
a) Fluorwasserstoff (=Flusssäure) + Chlorid
b) Wasser + Ammoniak
c) Salzsäure + Ammoniak
2. Vervollständige die korrespondierenden Säure-Base-Paare:
|
Säure |
H3PO4 |
HSO4– |
H2O |
NH3 |
H2O2 |
OH– |
||||||
|
Base |
HCO3– |
S2– |
(CO3)2– |
H2O |
Cl– |
HPO42– |
3. Welches der folgenden Moleküle ist ein Ampholyt. Begründe mit der Reaktionsgleichung:
HS–, H3O+, HPO42–, H2O, NH3, NH2–, H2CO3
4. Gibt man Aluminiumhydroxid in Wasser reagiert es alkalisch. Warum?
5. Natriumhydrogensulfat reagiert in Wasser sauer, Natriumhydrogencarbonat hingegen alkalisch. Stelle beide Reaktionsgleichungen auf und benenne alle Stoffe.
6. Wie lautet die Formel und wie heißen die Salze die beider Neutralisation der folgenden Reaktionen entstehen?
a) Salzsäure + Ammoniak
b) Phosphorsäure + Natronlauge
c) Salpetersäure + Calciumhydroxid
d) Fluorwasserstoffsäure + Kalilauge
e) Schwefelsäure + Ammoniak
f) Kohlensäure + Kalkwasser
7. Wie würdest Du das Salz Kupfersulfat aus den Elementen herstellen?
8. Welchen pH-Wert hat eine verdünnte Natriumhydroxidlösung mit der Konzentration c(OH–) = 0,0005 mol/l
9. Wie ist die Konzentration an Oxoniumionen einer verdünnten Natronlauge mit pH-Wert 10,6?
10. Eine recht konzentrierte Salzsäure wird mit pH-Wert 1,45 gemessen. Berechne die Konzentration an H3O+ und OH–.
11. Welchen pH-Wert zeigt eine verdünnte Schwefelsäure mit der Konzentration c=1,24·10–5 mol/l?
12. In Cola ist Phosphorsäure enthalten. Der pH-Wert beträgt ca. 4,8. Berechne die Konzentration.
13. Die Dissoziation des Wassers (Ionenprodukt) ist als Gleichgewichtsreaktion natürlich temperaturabhängig. Bei 0°C liegt ein pKW - Wert von 14,994 und bei 50°C ein pKW - Wert von 13,262 vor. Berechne zuerst die Konzentration an Oxoniumionen und daraus die pH-Werte.
14. Eine 0,1 molare Essigsäure hat den pH-Wert von 2,88. Propansäure der gleichen Konzentration hat den pH-Wert von 2,94.
a) Wie groß ist der Unterschied der Oxoniumionenkonzentration?
b) Bestimme beide pKS-Werte.
15. Berechne die Konzentration der Wassermoleküle in Wasser.
16. Warum ist in verdünnten Lösungen, die Konzentration der Wassermoleküle (auch bei unterschiedlichen Konzentrationen) annähernd gleich?
17. Füllt man 0,2 mol Propansäure mit Wasser auf einen Liter auf, so beträgt der pH-Wert 2,8. Berechne den pKS Wert der Propansäure.
18. Der pH-Wert einer Ammoniaklösung (c(NH3) = 0,7 mol/l) beträgt 11,5. Berechne den pKS-Wert
a) Formuliere für das Acetat-Ion (CH3COO)- die Protolyse mit Wasser (in Strukturformeln!) und stelle anschließend die Formel zur Berechnung der Basenkonstante auf.
b) Eine Natriumacetatlösung hat eine Konzentration von 0,1 mol/l. Der pH-Wert beträgt 8,8. Berechne den pKS-Wert der Acetationen.
19. Generell gilt: pKS+pKB =pKW. Leiten anhand des korrespondierenden Essigsäure/ Acetationen Säure-Base-Paars diese Beziehung her.
20. Eine verdünnte Essigsäure wird mit pH-Wert 2,6 gemessen. Der pKS-Wert ist 4,76. Berechne die Ausgangskonzentration c0 (CH3COOH).
Musterlösungen
8: [OH–] = 0,0005 mol/l => pOH = -lg (0,0005) = 3,3
da pH + pOH = 14 folgt daraus: 14 - pOH = pH => 14 - 3,3 = pH = 10,7
9. pH = 10,6 => - lg [H3O+] = 10,6 => [H3O+] = 10-10,6 mol/l = 2,5 ·10–11 mol/l
15. 1 mol Wasser wiegt 18g.
=> n = m/M = 1000g / 18 g/mol = 55,56 mol
In einem Liter Wasser sind 55,56 mol H2O enthalten.
16. 55,6 mol/l ist eine sehr, sehr hohe Stoffmenge an Wassermolekülen pro Liter Wasser. Ob da noch 1, 0,1 oder sogar nur 0,1 mol/l einer anderen Substanz dabei sind, spielt kaum eine Rolle, da sich praktisch nichts an der Konzentration verändert.
17. Formel zum Errechnen von pH/ pKs Werten der schwachen Säuren:
[Propansäure] = 0,2 mol/l
pH = 2,8
pH = 1/2 (pKs - log c) = 2,8 = 1/2 (pKs - log 0,2)
=> pKs = 4,88
22. Gegeben:
pH-Wert = 2,6
pKs = 4,75
=> Formel: pH= ½ (pKs-lg c(Essigsäure)) = 2,6=1/2(4,88-lg c(Essigsäure))
Kombinationsaufgaben Abitur: MWG / pH-Werte / Säurestärke/ Esther / Seifen
1. Erstelle Dir einen Formelzettel, wo alle Formeln zum Thema „pH, pKS, pKW usw.“ aufgeführt sind.
2. Säure-Base-Gleichgewichte:
Bei folgenden Säuren liegt eine Konzentration von 0,1mol/l vor. Folgende pH-Werte werden gemessen:
-
pH 2-Methylpropansäure = 2,93
-
pH Ethansäure = 2,88
-
pH Monochlorethansäure = 1,91
a) Erstelle die Reaktionsgleichung der Protolyse mit Wasser in Strukturformeln und stelle dann das MWG auf.
b) Nenne zwei Möglichkeiten das Gleichgewicht auf die Seite der Produkte zu verschieben. Erkläre an diesem Beispiel kurz das dahinter liegende Prinzip. Beachte dabei, dass eine Änderung der Temperatur oder des Druckes in diesem Fall nicht stattfinden darf!
c) Berechne den pKS-Wert der Ethansäure.
d) Ordne die drei Säuren begründet nach ihrer Säurestärke.
e) Zu Ethansäure wird etwas Ammoniak oder Natriumhydroxid zugefügt und anschließend unter Zugabe von Silbernitratlösung leicht erwärmt. Nach wenigen Minuten beobachtet man einen Silberspiegel auf der inneren Glaswand einen leichten Essiggeruch. Erstelle zu dieser Reaktion die passende Redoxreaktion mit Teilgleichungen.
3. Kondensationsreaktionen:
Salpetersäure kann mit Alkoholen zu Nitroverbindungen reagieren. Dabei reagieren die beiden Hydroxygruppen der beiden Verbindungen in einer Kondensationsreaktion. Ein bekanntes Beispiel einer solchen Kondensationsreaktion ist die Reaktion von einem Mol Glycerin (Propan-1,2,3-triol) mit drei Mol Salpetersäure. Dabei entsteht der Sprengstoff Nitroglycerin (Glycerintrinitrat).
Formulieren Sie die Reaktionsgleichung für die Herstellung von Nitroglycerin in Strukturformeln.
4. Iodwasserstoffgleichgewicht:
Wasserstoff und Iod reagieren zu Iodwasserstoff: H2 + I2 ⇋ 2 HI (K = 54,3)
a) Formuliere das Massenwirkungsgesetz für diese Reaktion.
b) Bestimme die Konzentration an Iodwasserstoff, die entsteht, wenn ein Kolben mit einem Volumen V = 1 Liter mit 0,1 mol Wasserstoff und 0,1 mol Iod gefüllt wird.
c) Berechne die Konzentration an Wasserstoff und Iod, die im Gleichgewicht vorliegen, wenn ebenfalls zum Start 0,1 mol Iodwasserstoff eingefüllt wurden.
5. Massenwirkungsgesetz:
Formuliere das Massenwirkungsgesetz für die folgenden Reaktionen:
a) CH4 + 2 O2 ⇋ CO2 + 2 H2O
b) 2 SO2 + O2 ⇋ 2 SO3
c) 3 H2O + H3PO4 ⇋ 3 H3O+ + (PO4)3−
d) H2O + HCl ⇋ H3O+ + Cl−
e) CH4 + NH3 ⇋ HCN + 3 H2
f) 2 H2O + H2SO4 ⇋ 2 H3O+ + (SO4)2−
6. Wiederholung zwischenmolekularer Kräfte:
Ordne die Moleküle a-c jeweils nach ihrem Siedepunkt und der Wasserlöslichkeit. Begründe jeweils anhand der zwischenmolekularen Kräfte:
a) CH3OH, CH3CH2OH, CH3CH2CH2OH
b) C2H6, CH3OH, CH2O
c) CH3CH2OH, CH3OCH3, HCOOCH3
7. Säure-Base-Puffer
Zu 20 ml Glycin-Wasser-Lösung (c = 0,1 mol/l) wird Natronlauge (c = 0,1 mol/l) zugefügt. Wie viel Milliliter Natronlauge müssen dazugeben werden, damit eine Pufferlösung mit pH = 9,8 entsteht?
(Glycin: pKS1 = 2,35, pKS2 = 9,8)
(A) 10 ml (B) 15 ml (C) 20 ml (D) 30 ml (E) 45 ml
8. Ethansäure reagiert mit Ethanol zu Wasser und Ethansäureethylester:
CH3COOH + C2H5OH ⇋ CH3COOC2H5 + H2O
a) Erstelle die Reaktionsgleichung in Strukturformeln.
b) Formuliere das Massenwirkungsgesetz.
b) Es reagieren beide Edukte mit einer Ausgangskonzentration von jeweils 1mol/l. Im Gleichgewicht liegt eine Konzentration von 0,8 mol/l Ester vor. Berechne die Gleichgewichtskonstante K.
c) Berechne die Konzentration an Ester, wenn die Startkonzentrationen 1 mol/l Säure und 4 mol/l Alkohol sind.
9. Bestimmung der Gleichgewichtskonstanten bei der Esterhydrolyse:
Es reagieren 10 mmol Ethansäuremethylester mit 10 ml Natronlauge (c= 1mol/l):
CH3COOCH3 + OH− ⇋ CH3COO− + CH3OH
Folgende Werte wurden gemessen:
|
1min |
2min |
3min |
4min |
5min |
10min |
15min |
|
|
[OH−] in mmol/ml |
8,5 |
7,2 |
6,3 |
5,6 |
5 |
3,6 |
3,2 |
|
[CH3COOCH3] in mmol/ml |
|||||||
|
[CH3COO−] in mmol/ml |
|||||||
|
[CH3OH] in mmol/ml |
a) Formuliere die Reaktionsgleichung in Strukturformeln
b) Berechne die fehlenden Konzentrationen und Erstelle ein Konzentrations-Zeit-Diagramm.
c) Bestimme die Konzentrationen der Edukte und Produkte im Gleichgewicht.
d) Bestimme die Gleichgewichtskonstante K
10. Verseifung und Fetthärtung:
a) Erstelle die Strukturformel eines Fetts, welches aus einem Molekül Hexadecansäure und zwei Molekülen cis,cis-Oktadeca-9,12-dien-säure besteht.
b) Dieses Fettmolekül wird nun mit Kalilauge verseift. Erstelle den vollständigen Reaktionsmechanismus.
c) Erkläre den Aufbau anionischer und kationischer Tenside mithilfe von Strukturformeln und nenne weitere Inhaltsstoffe von Waschmitteln (in Strukturformeln soweit möglich!) sowie deren Funktion.
Teillösung:
2)
c(H3O+) · c(Ac-)
KS = ———————————
c(HAc) · c(H2O)
Aus dem pH berechnet man die c(H3O+) (welche gleich der c(Ac-) ist)
c(H3O+) = 10 -2,88 = 0,0013 mol/l
c(HAc) = 0,1 mol/l
c(H3O+)2
KS = ————— = 0,0000174 bzw: 1,74 · 10-5 => pKS = 4,78
0,1 mol/l
7. Zu 20 ml Glycin-Wasser-Lösung (c = 0,1 mol/l) wird Natronlauge (c = 0,1 mol/l) zugefügt. Wie viel Milliliter Natronlauge müssen dazugeben werden, damit eine Pufferlösung mit pH = 9,8 entsteht?
(Glycin: pKS1 = 2,35, pKS2 = 9,8)
(A) 10 ml Lösung A ist richtig
Aufgabe zur Pufferkurvenanalyse
Titration einer schwachen Säure (Natriumhydrogencarbonat) mit einer starken Base (Natronlauge)
Versuch: Es liegen 10 ml einer 0,4 molaren Natrimhydrogencarbonatlösung vor. Dazu wird nun jeweils 1 ml Natronlauge hinzugetropt. Die gemessenen Werte sind unten in der Tabelle aufgeführt und bereits in das Diagramm eingetragen. Fülle die Tabelle aus und berechne die fehlenden Werte.
|
Zugabe an Base |
0 ml |
1 ml |
2 ml |
3 ml |
4 ml |
|
cBase |
0 mmol |
1 mmol |
|||
|
Crestliche Säure |
4 mmol |
3 mmol |
|||
|
VGesamt |
10 ml |
11 ml |
|||
|
Vorliegende Stoffe |
|||||
|
Anzuwendende Formel zur Berechnung des pH-Werts |
|||||
|
[Base] / [Säure] |
|||||
|
Log ([Base] / [Säure]) |
|||||
|
pH berechnet |
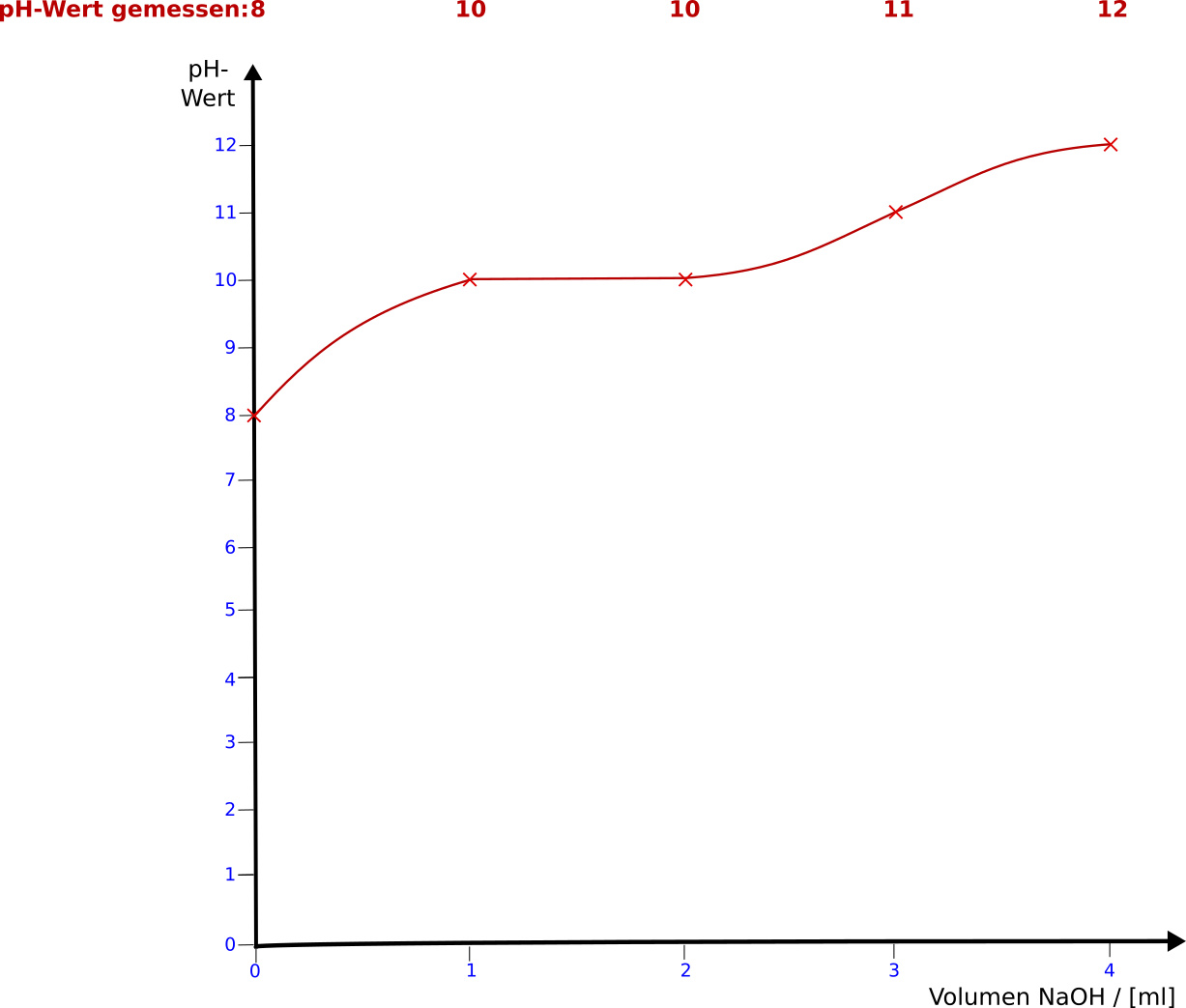
Titration NaHCO3 mit NaOH (Natriumhydrogencarbonat und Natronlauge)
Lösung:
|
Zugabe an Base |
0 ml |
1 ml |
2 ml |
3 ml |
4 ml |
|
cBase |
0 mmol |
1 mmol |
2 mmol |
3 mmol |
4 mmol |
|
Crestliche Säure |
4 mmol |
3 mmol |
2 mmol |
1 mmol |
0 mmol |
|
VGesamt |
10 ml |
11 ml |
12 ml |
13 ml |
14 ml |
|
Vorliegende Stoffe |
H2CO3 (HCO3)– |
(HCO3)– |
(HCO3)– |
(CO3)2– (HCO3)– |
(CO3)2– |
|
Anzuwendende Formel zur Berechnung des pH-Werts |
pH= ½ (pKs1+pKs2) |
pH= pKs + log([Base]/[Säure]) |
pH=pKs |
pH= pKs + log([Base]/[Säure]) |
14-½ (pKB + log([Base]) |
|
[Base] / [Säure] |
0 / 4 |
1 /3 |
2/2 |
3 / 1 |
4 / 0 |
|
Log ([Base] / [Säure]) |
- |
-0,48 |
0 |
0,48 |
- |
|
PH berechnet |
8,4 |
9,9 |
10,4 |
10,9 |
11,9 |
- Formel für schwache Säuren: pH= 1/2 (pKs-log[Säure])
- Formel für pH am Pufferpunkt: pH=pKs
- Formel für Puffergleichungen (Henderson Hasselbalch): pH= pKs + log([Base]/[Säure])
- Formel für amphotere Salze: pH= 1/2 (pKs1 + pKs2)
- Formel für schwache Basen: 14 - 1/2 (pKB + log([Base])
Bei 4ml muss die Formel der schwachen Base rein, weil: Hydroxid der Natronlauge ist komplett protoniert und die Säure ist komplett deprotoniert. Das heißt, die entstandene korrespondierende Base ist schwach => Formel für schwache Base!