Kapitel 20: Physikalische Chemie I - Grundlagen der Thermodynamik und des Energieumsatzes

Beim Schmelzen des Eises vergrößert sich die Entropie des Systems
Erinnerung - was ist eine chemische Reaktion?
Zu Beginn etwas rotes Feuer:
V: Kaliumchlorat, Zucker und Strontiumnitrat werden vermischt und mit etwas Schwefelsäure zur Reaktion gebracht.
B: rote Stichflamme.
S: Spontan ablaufende Reaktion.
Was sind die Grundlagen einer chemischen Reaktion?
Der Kennzeichen einer chemischen Reaktion:
Definition Mittelstufenunterricht:
„Bei chemischen Reaktionen finden eine Stoffumwandlung und eine Energieumwandlung statt“.
Definition Oberstufe:
Chemische Reaktionen erkennt man z.B. durch:
-
Elektronenübertragung (=> Redoxreaktionen, Elektrolysen)
-
Protonenübertragung (=> Protolyse, Säure-Base-Reaktion)
-
Spaltung von Stoffen (Cracken, Explosion z.B. TNT)
-
Umlagerung von Gitterbausteinen (z.B. monokliner - rhombischer Schwefel / Graphit - Diamant)
Beispiel: Fällungsreaktion von AgCl:
NaCl (aq) + AgNO3 (aq) ---> AgCl (s) ↓ + Na2NO3 (aq)
Bisher fand im Chemieunterricht vor allem eine Untersuchung der beteiligten Stoffe und der beteiligten Energie statt. Aber man kann eine Reaktion auch unter weiteren Aspekten betrachten.
In Zukunft werden Reaktionsgeschwindigkeiten ebenfalls beobachtet und analysiert.
Schnelle Reaktionen: Knallgasprobe, Ausfällung von AgCl
Langsame Reaktionen: Rosten von Eisen, alkoholische Gärung, Assimilation grüner Pflanzen
Physikalische Chemie
Bisher hat sich der Chemieunterricht immer sehr viel mit den Stoffumwandlungen auseinandergesetzt. Energetische Betrachtungen wurden z.B. bei Verbrennungen gemacht. Um nun bei chemischen Reaktionen genauer hinzuschauen und vor allem, um ein tieferes Verständnis zu erlangen, muss man energetische Aspekte nun genauer verstehen. Diese Art der Chemie wird physikalische Chemie genannt. Sie ist die dritte Teildisziplin neben der anorganischen und organischen Chemie. Die „physikalische Chemie“ beschäftigt sich mit Thermodynamik, Reaktionsgeschwindigkeit, Volumenarbeit, Aggregatzuständen und mit Lösungen und Lösungsvorgängen. Der gemeinsame Punkt all dieser Themen ist „Energie“.
Gasgesetzte der Thermodynamik
Gasgesetz von R. Boyle & E. Mariotte
R. Boyle & E. Mariotte entdeckten unabhängig voneinander die allgemeinen Gasgesetze:
V ~ 1/p
=> p · V = konstant
Gasgesetz von Gay-Lusac
Durch Einführung der absoluten Temperaturskala in Kelvin wurde damit folgende Aussage möglich (Gesetz von Gay-Lusac):
V ~ T
=> V/T = konstant
=> p · V / T = konstant
Gasgesetz von Avogadro
Durch Avogadro wurde die Stoffmenge eingeführt und er bestimmte, das bei verschiedenen Gasen bei gleichem Druck und gleicher Temperatur in gleichen Gasvolumina logischerweise auch die Stoffmenge gleich sein muss:
p · V / T = n · Konstante
Diese Konstante wurde als allgemeine Gaskonstante bestimmt (R):
Sie beträgt: R = 8,314 J/k·mol
=> das allgemeine Gasgesetz: p·V = n · R · T
Das allgemeine Gasgesetz gilt streng genommen nur für ideale Gase. Für reale Gase erhält man v.a. bei hohen Drücken stark abweichende Werte. Für Rechnungen in der Schule ist aber immer von idealen Gasen auszugehen!
Energie, Enthalpie, Entropie
a) Energieformen
Energie ist eine physikalische Größe mit der SI-Einheit Joule [J]. In geschlossenen Systemen ist sie unveränderlich (Energieerhaltungssatz)
Eine verbreitete (und veraltete) Definition: Fähigkeit eines Systems, Arbeit zu verrichten.
Man kann die Energie in sechs verschiedenen Energieformen einteilen:
1. Mechanische Energie (=Summe von kinetischer und potenzieller Energie)
-
Kinetische Energie (=Bewegungsenergie) - Ekin = ½ mv2
-
Potentielle Energie (=Lageenergie)
-
Schwingungsenergie (Schwingungen sind ein periodischer Wechsel zwischen zwei Energieformen. z.B. Pendel potentielle Energie wechselt bei maximaler Auslenkung mit der gleich großen kinetischen Energie während des Durchgangs durch die Ruhelage ab.)
-
Elastische Energie (bei elastisch deformierbaren Körpern)
-
Schallenergie
-
Wellenenergie (z. B. Wasserwellen, Stoßwellen und elektromagnetische Wellen)
2. Elektrische und magnetische Energie
-
Elektrische Energie
-
Magnetische Energie
3. Bindungsenergie
-
Chemische Energie (=Energie, welche in chemischen Bindungen zwischen Atomen bzw. Molekülen enthalten ist). Exotherme Reaktionen setzen diese zum Teil frei.
-
Kernenergie
4. Thermische Energie
Die thermische Energie ist in der ungeordneten Eigenbewegung der Atome bzw. Moleküle eines Stoffes gespeichert. Achtung: Der thermodynamische Begriff der „Wärme“ (Q) hat nichts mit der umgangssprachlichen Wärme/ Kälte zu tun. Vielmehr beschreibt er die über eine Systemgrenze hinweg transportierte thermische Energie (bzw. Wärmemenge).
5. Innere Energie
Die Summe aus thermischer Energie, Schwingungsenergie im Körper und Bindungsenergie bezeichnet man als Innere Energie.
6. Masse
Nach Einsteins spezieller Relativitätstheorie gilt für ein ruhendes Teilchen: E = mc2
Energiewandlung
Energie kann nicht erzeugt oder verbraucht werden! Dies ist nach dem Energieerhaltungssatz unmöglich. Sie kann aber in unterschiedliche Erscheinungsformen umgewandelt werden. So wandelt Bremsen beim Fahrrad die kinetische Energie in Wärmeenergie um. Eine Glühlampe wandelt elektrische Energie in Licht und Wärmeenergie um.
Es gibt aber Grenzen der Wandlung. Die Entropie ist ein Maß für die Wandlung der in einem geschlossenen System enthaltenen Energie. Solange sich die Entropie nicht (oder wenig ändert) sind Wandlungen leicht möglich.
Zusatzinformationen:
- https://de.wikipedia.org/wiki/Energiewandlung
- https://de.wikipedia.org/wiki/Portal:Energie
- https://de.wikipedia.org/wiki/Energie
Die „Triebkraft“ chemischer Reaktionen
Arten chemischer Systeme
Jede chemische Reaktion umfasst Stoffumsatz und Energieumsatz. Stoffaustausch ohne Energieaustausch ist nicht möglich! Die Energie kann dabei in unterschiedlichen Formen auftreten:
Wärmeenergie, Lichtenergie, elektrische Energie, mechanische Energie, innere Energie
Es werden immer nur Veränderungen in einem räumlich begrenzten Gebiet, dem System, betrachtet.
System: betrachteter Teil des „Universums“ (= Reaktionsraum)
Umgebung: Rest des „Universums“
Man unterscheidet drei Arten chemischer Systeme:
|
Art des chemischen Systems |
Beziehung zur Umgebung |
Beispiele |
|
offenes System |
Stoff- und Energieaustausch mit der Umgebung |
Reaktion im offenen Gefäß z.B.: Auto, Lebewesen |
|
geschlossenes System |
Energieaustausch mit der Umgebung, aber kein Stoffaustausch |
Reaktion im offenen Gefäß, wenn bei den herrschenden Bedingungen kein Stoff entweicht Durchführung einer Reaktion im fest verschlossenen Raum (z.B. Verschiebung des Gleichgewichts von NO2 und N2O4 im zugeschmolzenen Reagenzglas durch Erwärmen bzw. Abkühlen) z.B.: Weltraumkapsel |
|
abgeschlossenes System |
weder Energie- noch Stoffaustausch mit der Umgebung |
Durchführung einer Reaktion in einem Gefäß mit wärmeisolierenden Wänden (z.B. Auflösen eines Salzes in Wasser in einem Dewargefäß ohne Bildung gasförmiger Stoffe) z.B.: Universum |
Die innere Energie (U)
Die Summe aller Energien eines abgeschlossenen Systems bezeichnet man allgemein als innere Energie U. Der absolute Wert der inneren Energie lässt sich nicht bestimmen, da sich die innere Energie aus verschiedenen Energieformen zusammensetzt, deren Werte nur schwer festzustellen sind.
Der Zustand eines Systems hingegen lässt sich durch verschiedene Zustandsgrößen beschreiben:
z.B.: p, V, T, c, U
Größen, die nur vom Endzustand eines Teilchensystems abhängen, also nicht vom Weg, auf dem dieser Zustand erreicht wurde, heißen Zustandsgrößen.
Aufgaben:
- Was passiert mit der inneren Energie eines Systems bei einer Reaktion?
- Anfangs und Endzustand einer Reaktion sind verschieden. Was heißt das für die innere Energie?
- Gibt es verschiedene Wege den Endzustand zu erreichen?
Ein Vergleich zur Erklärung: 3 Möglichkeiten einen Felsblock zu Tal zu bringen:
1. Rolle: Ein anderer, gleich großer Steinblock oder ein Gegengewicht wird gehoben, Arbeit wird geleistet, kaum Wärme entwickelt oder verbraucht.
2. Zu Tal werfen: weniger oder gar keine Arbeit wird geleistet, aber Wärmeentwicklung, starke mechanische Verformung des Bodens.
3. Gleitbahn: weniger oder gar keine Arbeit wird geleistet, aber Wärmeentwicklung durch Reibung und geringe mechanische Verformung des Bodens

Beliebig viele unterschiedliche Wege sind denkbar.
=> unterschiedliche Arbeitsleistung und Wärmefreisetzung
=> Unterschiede im Wärmeaustausch und in der geleisteten Arbeit
Veränderung der inneren Energie eines Systems:
-
durch Wärmeaustausch mit der Umgebung
-
wenn es Arbeit an der Umgebung verrichtet (bzw. umgekehrt)
1. Hauptsatz der Thermodynamik:
Δ U = Δ Q + Δ W
Im abgeschlossenen System gilt: Δ U = 0
U = Innere Energie (eine Zustandsgröße). Es sind keine absoluten Werte messbar (das ist auch nicht notwendig, da Chemiker sich nur für Energieänderungen interessieren. Der Bezugspunkt ist folglich willkürlich).
d.h. Energie kann weder erzeugt noch vernichtet werden.
(=> Ausschluss eines Perpetuum mobile)
Enthalpie (H)
V: Zn wird mit HCl zur Reaktion gebracht. Das entstehende Gas wir damit einem Kolbenprober aufgefangen.
B: Gasentwicklung => Druck => Volumenarbeit
S: Volumenarbeit (bei p = konstant):
(1) ΔW = - p·ΔV
Die Summe der einem System von außen zugeführten Wärme ΔQ und der an ihm verrichteten Arbeit ΔW ist gleich der Zunahme der inneren Energie:
(2) ΔU = ΔQ + ΔW (erster Hauptsatz der Thermodynamik)
aus (1) und (2) folgt:
=> ΔU = ΔQ - p·ΔV
<=> ΔQ = ΔU + p·ΔV
=> Enthalpie: ΔH = ΔU + p·ΔV
Die Enthalpie H (früher auch Wärmeinhalt) eines thermodynamischen Systems ist die Summe aus der inneren Energie U des Systems und dem Produkt aus Druck p und Volumen V des Systems.
Die Reaktionswärme bei konstantem Druck heißt Enthalpie.
Energiebeteiligung bei chemischen Reaktionen - das Energiediagramm
Bei jeder chemischen Reaktion spielt die Umwandlung von Energie eine Rolle. Entweder wird Energie freigesetzt, die z.B. vorher in den Ausgangsstoffen enthalten war, oder Energie wird zum Ablauf der Reaktion benötigt und somit dem System entzogen.
a) Energiediagramm (exotherme Reaktion)

Energiediagramm, exotherme Reaktion
Aktivierungsenthalpie (ΔHA), Energie, welche notwendig zum Auslösen der Reaktion ist. Reaktionsenthalpie (ΔHR), Energieüberschuss, der bei exothermen Reaktionen frei wird. Gesamt freiwerdende Energie (ΔHG)
Chemische Reaktionen, die unter Energieabgabe ablaufen, heißen exotherme Reaktionen. Die freiwerdende Energie kann dabei als Wärme, Licht oder in anderen Formen freigesetzt werden. Sie wird auch als Reaktionsenthalpie (ΔH) bezeichnet.
ΔHR < 0 => Produkte energieärmer als Edukte
b) Energiediagramm (endotherme Reaktion)
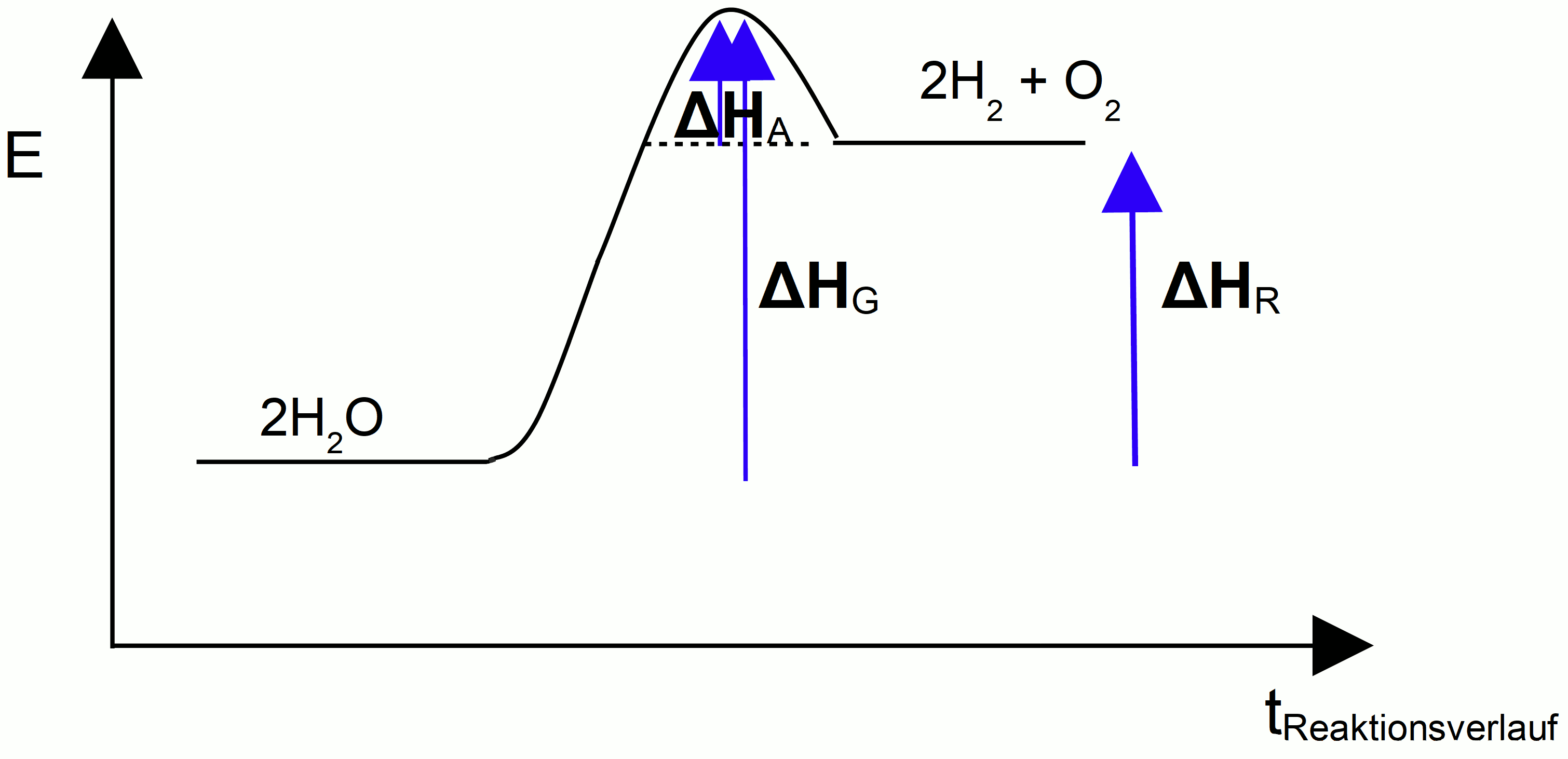
Energiediagramm, endotherme Reaktion
Chemische Reaktionen, bei denen ständig Energie zugeführt werden muss, damit sie überhaupt ablaufen, nennt man endotherme Reaktionen.
ΔHR > 0 => Produkte energiereicher als Edukte
Vorsicht: übliche Vorstellung: Prinzip des Energieminnimums!
Chemische Reaktionen laufen dann freiwillig ab, wenn dabei Enthalpie frei wird. V: Ammoniumthiocyanat + Bariumhydroxid mischen
B: Temperatur sinkt von 20oC auf -15oC ab S: Reaktion ist endotherm, läuft aber trotzdem freiwillig ab. Es liegt also ein Widerspruch zur üblichen Vorstellung vor!
2NH4SCN + Ba(OH)2 ---> Ba(SCN)2 + 2NH3 + 2H2O
Überlege: Müsste bei einer Katalyse nicht der EA Berg kleiner sein, da die Reaktion schneller läuft?
Entropie S - ein Maß für die Unordnung von Teilchen
Unordnung; Entropie (Standard- und Reaktionsentropie):
1850 führte Rudolf Clausius eine neue thermodynamische Größe ein, welche dieses Problem erklären konnte. Diese Größe beschreibt den Unordnungszustand eines chemischen Systems. Er nannte diese Größe „Entropie“ (S) [griechisch: en tropos = im Wechsel]. Er definierte: Liegt in einem System eine große Unordnung der Teilchen vor (z.B. bei gasförmigen Systemen), dann ist der Zahlenwert der Entropie groß!

Geordnete Systeme, z.B. Reaktionen, bei denen Feststoffe (z.B. Ionengitter) entstehen, haben eine geringe Entropie.
Der Lösungsvorgang eines Natriumchlorid-Salzkristalls in Wasser kann die Entropie veranschaulichen:
Der NaCl-Salzkristall hat als Feststoff einen sehr hohen Ordnungsgrad, die Ionen (Na+ und Cl–) liegen im Ionengitter abwechselnd angeordnet vor.
Gelangt der Kristall in ein mit Wasser gefülltes Gefäß, so kommt es zu einer Interaktion der Ionen mit den Wassermolekülen. Diese „drängeln“ sich in die Zwischenräume und lösen Ionen heraus. Dieser Schritt ist endotherm, da die Gitterenergie überwunden werden muss!
Die dazu notwendige Energie kommt aus dem Wasser, da dieses ja eine Temperatur von ca. 293K hat. Als Folge kühlt sich das Wasser ab! Die Wassermoleküle ordnen sich dann um die Ionen an und bilden eine Hydrathülle. Dabei wird etwas Energie freigesetzt.
Aber warum läuft das Lösen nun überhaupt ab, wenn der erste Schritt endotherm ist?
Ganz einfach ;-)
Gelöst liegen die Ionen viel ungeordneter als im festen Kristall vor. Der Unordnungsgrad nimmt zu, die Entropie bekommt einen höheren Wert, sodass der Term „T · ΔS“ größer wird. Dadurch wird mehr von positiven Wert ΔH abgezogen (die Reaktion ist ja endotherm) und somit wird ΔG negativ. Das Lösen von NaCl ist also ein exergonischer Vorgang. Er läuft spontan ab.
ΔG = ΔH - T · ΔS (zur Erklärung siehe nächste Seiten)
Weitere Beispiele:
- Trocknen von gefrorener Wäsche im Winter
- Verdunsten von Wasser oder Benzin
- Kälte beim Auflösen von Salzen
Was haben alle diese Reaktionen gemeinsam?
Die „Unordnung“ (Entropie, siehe nächste Seite) der Teilchen nimmt zu.
=> Zunahme der „Unordnung“ führt zu freiwillig ablaufenden endothermen Reaktionen
=> Prinzip der maximalen Unordnung
Die Freiwilligkeit einer Reaktion ist abhängig vom Prinzip des Energieminnimums sowie vom Prinzip der maximalen Unordnung!
2. Hauptsatz der Thermodynamik
ΔS > 0: Jedes System, das sich selbst überlassen wird, strebt nach einem Zustand größter Wahrscheinlichkeiten. D.h. die Entropie der Welt strebt einem Maximum zu.
Der 2. Hauptsatz wäre ein geeignetes Kriterium für den spontanen Ablauf einer Reaktion (Entropie!) - aber: Anwendung sehr unbequem. Die Entropieänderung der reagierenden Substanzen und der Umgebung müsste untersucht werden. Beschränkung auf den Vorgang selbst wäre wünschenswert. Die Freie Enthalpie ist dafür eine Lösung:
Betrachtet man natürliche Systeme, so fällt auf, dass nicht jede exotherem Reaktion auch spontan abläuft. Außerdem gibt es auch endotherme Reaktionen, die von alleine ablaufen! (z.B. lösen sich manche Salze in Wasser unter Abkühlung auf:
NH4Cl (s) ---> NH4+ + Cl– ΔH = 15 kJ/mol
Folglich muss es neben der Reaktionsenthalpie weitere Ursache geben, welche einen Einfluss auf die spontane Umsetzung bei Reaktionen haben!
Konsequenzen:
Daraus ergibt sich nun eine Reihe Konsequenzen für die zukünftige Betrachtung der Chemie:
1. Der Wert der Entropie ist ein Indikator für die Stabilität eines chemischen Systems: Je größer der Zahlenwert der Entropie ist, desto weniger spontane Änderungen sind möglich und desto stabiler ist das chemische System!
2. Die Entropie ist für Chemiker vor allem als Zustandsgröße interessant. Absolute Beträge interessieren uns eigentlich kaum:
ΔS = S Endzustand - S Anfangszustand
=> Die Entropie wird nicht absolut gemessen, sondern nur die Differenz von Reaktionsbeginn zu Reaktionende.
3. Die Maßeinheit ist kJ/mol.
4. Bei spontan ablaufenden Reaktion steigt die Entropie in der Regel an (d.h. keine Reaktion wird ablaufen, bei der sich die Stoffe von selbst in geordnetere Zustände begeben.
5. Nimmt in einer Reaktion die Entropie ab, muss sie an anderer Stelle zunehmen!
6. Nach Clausius strebt das Universum einem endgültigen Gleichgewichtszustand entgegen, an dem die Entropie ihren höchsten Wert erreicht hat und keine spontanen Reaktionen mehr ablaufen können. Dies dürfte das Ende des Universums sein... warten wir es ab, ob er Recht hatte...
=> Wärmetod des Universums... bedauerlich, dauert aber noch!
Zusatzinformationen:
- https://de.wikipedia.org/wiki/Rudolf_Clausius
- https://de.wikipedia.org/wiki/Entropie_%28Thermodynamik%29
Die freie Enthalpie G (= Gibbs´sche Energie)
Das freiwillige Ablaufen einer chemischen Reaktion wird durch die Gibbs-Helmholtz-Gleichung vorausgesagt. Diese Gleichung bestimmt die freie Enthalpie (ΔG), welche nicht mit der Reaktionsenthalpie (ΔH) verwechselt werden sollte.
Gibbs und Helmholtz gelang die Kombination des 1. und 2. Hauptsatzes der Thermodynamik:
ΔG = ΔH - T · ΔS
ΔS gibt in dieser Gleichung übrigens die natürliche „Unordnung“ an, die Entropie.
H ist die (dir schon lange bekannte) Reaktionenthalpie (exotherm oder endotherm).
T ist die Temperatur in Kelvin angegeben.
Die Freie Enthalpie (= Freie Energie) ist die Energie, die maximal als nutzbringende Arbeit bei einer chemischen Reaktion gewonnen werden kann.
Das Vorzeichen von ΔG (freie Enthalpie) zeigt die „Triebkraft“ einer Reaktion. Je größer der negative Betrag (also je kleiner der Wert) ist, desto größer ist die Triebkraft der Reaktion.
Wenn ΔG < 0 ist, kann die Reaktion freiwillig ablaufen. Solche Reaktionen nennt man exergonisch.
Dies ist besonders bei exothermen Reaktionen der Fall, da sie einen negativen Wert für ΔH haben und somit der Wert für ΔG in der Regel negativ wird (siehe unten).
Endergonische Reaktionen hingegen laufen nicht freiwillig ab.
Merke:
-
ΔG < 0 => (ΔG negativ) exergonische Reaktion, freiwilliger Verlauf.
-
ΔG = 0 => Reaktion ist im Gleichgewicht, keine Triebkraft.
-
ΔG > 0 => endergonische Reaktion, kein Verlauf ohne Zwang (z.B. permanente Energiezufuhr). Die Rückreaktion hingegen ist freiwillig. (ΔS = S Endzustand - S Anfangszustand)
Beispiele für das Zusammenspiel von ΔH und ΔS:
ΔG = ΔH - TΔS
Welche Bedingungen müssen vorliegen, damit ΔG möglichst klein ist, sodass die Reaktion freiwillig abläuft?
-
Die Enthalpie wird innerhalb der Reaktion negativer, sodass der Wert ΔH negativ wird (exotherme Reaktion)
-
Die Entropie sollte zunehmen. Je höher der Wert ist, desto positiver wird ΔS.
Während die Temperatur für alle Reaktionen variabel ist, so sind ΔH und ΔS für jede Reaktion fest und unveränderbar. Vier Fälle lassen sich für Vorhersagen unterscheiden:
Eindeutige (einfach zu treffende) Vorhersagen:
|
1. |
ΔH > 0 |
und ΔS < 0 |
=> |
Reaktion ist immer endergonisch |
|
|
endotherm |
und Entropieabnahme |
|
|
|
|
|
|
|
|
|
2. |
ΔH < 0 |
und ΔS > 0 |
=> |
Reaktion ist immer exergonisch |
|
|
exotherm |
und Entropiezunahme |
|
|
Vorhersagen schwierig:
|
1. |
ΔH > 0 |
und ΔS > 0 |
=> |
Ob die Reaktion endergonisch oder exergonisch ist, hängt nun vor der Temperatur, bei der die Reaktion stattfindet, ab. |
|
|
endotherm |
und Entropiezunahme |
|
|
|
|
|
|
|
|
|
2. |
ΔH < 0 |
und ΔS < 0 |
=> |
Ob die Reaktion endergonisch oder exergonisch ist, hängt nun vor der Temperatur, bei der die Reaktion stattfindet, ab. |
|
|
exotherm |
und Entropieabnahme |
|
|
Die Umgebungstemperatur bzw. die zugeführte Temperatur spielt bei diesen Fällen eine entscheidende Rolle
Beachte:
-
ΔG hängt nicht nur von den beteiligten Stoffen ab, sondern auch von den Reaktionsbedingungen (Konzentration, Temperatur, pH-Wert usw.)
-
ΔG° = Freie Enthalpie im Standardzustand: alle Konzentrationen 1 mol/l, 25°C
-
ΔG°´ für pH 7 (in lebenden Geweben)
Zusatzinformationen:
- https://de.wikipedia.org/wiki/Freie_Enthalpie
- https://de.wikipedia.org/wiki/Enthalpie
- https://de.wikipedia.org/wiki/Gibbs-Helmholtz-Gleichung
- https://de.wikipedia.org/wiki/Reaktionsenthalpie
- https://de.wikipedia.org/wiki/Normalbedingungen
- https://de.wikipedia.org/wiki/Standardbedingungen
Reaktionskinetik: Mathematische Betrachtungen
Chemische Reaktionen laufen nur dann freiwillig (spontan) ab, wenn die freie Reaktionsenthalpie einen negativen Wert aufweist: ΔG < 0
ΔG = ΔH – T · ΔS
Um solche freien Enthalpien zu berechnen, bezieht man sich in der Regel auf den Standardzustand (c = 1mol/l, T = 25°C also 298,15K, p=1013 hPa)
Die freie Standardenthalpie wird mit einer 0 gekennzeichnet: ΔG0
ΔG = ΔG0 + R · T · lnK
K= Gleichgewichtskonstante
R = 8,314 J/k·mol (allgemeine Gaskonstante)
Die freie Reaktionsenthalpie ist keine konstante Größe! Ihr Wert nimmt bei einer Reaktion ab, bis sie das Minimum von 0 erreicht:
Dann gilt: 0 = ΔG0 + R · T · lnK
=> -ΔG0 = R · T · lnK
Der natürliche Logarithmus der Gleichgewichtskonstanten ist somit der freien Enthalpie direkt proportional.
Änderung der freien Enthalpie beim Ablauf von Gleichgewichtsreaktionen:
Bei Gleichgewichtsreaktionen gilt fast immer, dass eine Reaktion freiwillig abläuft und die Rückreaktion nicht. Für dieses Beispiel definieren wir:
- Hinreaktion: freiwillig
- Rückreaktion: unfreiwillig
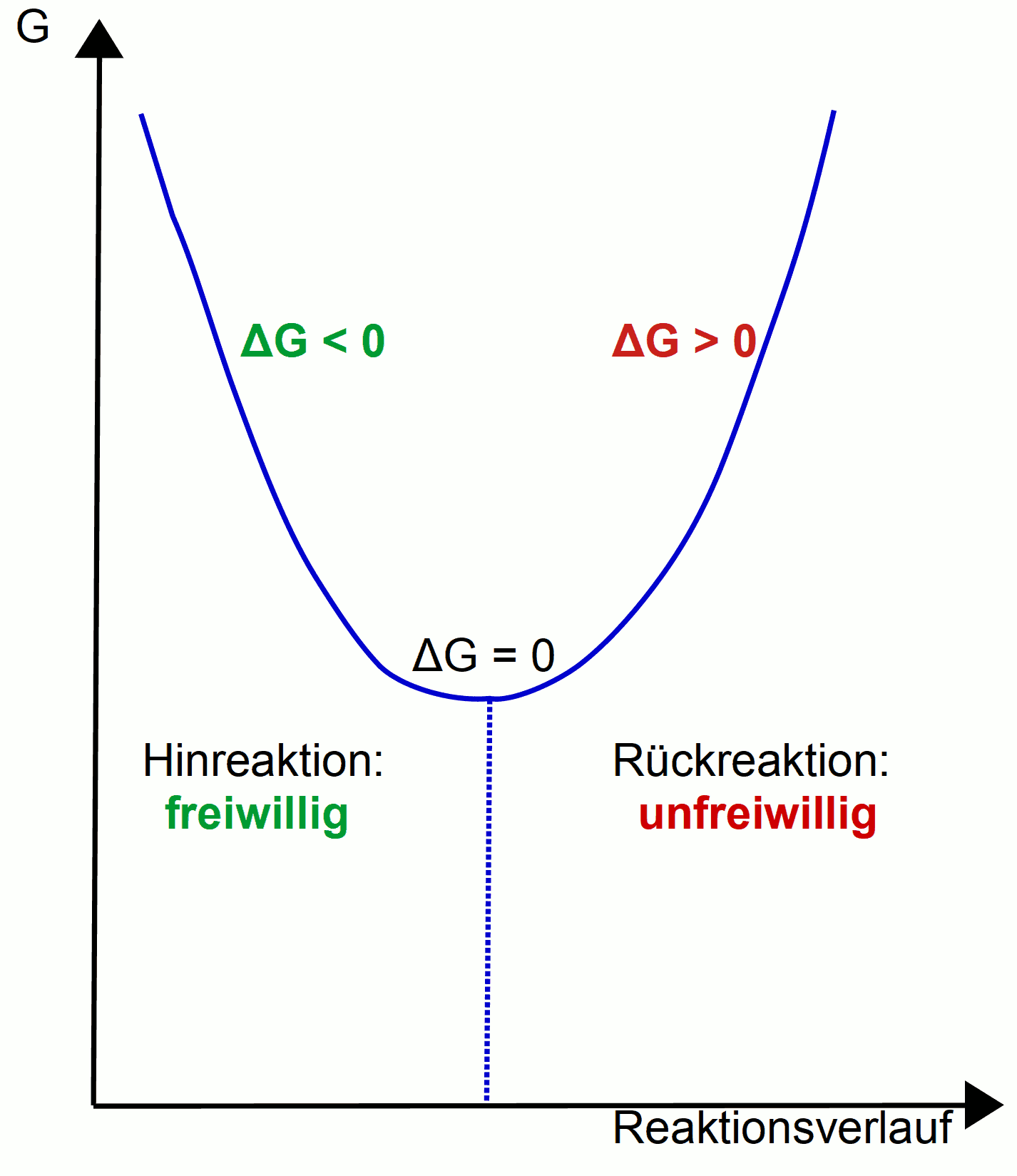
Freie Enthalpie bei Gleichgewichtsreaktionen (Gibb'sche freie Enthalpie)
Vorhersagen über spontan ablaufende Reaktionen
Beispiel: bei einer Reaktion bilden zwei Gase einen Feststoff, die Reaktion ist exotherm:
A(g) + B (g) ---> C(s) ΔH < 0
Berechnung von ΔH und ΔS
ΔH Reaktion = ΔH Produkte - ΔH Edukte
ΔS Reaktion = ΔS Produkte - ΔS Edukte
Vorhersage
Die Entropie wird sich in der Reaktion verringern,da die ursprünglich vorhandenen Gase mehr Platz benötigen als der entstehende Feststoff und somit die „Unordnung“ im System abnimmt. Der Wert der Entropie bekommt somit ein negatives Vorzeichen.
=> ΔS Reaktion = ΔS Produkte - ΔS Edukte => ΔS < 0
Setzt man diesen negativen Wert in die Gleichung (ΔG = ΔH - T ΔS) ein, dann ist also ΔS negativ und somit der ganze rechte Term (ΔS multipliziert mit der Temperatur) auch. Dieser negative Wert wird von der Reaktionsenthalpie subtrahiert (also im Grunde addiert, da zwei negative Vorzeichen vorliegen: subtrahieren einer negativen Zahl = addieren!). Somit wird ΔG nur dann <0 sein, wenn die Reaktion stark exotherm ist oder die Temperatur sehr gering ist)
Eselsbrücke: Ein geordneter Endzustand bedeutet eine negatives ΔS.
Es gilt also vereinfacht:
-
Wenn ΔS positiv ist und ΔH negativ ist, läuft eine Reaktion spontan ab.
-
Wenn ΔS positiv ist und ΔH positiv, läuft eine Reaktion spontan bei hohen Temperaturen ab.
-
Wenn ΔS negativ ist und ΔH negativ ist, läuft eine Reaktion bei geringen Temperaturen spontan ab, solange sie exotherm ist
-
Wenn ΔS negativ ist und ΔH positiv, dann läuft die Reaktion niemals spontan ab, aber die Umkehrreaktion bestimmt!
Zusatzinformationen: https://de.wikipedia.org/wiki/Entropie_%28Thermodynamik%29
Energetische Betrachtung der Verbrennung von Glucose
Die Oxidation der Glucose:
C6H12O6 (s) + 6O2 (g) ---> 6CO2 + 6 H2O ΔH0 = - 2808 kJ/mol
Verbrennt man 1 Mol Glucose (=180g) bei 298K, dann wird eine Wärmemenge von 2808 kJ freigesetzt.
=> 1kg Glucose entspricht -15600 kJ
Dabei ist es egal, ob die Oxidation der Glucose in einem Schritt stattfindet (z.B. bei einer Verbrennung), oder in mehreren Einzelschritten, wie bei der Zellatmung. Die freiwerdende Energie bleibt gleich!
Der Satz von Hess:
Die Standardenthalpie einer Reaktion ist gleich der Summe der Standardenthalpien
einer Folge von Reaktionen, in die die betreffende Reaktion formal zerlegt werden kann.
Das bedeutet, das Standardenthalpien bei umfangreichen und komplexen chemischen Reaktionen leicht durch geeignete Kombinationen der Enthalpien einfacher Teilreaktionen auszurechnen sind.
Dabei gilt: Die Teilreaktionen müssen im Labor nicht unbedingt praktisch realisierbar sein. Genauso können hypothetische Reaktionen vorliegen. Solange die Reaktionsgleichungen korrekt ausgeglichen sind, gilt der Satz von Hess!
Der thermodynamische Hintergrund ist der 1. Hauptsatz der Thermodynamik: Da die Enthalpie eine Zustandsfunktion ist und ihr Wert damit wegunabhängig ist, gilt der Satz von Hess solange Edukte und Produkte der Bruttoreaktion gleich bleiben.
Energetische Kopplung in der Natur
Lebewesen sind hoch geordnete Organismen, welche demzufolge die Notwendigkeit einer äußeren Energiequelle zur Aufrechterhaltung des Ordnungszustandes haben. Nur so können sie der Zunahme an Entropie entgegenwirken. => endergonische Synthesen benötigen Energie aus anderen chemischen Systemen. => Kopplung exergonischer und endergonischer Reaktionen.
Voraussetzung für Energieübertragung:
- Übertragung von Reaktionswärme ---> zeitgleicher Ablauf nötig
- Kopplung über ein gemeinsames Zwischenprodukt
Stoff tritt in einer chemischen Reaktion als Produkt auftritt in einer zweiten Reaktion als Ausgangsstoff: A + B ---> C + D D + E ---> F + G Ein solcher Stoff ist Adenosintriphosphat (ATP). Es ist in der Natur bei allen Lebewesen das wichtigste energieliefernde Zwischenprodukt bei biochemischen Reaktionen!
Dabei kann ATP zu ADP und Phosphat reagieren. Diese Reaktion ist umkehrbar. Das Phosphat kann bei der Bildung von einem Stoff (hier X) abgegeben werden. Bei der Reaktion zu ADP wird dann die Energie frei, die notwenidig ist einen zweiten Stoff (hier Y) mit Phosphat zu verbinden. X-P + ADP ---> X + ATP ATP+ Y ---> ADP + Y-P Beispiel:

Das ATP-System wirkt als:
- Energieüberträger
- Energiespeicher
Strukturelle Gründe für das hohe Gruppenübertragungspotential des ATP:
-
Elektrostatische Abstoßung zwischen den negativen Ladungen der Phosphatgruppen (vergl. Feder)
-
Größere Resonanzstabilisierung des Phosphats gegenüber ATP.
ATP besitzt ein hohes Gruppenübertragungspotential für Phosphatgruppen, d.h. das terminale Phosphat wird abgespalten, wann immer es möglich ist (Übertragung auf einen geeigneten Akzeptor)
Gruppenübertragungspotential:
Änderung der Freien Energie bei der Übertragung einer Gruppe auf den Standardakzeptor Wasser (unter Standardreaktionsbedingungen)
Ade-Rib-P~P~P + H2O ---> Ade-Rib-P~P + P ΔG° = - 29 kJ/mol
Wiederholungsaufgaben zum Thema „Reaktionskinetik“
-
Nenne Kennzeichen chemischer Reaktionen.
-
Welche Aussagen kann ein Energiediagramm treffen?
-
Erstelle für jeweils frei gewählte Reaktionen ein exothermes und ein endothermes Energiediagramm
-
Wie unterscheiden sich Standard- und Normalbedingungen?
-
Was versteht man unter Gibb‘scher freier Enthalpie und unter Entropie?
Standardbildungsenthalpien
Siehe: https://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_Enthalpie_und_Bindungsenergie