Kapitel 04: Säuren und Laugen

Zitronen enthalten Zitronensäure, diese verleiht den sauren Geschmack
Säuren und Laugen
Informationen zu Säuren und Laugen
- Die erste Säure, die man schon im Altertum kannte, war Essig. Im Mittelalter waren weitere Säuren bekannt (z.B. Salz-, Salpeter- und Schwefelsäure).
- Zitronensäure und Essigsäure kann man am Geruch erkennen.
- Die Wirkung der Säuren: Säuren ätzen! Sie greifen besonders unedle Metalle und Kalk an. Aber auch Kleidung und die Haut sind bei Kontakt in Gefahr, z.B. greift Phosphorsäure, die in Coca Cola enthalten ist, Fleisch an.
- Die „Gegenspieler der Säuren“ sind die Laugen. Sie sind ätzend und greifen viele andere Stoffe an, die Säuren nicht unbedingt angreifen. (z.B. Haare, Haut und Fett).
- Natriumhydroxid und Kaliumhydroxid sind bekannte Laugen.
- Laugen sind genauso gefährlich, nur etwas unbekannter als Säuren. Sie greifen viele natürliche Stoffe an, aber nicht Metalle. Deshalb entfernen sie als z.B. „Abflussfrei“ auch Haare und Fette, aber schädigen die Rohre nicht.
- Säure und Laugen kann man verdünnen. Gibt man zu Säure die gleiche Menge Wasser hinzu, so ist die Wirkung deutlich schwächer.
- Vorsicht! Verätzungen können immer passieren. Am besten ist es, die Stelle sofort mit Wasser abzuspülen. Augen gut auswaschen! Verätzte Kleidung muss entfernt werden.
- Laugen liegen oft als Feststoff vor, den man noch in Wasser auflösen muss.
- Es ist ein weit verbreitetes Vorurteil, dass Säuren und Laugen immer Flüssigkeiten sind.
Wahr ist vielmehr, dass es auch bei Raumtemperatur feste und gasförmige Säuren gibt.
Ein bekannter Vertreter einer festen Säure ist das Vitamin C Pulver (Vorsicht, es greift die Zähne an, wenn es nicht mit viel Wasser verdünnt ist). Eine typisch gasförmige Säure ist die Kohlensäure. - Ob ein Stoff eine Säure oder eine Lauge ist, kann man ihm nicht ansehen. Geschmacksproben sind im Labor ebenfalls nicht möglich. Außerdem möchte man nicht alles in den Mund nehmen!
=> Wir brauchen ein Hilfsmittel zur Unterscheidung und auch zum Nachweisen von Säuren und Laugen
Der Mensch kann den Säuregrad einer verdünnten Lösung nicht wahrnehmen, deshalb brauchen wir im Labor ein Hilfsmittel um sie zu erkennen
=> Indikatoren helfen uns Säuren und Laugen zu erkennen.
Indikatoren
Indikatoren sind Farbstoffe, die in Säuren und Laugen ihre Farbe verändern und uns so zeigen, ob eine Flüssigkeit sauer (durch Säure), neutral oder alkalisch (durch Lauge) reagiert.
In der Schule wird meist nur Universalindikator benutzt, wobei auch Lackmus und Phenolphtalein hin und wieder zum Einsatz kommen.
|
+ Säure (sauer) |
neutral |
+ Lauge (alkalisch) |
|
|
Universalindikator |
rot |
grün |
türkis |
|
Lackmus |
rot-orange |
rotviolett |
blauviolett |
|
Phenolphtalein |
weißer Niederschlag |
wasserklar |
rotviolett |
|
Bromthymolblau |
gelb |
grünlich |
blau |
|
Methylorange |
rot |
gelborange |
orange |
|
Blaukrautsaft |
rötlich |
blau |
gelb-grün |
Es gibt auch Papierstreifen, welche mit Universalindikator getränkt wurden - sie heißen pH-Papier. Es misst sehr genau - so genau, dass jeder möglichen Farbe eine Zahl zugeordnet ist - diese heißt auch pH-Wert.
Zusatzinformationen: https://de.wikipedia.org/wiki/Indikator_%28Chemie%29
Säure- und Laugenformeln
Bei Säuren wird das Wasserstoffatom rot gefärbt ( => Säuren haben den sauren Wasserstoff).
Bei Laugen wird die Hydroxidgruppe blau gefärbt (=> Laugen sind wässrige Hydroxidlösungen).
Hier sind die wichtigsten Säuren und ihre Säurereste (für Klasse 7 und 8 gilt, dass die Säurereste noch ohne ihre Ladungen gelernt werden!):
|
Die wichtigsten Säuren und ihre Säurereste |
|
Säure: |
Säurerest: |
||
|
HF |
Fluorwasserstoffsäure |
F |
Fluorid |
|
HCl |
Chlorwasserstoffsäure |
Cl |
Chlorid |
|
HBr |
Bromwasserstoffsäure |
Br |
Bromid |
|
HI |
Iodwasserstoffsäure |
I |
Iodid |
|
H2S |
Schwefelwasserstoff(säure) |
S |
Sulfid |
|
HNO3 |
Salpetersäure |
NO3 |
Nitrat |
|
H2SO4 |
Schwefelsäure |
SO4 |
Sulfat |
|
H2CO3 |
Kohlensäure |
CO3 |
Carbonat |
|
H3PO4 |
Phosphorsäure |
PO4 |
Phosphat |
|
HNO2 |
Salpetrigesäure |
NO2 |
Nitrit |
|
H2SO3 |
Schwefeligesäure |
SO3 |
Sulfit |
|
H3PO3 |
Phosphorigesäure |
PO3 |
Phosphit |
|
Die wichtigsten Laugen |
|
Lauge: |
|
|
NaOH |
Natronlauge |
|
KOH |
Kalilauge |
|
Ca(OH)2 |
Calciumlauge (=Kalkwasser) |
|
Ba(OH)2 |
Bariumlauge (=Barytwasser) |
Wichtige Tipps und Hinweise:
Chlorwasserstoffsäure nennt man in Wasser gelöst auch Salzsäure
Laugen sind wässrige Hydroxidlösungen
Natriumlauge = Natronlauge = Natriumhydroxid
Kaliumlauge = Kalilauge = Kaliumhydroxid
Definitionen nach Svante Arrhenius (1859-1927):
Arrhenius wurde am 19. 2.1859 in Uppsala geboren und ist am 2.10.1927 in Stockholm gestorben. Der schwedische Physiker und Chemiker forschte auf dem Gebiet der elektrolytischen Dissoziation (z.B. dem Zerfall von Salzen und Säuren in Wasser). In seiner Doktorarbeit beschäftigte sich mit der Leitfähigkeit von Salz- und Säurelösungen. Sie wurde jedoch wegen der vielen neuen Ideen der damaligen Zeit bei anderen Chemikern nicht anerkannt. Erst als der Chemiker Ostwald sich positiv dazu äußerte, wurde der Wert seiner Forschungen erkannt.
Er erforschte auch der Einfluss von des Kohlenstoffdioxids für das Klima der Erde und untersuchte als erster den Treibhauseffekt. 1903 erhielt Svante Arrhenius als erster Schwede den Nobelpreis für Chemie.
Quelle Bild: public domain - https://de.wikipedia.org/wiki/Bild:Arrhenius2.jpg -Danke an Matthias Bock
Er stellte für Säuren folgende Definition auf:
Die wässrigen Lösungen von Hydroxiden bezeichnet man als Laugen.
Eine Säure ist ein Stoff, der in wässriger Lösung Wasserstoffionen bildet.
(In der 7. und 8. Klasse nennen wir „Wasserstoffionen“ besser „sauren Wasserstoff“).
Zusatzinformationen und Bilder: https://de.wikipedia.org/wiki/Svante_Arrhenius
Aufgaben:
1. Treffe eine Vorhersage über die zu erwartende Farbe, wenn man die saure Universalindikatorlösung mit der neutralen Universalindikatorlösung zusammenkippt.
2. Lies im Internet über die Eigenschaften und die Verwendung der wichtigsten Säuren (Salzsäure, Schwefelsäure, Phosphorsäure und Zitronensäure) nach. Passende Links findest Du in den unten aufgeführten Zusatzinformationen.
Zusatzinformationen:
Schwefelsäure: https://de.wikipedia.org/wiki/Schwefelsäure
Salzsäure: https://de.wikipedia.org/wiki/Salzsäure
Phosphorsäure: https://de.wikipedia.org/wiki/Phosphorsäure
Salpetersäure: https://de.wikipedia.org/wiki/Salpetersäure
Kohlensäure: https://de.wikipedia.org/wiki/Kohlensäure
Zitronensäure: https://de.wikipedia.org/wiki/Zitronensäure
Essigsäure: https://de.wikipedia.org/wiki/Kohlensäure
Laugen
Laugen ätzen und sind in konzentrierter Form gefährliche Flüssigkeiten. Sie stehen in ihrer konzentrierten Form den konzentrierten Säuren nicht nach!
Hinweis: Laugen verätzen die Hornhaut des Auges!
Allerdings ist die Vielfalt an starken Laugen nicht so hoch. Vor allem Natronlauge und Kalilauge können in konzentrierter Form sehr ätzend sein. Kalkwasser (Calciumhydroxid) und Barytwasser (Bariumhydroxid) sind etwas weniger gefährlich!
Für alle Laugen und Säuren gilt: Je konzentrierter sie sind, desto stärker ist ihre Wirkung. Im Umkehrschluss bedeutet dies, dass eine Verdünnung sie ungefährlicher macht!
So wird verdünnte Natronlauge z.B. für Laugengebäck verwendet.
Barytwasser:
Bariumhydroxid ist bei Raumtemperatur ein Feststoff. In Wasser aufgelöst wird er Barytwasser oder Bariumlauge genannt.

Versuche: Die Wirkung von Laugen und Säuren
1. Die Wirkung von Natronlauge
In ein RG wird eine Haarsträhne gegeben, dann 3-5 Plätzchen NaOH und ca. 3ml Wasser. Gut umrühren und bis zur nächsten Stunde stehen lassen.
=> Haare werden aufgelöst.
Infos für die Oberstufe:
- Es findet eine basische Hydrolyse von Proteinen statt
- viele Aminosäuren werden durch Racemisierung zerstört
2. Wasserentziehende (=hygroskopische) Wirkung konzentrierter Schwefelsäure
V: In ein (altes) Reagenzglas wird etwas Haushaltszucker (=Saccharose) eingefüllt und mit etwas Wasser befeuchtet. Nun wird der Zucker von Konzentrierter Schwefelsäure bedeckt.
B: Es entsteht eine schwarze, leichte Substanz mit großem Volumen. Der Geruch erinnert an eine Mischung aus Kohle und Karamel.
S: Die ablaufende Reaktion ist zu komplex um, sie in der Mittelstufe zu verstehen. Grob gesagt wird der Zucker durch die Schwefelsäure in Wasser und Maltol (ein Aromastoff der Ananas) und Kohlenstoff zersetzt.
Eine vereinfachte Gleichung für Schüler der Oberstufe: C6H12O6 + 6H2SO4 ---> 6C + 6H3O+ + 6(HSO4)-
Natriumhydroxid entzieht der Luft die Feuchtigkeit
Die wasserentziehende Wirkung kann man schon beobachten, wenn festes Natriumhydroxid ein paar Tage offen an der Luft steht (leider hat jemand das Uhrglas berührt, so dass die Pastillen nicht mehr am originalen Platz lagen):


3. Versuch zum Rohreiniger
Mit etwas Haaren wird ein Reagenzglas „verstopft“, dann wird Wasser mit Abflussfrei zugegeben und man wartet ca. einen Tag.
Reaktionen der Oxide mit Wasser I: Säurebildung in zwei Schritten
Ziel dieser beiden Versuche ist es Schwefelsäure bzw. Kohlensäure herzustellen. Dazu wird das jeweilige Element in reinem Sauerstoff verbrannt. Es bilden sich sogenannte Nichtmetalloxide.
Damit nichts von den entstehenden Oxiden verloren geht, finden beide Versuche in geschlossenen Rundkolben statt.
V 1: Verbrennen von Schwefel & Kohlenstoff in reinem Sauerstoff
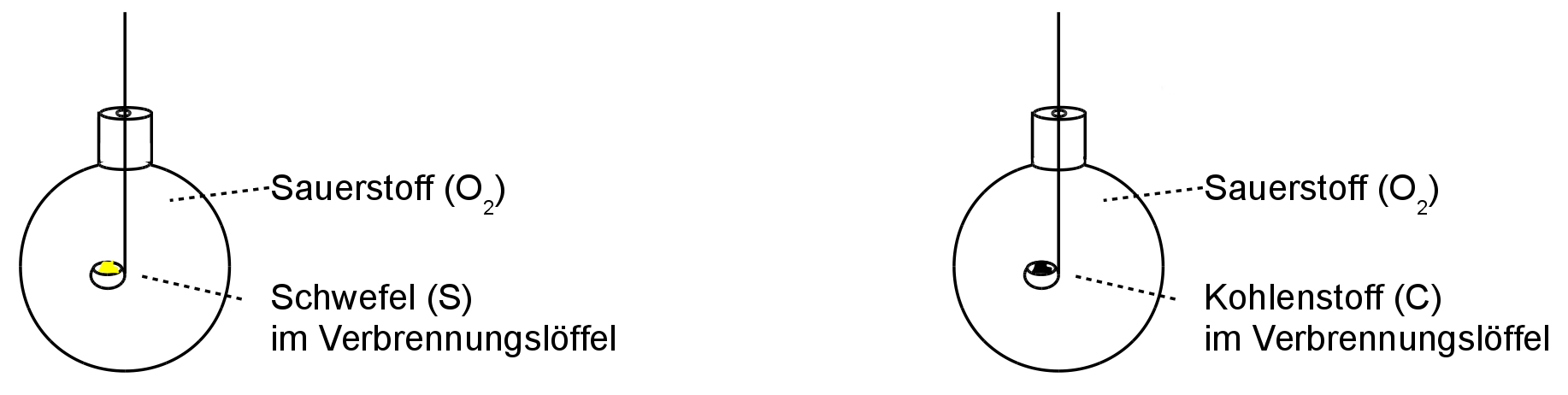
|
B1: - Schwefel verbrennt mit blauer Flamme |
- Kohle verbrennt |
|
- Rauchbildung |
- gelbe Flamme |
|
S1: Entstehung von Schwefeloxid |
Entstehung von Kohlenstoffdioxid |
|
Schwefel + Sauerstoff -> Schwefeloxid + E |
Kohlenstoff + Sauerstoff -> Kohlenstoffdioxid + E |
V2: Im zweiten Schritt gibt man nun Wasser zu den neu entstandenen Oxiden. Wenn sich die Oxide in Wasser lösen, bildet sich Säure. Zum Beweis kann man anschließend einigen Tropfen Universalindikator zufügen.

|
B2: starke Rotfärbung |
geringe Rotfärbung |
|
S2: Schwefeloxid löst sich in Wasser und bildet Schwefelsäure |
Kohlendioxid löst sich in Wasser und bildet Kohlensäure |
|
Schwefeloxid + Wasser ---> Schwefel(ige) Säure + E |
Kohlenstoffdioxid + Wasser ---> „Kohlensäure“ + E |
Nichtmetalloxide (z.B. Kohlenstoffdioxid) bilden mit Wasser eine Säure.
Das Video zum ersten Versuch findet ihr in meinem Kanal: Verbrennen von Schwefel:https://youtu.be/LJohKxAWbcs
Das Video zum zweiten Versuch: Schwefeloxid reagiert mit Wasser: https://youtu.be/NhpOVEfOGJo
Aufgaben:
1. Das Wort Säure und alle Säuren sind zu unterstreichen, das Wort Nichtmetall und alle Nichtmetalle sind in einer anderen Farbe zu unterstreichen.
2. Nenne 10 Nichtmetalle. Wie unterscheiden sie sich von den Metallen? Was unterscheidet Nichtmetalloxide von Nichtmetallen?
3. Wie kann man eine Säure bilden?
4. In Cola ist viel Phosphorsäure enthalten. Wie kann eine Getränkefirma Phosphorsäure herstellen? (https://de.wikipedia.org/wiki/Phosphor).
5. Warum erlischt die Flamme im Rundkolben nicht sofort? Wie lange läuft die Verbrennung eigentlich?
6. Ein Schüler schreibt im Test: Zum Herstellen von Schwefelsäure nimmt man Schwefel und mischt ihn mit Wasser. Warum ist das falsch?
Reaktionen der Oxide mit Wasser II: Laugenbildung in zwei Schritten
Metalloxide sind chemische Verbindungen eines Metalls mit Sauerstoff. Viele Metalloxide dienen als Erze zur Metallgewinnung (d.h. der Sauerstoff wird entzogen und so das reine Metall gewonnen). Metalle können auch wieder zu Metalloxiden reagieren. Ein weit verbreitetes Problem ist Rost (Eisenoxid), welcher aus wertvollem Eisen entsteht.
In diesem Versuch dienen die Metalloxide als Ausgangsstoff zur Laugenherstellung. Doch erstmal muss man aus dem Element ein solches Metalloxid herstellen:
V1. Verbrennen von Magnesium über einem Becherglas .
B1: Es entsteht eine helle, gleißende Flamme; weißer Feststoff (Rauch).
S: Es ist das weiße Pulver Magnesiumoxid entstanden.
Magnesium + Sauerstoff ---> Magnesiumoxid + Energie
V2: Anschließend wird das Produkt mit Wasser gemischt.
B2: Magnesiumoxid löst sich schlecht in Wasser, nach Zugabe des Wassers kann man Universalindikatorfarbe hinzugeben. Er zeigt die Farbe
blau.
S: Es ist Magnesiumlauge entstanden.
Magnesiumoxid + Wasser ---> Magnesiumlauge + Energie
Merke: Wenn sich Metalloxide in Wasser lösen, reagieren sie mit Wasser zu Hydroxiden.
Die wässrigen Lösungen von Hydroxiden bezeichnet man als Laugen.
Aufgaben:
1. Das Wort Metalloxid und alle Metalloxide sowie alle Laugen werden wieder unterstrichen
2. Was unterschiedet Metalloxide von Metallen?
3. Wo findet man im Periodensystem der Elemente die Metalle und wo die Nichtmetalle?
4. Wozu werden Metalloxide verwendet?
5. Beschreibe allgemein: Wie stellt man eine Lauge her?
6. Was entsteht bei der Verbrennung von Natrium?
7. Eine wichtige Lauge ist das so genannte Kalkwasser. Der richtige Name ist Calciumhydroxid. Kannst Du beschreiben, wie man es herstellen kann?
8. Wozu wird Calciumoxid verwendet? (https://de.wikipedia.org/wiki/Calciumoxid).
Säuren und Basen im Alltag


Der pH-Wert
Vielleicht hast Du das auch schon in Versuchen beobachtet: Die Wirkung einer Säure ist nicht immer gleich! Es gibt starke (z.B. Schwefelsäure, H2SO4) und schwache Säuren (z.B. Zitronensäure). Außerdem sind auch starke Säuren in ihrer Wirkung schwach, wenn man sie mit viel Wasser verdünnt.
Um die Wirkung einer Säure beurteilen zu können, braucht man eine passende Maßeinheit.

=> Definition für die 7. und 8. Klasse:
Der pH-Wert misst die Stärke der Wirkung von Säuren und Laugen, also wie sauer oder alkalisch eine Substanz reagiert.
Der pH-Wert wird mit einem Messgerät oder mit so genanntem Indikatorpapier gemessen. Auf dessen Farbskala findet man die Werte von pH 0-14. Den mittleren Wert (pH=7) misst man bei neutralen Lösungen, wie z.B. reinem Wasser. Die Werte pH 0-6 sind sauer (Säure), die Werte pH 8-14 sind alkalisch (Lauge).
Hier einige Beispiele von pH-Werten bei Alltagsstoffen
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
HCl |
Magensäure,
Kalkreiniger
Batterie- säure |
Zitronensaft |
Essig
Zitronenlimonade |
Cola
Sauerkraut |
Haut
Shampoo
O-Saft |
saure Milch
Speichel |
Leitungs-wasser |
Darmmilllieu
Nordsee- Wasser |
Seife |
nasser Zement |
Waschmittel
Ammoniak |
Kernseife |
Abfluss-frei |
sehr sauer schwach sauer neutral schwach alkalisch sehr alkalisch
Das Besondere an der pH-Wert-Skala ist, dass der Unterschied zwischen einem pH-Wert und dem nächsten das 10-fache beträgt. Das bedeutet, dass z. B. eine Säure mit pH=2 zehnmal so sauer wie eine Säure mit pH=3 ist und hundertfach so sauer ist, wie eine pH=4 ist.
Eine Verdünnung einer Säure um den Faktor 10 bedeutet also die Zunahme des pH-Werts um den Faktor 1
Verdünnungsreihe HCl:
Konzentrierte HCl hat den pH = 0
Lsg. 1: 1/10 konz HCl + 9/10 Wasser pH = 1
Lsg. 2: 1/10 Lsg 1 + 9/10 Wasser pH = 2
usw.
Beachte, dass man das „p“ des pH-Werts klein schreibt!
pH ist Abkürzung für potentia Hydrogenii (Macht/Kraft der Wasserstoffe).
Zusatzinformationen: https://de.wikipedia.org/wiki/ph-wert
Aufgaben:
1. Lies den Text und markiere wichtige Schlüsselwörter. Kennst Du noch andere Alltagsstoffe, die eine saure oder eine alkalische Wirkung haben?
2. Was vermutest Du, warum man den Säuregrad überhaupt messen muss? Reicht nicht eine Bezeichnung wie sauer oder neutral aus?
3. Begründe, warum eine starke Säure auch manchmal schwach wirken kann? Vergleiche mit einem starken Sportwagen, der in einer 30er-Zone fährt.
4. Begründe, warum Aquarienliebhaber so sehr am pH-Wert ihres Wassers interessiert sind.
5. Mit der wie vielfachen Menge Wasser muss man einen Liter Essig verdünnen, damit er nicht mehr sauer ist (pH =7)?
Säuren greifen unedle Metalle an
Unedle Metalle sind z.B. Magnesium, Zink und Eisen. Diese Metalle werden leicht durch Säuren angegriffen. In diesem Versuch siehst Du die heftige Reaktion von Säuren mit unedlen Metallen. Du kannst dies auch zu Hause versuchen, indem Du Eisenwolle mit Zitronensaft über Nacht reagieren lässt.
V1: Magnesium wird mit verdünnter Salzsäure (HCl) gemischt
B: Es entsteht ein brennbares Gas, das Mg löst sich auf
S: Mg reagiert zu einem Salz und Wasserstoff:
Magnesium + Salzsäure ---> Wasserstoff + Magnesiumsalz + E
(Mg + 2HCl ---> H2 + MgCl2 +E)
V2: Der Versuch wird mit einem Centstück aus Kupfer wiederholt.
B2: keine Reaktion
S2: Kupfer ist im Gegensatz zu Magnesium ein edleres Metall. Es wird von verdünnter Salzsäure nicht angegriffen.
Säuren greifen Kalk an
Aufgabe: Kennst Du diesen Versuch mit dem Ei, welches in Essig liegt?
Beschreibe das Bild. Was denkst Du passiert und was wird das Resultat des Versuches sein?
Wenn Du sicher bist, was passiert, führe den Versuch mit Haushaltsmitteln selbst durch.

Schon nach kurzer Zeit greift die Essigsäure das Ei an. Es entsteht das Gas Kohlenstoffdioxid.
Säurestärke
In manchen Büchern wird der pH-Wert mit der Säurestärke gleichgesetzt. Dies ist jedoch nicht ganz richtig!
Zum Vergleich: eine verdünnte Schwefelsäure kann schwächer wirken als die schwache (aber konzentrierte) Zitronensäure.
Der Begriff „starke Säure“ sagt aber, dass eine Säure immer stark ist, egal wie gerade der aktuelle pH-Wert ist. Ein Sportwagen ist auch immer ein Sportwagen, auch wenn er mit 30 durch ein Wohngebiet fährt!
Um dem ganzen Phänomen der Säurestärke etwas näher zu kommen, betrachten wir die Reaktion von Magnesiumband in einer starken und einer schwachen Säure:
V: Mg-Band wird mit konzentrierter HCl bzw. mit Essigsäure versetzt
B: Mit konzentrierter Salzsäure ist die Reaktion viel heftiger. In beiden Fällen entsteht ein brennbares Gas.
S: Daraus folgt, dass HCl eine stärkere Säure ist, Essigsäure hingegen eine schwache Säure ist.
Magnesium + Säure ---> Salz + Wasserstoff + E
V2: Die Säure HCl wird mit viel Wasser verdünnt und dann ein Streifen Magnesium hineingeworfen. Der Versuch wird mit Essigsäure wiederholt
B2: Beide Reaktionen laufen ähnlich langsam ab
S2: Man kann Säuren in ihrer Wirkung abschwächen. Man kann also starke Säuren mit Wasser verdünnen, ihre Wirkung ist dann weniger stark. Dennoch bleiben sie starke Säuren.
Nicht alle Säuren sind gleich stark oder gleich ätzend.
Man unterscheidet grob gesagt zwischen starken und schwachen Säuren.
|
starke Säuren: |
||
|
Salzsäure |
HCl |
|
|
Salpetersäure |
HNO3 |
|
|
Flusssäure |
HF |
|
|
Schwefelsäure |
H2SO4 |
|
|
Phosphorsäure |
H3PO4 |
|
|
schwache Säuren: |
||
|
Kohlensäure |
H2CO3 |
|
|
Zitronensäure (E330) |
Diese Formeln |
|
|
Essigsäure |
sind leider noch zu |
|
|
Ameisensäure |
kompliziert. Du |
|
|
Äpfelsäure (E296) |
lernst sie in den |
|
|
Milchsäure |
nächsten Jahren. |
|
|
Ascorbinsäure (E300) |
Verwendung der schwachen Säuren:
Zitronensäure und Ameisensäure werden z.B. zum Entkalken (von Töpfen und Kaffeemaschinen) und zum Konservieren von Lebensmitteln benutzt. Ameisen benutzten ihre Säure als Verteidigungsstoff.
Essigsäure wird verdünnt mit Wasser für Salat, zum Kochen und zum Konservieren von Lebensmitteln (wie Gurken oder Fisch) verwendet.
Milchsäure entsteht durch Milchsäurebakterien und lässt Milch erst sauer werden, dann gerinnen. Das Produkt kann Joghurt oder Käse sein.
Die Neutralisation
Die Neutralisation ist die Reaktion zwischen Säuren und Laugen/ Basen. Dabei bildet sich Wasser.
Die übrigen Ionen bilden ein Salz.
Universalindikator in seinen drei Farben:

Gibt es eine Möglichkeit Säuren unschädlich zu machen?
V: Zu Salzsäurelösung, die mit Universalindikator gefärbt ist, wird Natronlauge (=Natriumhydroxid in Wasser aufgelöst) zugetropft. Die entstehende Lösung kann mit dem Bunsenbrenner eingedampft werden.
Wichtig ist ein geschicktes und langsames Tropfen (z.B. mit einer Pipette) und ständigem Rühren!
Bei der Neutralisation muss man folgendes beachten:
- tropfenweise Zugabe (z.B. mit einer Pipette)
- ständiges Rühren
- geduldig sein
B: Allmähliche Grünfärbung der Lösung. Nach dem Eindampfen bliebt ein weißer Feststoff zurück.
S: Salzsäure und Natronlauge haben gemeinsam zu Wasser und einem Salz reagiert.
Beispiel einer Neutralisation:
NaOH + HCl ---> H2O + NaCl + E
Gibt man zu einer Lauge eine bestimmte Menge an Säure hinzu, so erhält man eine neutrale, nicht ätzende Flüssigkeit.
=> Lauge und Säure sind Gegenspieler. In gleicher Konzentration zusammengefügt, heben sie sich in ihrer Wirkung auf.
Nach dem Eindampfen liegt reines Natriumchlorid mit seiner typischen Kristallstruktur vor:

Ein Video zur Neutralisation von Schwefelsäure findet ihr in meinem Kanal: https://youtu.be/t_AFdW4Zi1c
Quantitative Neutralisation
Bei der Neutralisation entsteht ein weiterer Stoff neben Wasser. Um diesen zu sehen, muss eine Neutralisation durchgeführt und das Wasser eingedampft werden. Der Rückstand wird dann untersucht.
Nur, wie neutralisiert man ohne Indikator?
V1: Zu 15 ml Natronlauge wird so lange aus einer Bürette Salzsäure zugetropft, bis es zum Farbumschlag kommt. Die Menge wird notiert. Der Versuch wird ohne Indikator wiederholt.
B: Für 15 ml Natronlauge werden .... ml Salzsäure benötigt.
V2: Die neutrale Lösung (ohne Indikator) aus V1 wird eingedampft.
B2: Es bildet sich ein weißer Niederschlag, Dampf steigt auf
S2: Natronlauge und Salzsäure haben zu Kochsalz und Wasser reagiert
Na OH + H Cl ---> H2O + NaCl + E
Allgemeine Regel für jede Neutralisation: Lauge + Säure reagieren zu Salz + Wasser + E
Das entstandene Salz ist in der Regel im Wasser aufgelöst und kann durch Eindampfen rein gewonnen werden.
Fragen:
1. Warum muss der Versuch zweimal durchgeführt werden?
2. Was geben Ärzte zu trinken, wenn jemand versehentlich Säure getrunken hat?
3. Viele Menschen leiden an Sodbrennen, also dem Aufsteigen von einem Übermaß an Magensäure. Übliche Medikamente enthalten Calciumoxid. Kannst Du erklären, warum?
4. Kannst Du die Reaktionsgleichungen für folgende Neutralisationen erstellen?
a) Natronlauge mit Schwefelsäure
b) Kalilauge mit Phosphorsäure
c) Kalkwasser mit Phosphorsäure
5. Benenne die bei Aufgaben 4 entstehenden Salze.
Rotkohl, der Indikator aus der Küche
In der Chemie versteht man unter einem Indikator einen Stoff, der zur Überwachung einer chemischen Reaktion beziehungsweise eines Zustandes dient. Häufig wird die Änderung durch eine Farbveränderung angezeigt.
Säure-Base-Indikatoren aus dem Haushalt:
Auch Rotkohlsaft kann als Säure-Lauge Indikator verwendet werden. Rotkohlsaft kann dabei Farben von rot = sauer bis blau = alkalisch annehmen (in noch alkalischerem Milieu wird er grün und bei pH>10 sogar gelb).
In Norddeutschland wird zum Rotkohl häufig Apfel zugegeben - dessen Säure färbt ihn richtig rot. In Bayern wird er eher Blaukraut genannt, da dort das Trinkwasser neutral ist und der Rotkohl beim Kochen eher blau erscheint.
Auch Teetrinker kennen ihren Tee als Indikator - wird nämlich Zitronensaft zugegeben, dann verfärbt sich der Tee hellorange. Würde man hingegen Lauge zufügen, wäre er fast dunkelbraun.
Probiere es einmal selbst: Nimm einen frischen Rotkohl und zerschneide ein bis zwei Blätter mit einer Schere oder einem Messer. Gib die zerschnittenen Blätter für einige Minuten in ein Gefäß mit etwas Wasser. Besonders gute Ergebnisse erhältst Du, wenn Du heißes Wasser verwendest. Ersatzweise kann Rotkohl aus der Konserve verwendet werden.
Mit dem farbigen Rotkohlextrakt kann man dann durch Zugabe von Säure oder Lauge mindestens fünf verschiedene Farben herstellen:

stark sauer - sauer - neutral - alkalisch - stark alkalisch
Die Neutralisation ist eine exotherme Reaktion
V: In ein großes, senkrecht eingespanntes Reagenzglas gibt man 5ml 5%-10% HCl, dann gibt man in kleinen Portionen konzentrierte NaOH hinzu. Die Temperatur wird mit einem Thermometer gemessen.
B: Unter heftigem Aufwallen, Hitze und Geräuschentwicklung reagieren beide Substanzen miteinander. Am Boden setzt sich ein weißer Stoff ab.
S: Es bilden sich Kochsalz und Wasser. Die Neutralisation setzt große Energien frei. Solche Reaktionen nennt man exotherme Reaktionen.
Textübungen zur Wiederholung und zum Üben des Formulierens
Formuliere zu jeder der drei Fragen je eine ausführliche Antwort. Achte vor allem dabei auf Verständlichkeit und Vollständigkeit der Antwort.
1. Beschreibe den Zusammenhang zwischen Oxidationen von Metallen und Nichtmetallen und der Säure- und Laugenbildung.
2. Begründe, ob die folgende Aussage zutrifft: „Durch Verbrennungen fossiler Brennstoffe (wie Erdöl, Erdgas, Benzin, Diesel usw.) entstehen für Pflanzen zu saure Böden.
3. Durch Verstreuen von Calciumoxidpulver über Wäldern können großflächig saure Waldböden neutralisiert werden. Erkläre diesen Zusammenhang mit chemischem Hintergrundwissen. Bedenke dabei, das Calcium ein Metall ist.
Wiederholungsfragen Kapitel 4
- Nenne 5 Säuren und 3 Laugen mit ihrer Formel. Stelle dann die Reaktionsgleichung einer beliebigen Neutralisation auf.
- In Cola ist viel Phosphorsäure enthalten. Wie kann eine Getränkefirma Phosphorsäure herstellen.
b) Stelle die Reaktionsgleichungen dazu auf.
c) Beschreibe, wie diese Säure unschädlich gemacht werden kann. Beschreibe genau, wie man dazu vorgehen muss. - Schwefeloxid wird mit Wasser vermischt. Stelle die Reaktionsgleichung auf.
a) Stelle die Reaktionsgleichung der Verbrennung von Magnesium auf.
b) Erkläre an diesem Beispiel die Begriffe Oxidation und Metalloxid.
c) Welche Farbe zeigt Universalindikator, wenn man das Produkt aus 3a) mit Wasser mischt? - Wissenschaftler haben festgestellt, dass Regenwasser auch Säuren enthält. In den letzten Jahren hat man nun beobachtet, dass vor allem in Gebieten mit starkem Autoverkehr, der Regen besonders sauer ist. Besteht da ein Zusammenhang? (Tipp: In Benzin sind Kohlenstoff und Schwefel enthalten).
- Erkläre den Begriff pH-Wert.
- Was vermutest Du, warum man den pH-Wert überhaupt messen muss? Reicht nicht eine Bezeichnung wie sauer oder neutral aus?
- Warum kann eine starke Säure auch manchmal schwach wirken? Vergleiche mit einem starken Sportwagen, der in einer 30er-Zone fährt.
- Nenne Gründe, warum Aquarienliebhaber so sehr am pH-Wert ihres Wassers interessiert sind.
- Bestimme die Menge Wasser, mit der man 1l Essig verdünnen muss, damit er nicht mehr sauer ist (pH=7)?
- Was ist eine „Neutralisation“?
a) Beschreibe eine Versuchsdurchführung und stelle Beobachtung und Schlussfolgerung auf (mit Reaktionsgleichung!).
b) Stelle die Reaktionsgleichung der Neutralisation von Phosphorsäure mit Kalilauge auf. - Ein Bauarbeiter arbeitet beim Anrühren des Zements ohne Handschuhe. Dazu verwendet er so genannten „gebrannten Kalk“ (CaO). Nach einigen Wochen sind seine Hände stark angegriffen, eingerissen und rötlich. Finde eine Erklärung.
- a) Beschreibe, wie man aus Phosphorpulver eine Säure herstellen kann.
- b) Stelle die Reaktionsgleichungen dazu auf:
- c) Wie kann diese Säure unschädlich gemacht werden? Beschreibe genau, wie man dazu vorgehen muss.
- Definiere die Begriffe Säure und Lauge und wiederhole alle Säuren und ihr Säurereste.
- Was ist ein Indikator? Erkläre, welche positiven Eigenschaften ein Stoff haben muss, um ein Indikator zu sein und nenne dir bekannte Indikatoren.
- Nenne 5 Dinge aus dem täglichen Leben, die eine Säure sind.