Wiederholungsfragen 4. Lernjahr Chemie - Einführung in die organische Chemie
50 richtig lustige Fragen zur Testvorbereitung
-
Vergleiche Diamant und Graphit hinsichtlich ihrer Eigenschaften und dem Aufbau.
-
Was versteht man unter der „Chemie des Kohlenstoffs“. Nenne den Begründer der organischen Chemie und welchen organischen Stoff er erstmalig im Labor herstellte.
-
Beschreibe die Verbrennung organischer Substanzen am Beispiel der Verbrennung von Benzin (zur Vereinfachung Oktan). Stelle eine Reaktionsgleichung auf und formuliere einen Merksatz, der dies für alle organischen Substanzen zusammenfasst. Zur Übung erstelle dann die Reaktionsgleichungen für die Verbrennung von Methan, Ethan und Propan auf.
-
Welche Konsequenzen ergeben sich aus den Produkten in Aufgabe 3 für unsere Umwelt?
-
Was ist die homologe Reihe der Alkane? Wie unterscheiden sich Alkane, Alkene und Alkine? Nenne je ein Beispiel sowie die allgemeine Formel.
-
Welchen Zusammenhang siehst du zwischen der Länge der Kohlenstoffkette und dem Litergewicht sowie der Siedetemperatur der homologen Reihe der Alkane.
-
Welche Summenformel haben a) Cyclo-Alkane b) Alkene mit zwei Doppelbindungen)?
-
Erkläre den Begriff „Isomer“ und stelle alle Isomere von Hexan auf.
-
Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel C4H9OH an!
-
Wiederhole die Regeln der Nomenklatur und benenne die folgenden Verbindungen:
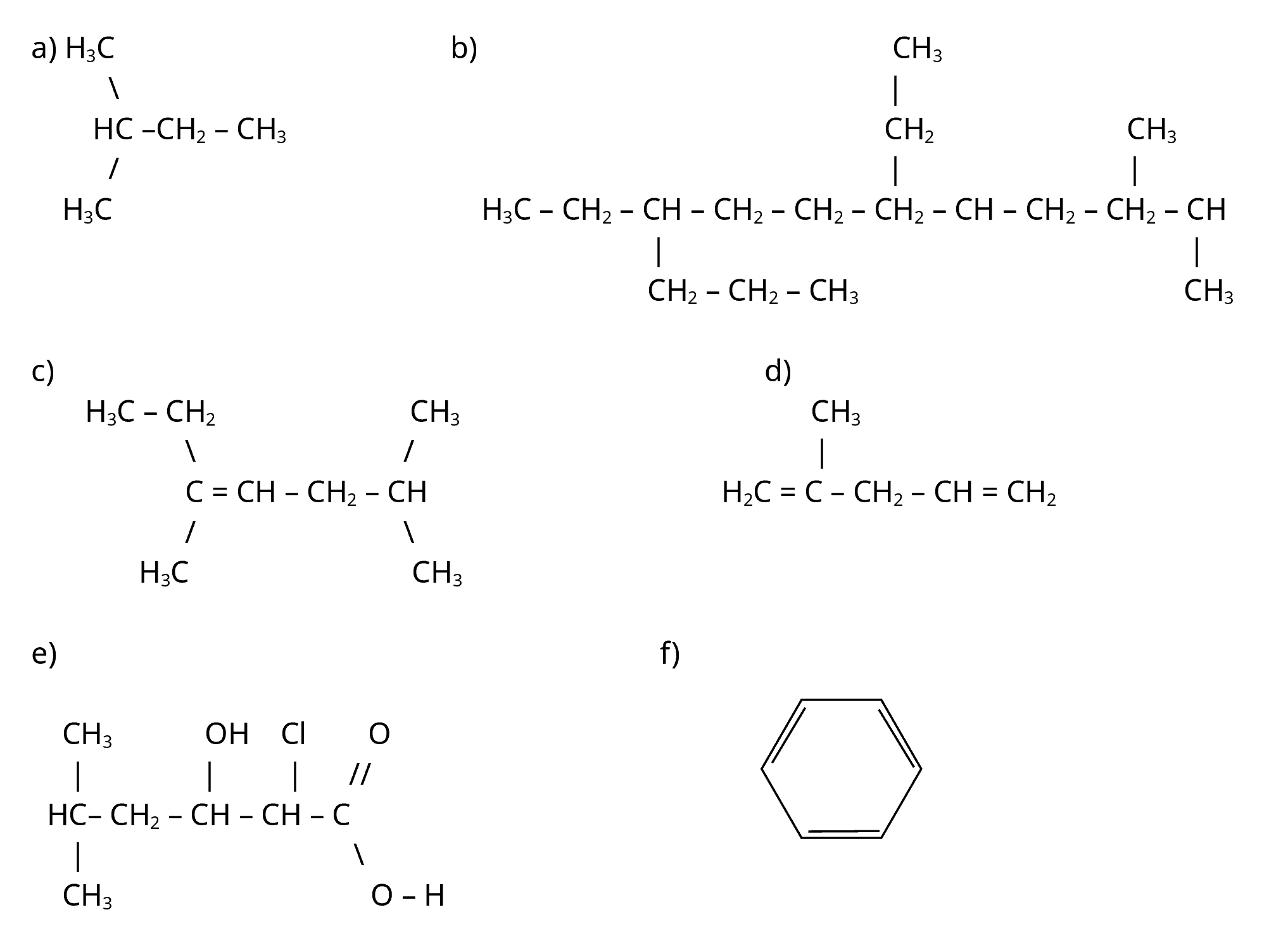
-
Zeichne die folgenden Strukturformeln und benenne die Substanzen:
a) CH3-CHCl2 b) C2H5OH c) CH3-CH3O d) C2H3Br e) C3H7Cl f) C6H6 g) C3H8 h) C3H5Cl
i) C3H3COOH j) C3H3O k) Butanal l) (CH3)3CCH3 m) CH2=C(CH3)CH2F n) H3C-CH2-Br
o) 1,5-Diiodpenta-1,4-dien p) 2-Fluor-3,4-dimethylhexen (3) q) 4,4-Dimethylheptan
r) 2,3,4 Trimethylpenten s) H3C-CH2-CH2-CH2-CH2 t) H3C-CH=CH-CH=CH-CH3 u) 2,2 Dimethylpropan -
Begründe, warum es in der organischen Chemie eine theoretisch unendliche Anzahl an Verbindungen gibt.
-
Begründe, warum Kohlenstoff vierbindig ist und warum Wasserstoff nur eine Bindung haben darf. Wie viele Bindungen hat Stickstoff? Wie sehen die typisch gebunden Sauerstoffe aus?
-
Nenne zehn Stoffe, in denen Kohlenstoff enthalten ist. Wie kann man Kohlenstoff in ihnen chemisch nachweisen? Beschreibe ein Experiment. (Wie kann man Halogene in Kohlenwasserstoffen nachweisen?)
-
Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.B. Benzin oder Alkohol) aus?
-
Stoffklasse
funktionelle Gruppe
Endung
Beispiel
Alkan
C-C
Alken
C=C
Alkin
Alkohol
Carbonsäure
Halogenalkane
Vervollständige die Tabelle:
-
Erstelle den genauen Mechanismus der Bildung von 1-Chlor-Hexan aus Hexan. Achte darauf, keine Fehler zu machen! Lerne an diesem Beispiel ordentlich und gewissenhaft zu zeichnen! Jede vergessene Bindung bedeutet ein Hanuta für den Nachbarn!
-
Gib eine Methode an, nach der aus 1-Butanol Buten entsteht.
-
Wie kann man Brombutan herstellen? Nenne verschiedene Wege.
-
Formuliere die Iodierung von Ethan. Nenne mindestens drei mögliche Abbruchreaktionen.
-
Formuliere einen chemischen Syntheseweg zur Herstellung von Ethanol. Wie wird Alkohol eigentlich üblicherweise hergestellt?
-
Nenne Verwendungszwecke von Carbonsäuren und Aldehyden.
-
Wozu wird Glycerin, Aceton, Ethanal, Ameisensäure und Octan verwendet?
-
Nenne eine Methode zur Darstellung von Ethan-1,2-diol (=Glycol).
-
Beschreibe den Reaktionsmechanismus und die Reaktionsbedingungen der folgenden Reaktion:
CH3 CH3
| |
H2C– CH2 – CH3 + ........ --> ...... --> H2C = C – CH3 + .....
|
Cl -
Vervollständige die Reaktionsgleichung (und gib Pfeile über die sich bewegenden Atome an und benennen Edukte und Produkte: (CH3)3C-OH + H2SO4 ---> ...
-
Nenne drei Dir bekannte zwischenmolekulare Kräfte. Beschreibe sie und ordne sie hinsichtlich ihrer zunehmenden Wirkungsstärke.
-
Erkläre das Zustandekommen von Dipol-Dipol-Kräften und von Van-Der-Waals-Kräften. Welchen Einfluss haben Sie und wie entstehen sie? Worin unterscheiden sie sich?
-
Vergleiche die zwischenmolekularen Kräfte von Methanol und Oktanol.
-
Ordne Wasser, Methanol und Diethylether nach Molekülmassen und vergleiche deren Siedepunkte. Kann man diesen Widerspruch erklären?
-
Beurteile die Löslichkeit folgender Substanzen in Wasser: Methansäure, 1-Octanol, Ethansäure-methylester, 2-Propansäure.
-
Was versteht man unter Viskosität? Erkläre und nenne Beispiele.
-
Inwiefern hat der räumliche Bau eines Moleküls Einfluss auf dessen polaren Charakter? Begründe am Beispiel von CCl4, CO2 und HF.
-
Welche Art von Bindung liegt im Chloroform-Molekül (HCCl3) vor?
-
Erkläre, warum sich Alkane nicht in Wasser, sehr wohl aber in Öl und Fett lösen. Benutze dazu die folgenden Begriffe: Hydrophob, hydrophil, lipophob, lipophil, Dipol-Dipol-Wechselwirkungen, räumlicher Bau und Abstoßung.
-
Erkläre das Zustandekommen von zwei Phasen beim Mischen von Alkanen mit Schwefelsäure.
-
Was erwartest Du, wenn man Kochsalz in Benzin gibt und kräftig rührt? Begründe.
-
„Die unterschiedliche Entzündbarkeit der flüssigen Alkane entspricht der homologen Reihe und ist von den Massen und den Van-der-Waals-Kräften abhängig“. Stimmt diese Aussage? Begründe!
-
Nenne und vergleiche die Eigenschaften von Alkanen, Alkinen und Alkenen erst allgemein und dann am Beispiel von Ethan, Ethen und Ethin.
-
Nenne gemeinsame Eigenschaften von Halogenalkanen. Beschreibe die Stoffklasse und nenne prominente Verbindungen.
-
Nenne die Summenformeln von Paraffin, Aceton, Ether (Diethylether), Glycerin.
-
Lerne die Formeln der Säuren „Chlorwasserstoff“, „Bromwasserstoff“, „Iodwasserstoff“ und „Schwefelwasserstoff“.
-
0,0396g einer unbekannten organischen Substanz verbrennen zu 0,0390g Wasser und 0,0469g Kohlenstoffdioxid. Wie lautet die Verhältnisformel der Verbindung?
-
Erkläre mit eigenen Worten, wie sich hydrophile von lipophilen Flüssigkeiten unterscheiden.
-
Wie erklärst Du Dir das „Nichtmischen“ und die Phasenbildung, wenn man versucht hydrophile von lipophilen Flüssigkeiten miteinander zu vermischen?
-
Erkläre genau, welche molekularen Grundlagen dazu führen, dass eine Verbindung, welche polare Bindungen hat (wie z.B. CCl4) dennoch apolar ist.
-
Hähnchen verschmierte Finger lassen sich kaum nur mit Wasser reinigen. Warum und wie kannst Du die fettigen „Hähnchen-Finger“ am besten reinigen?
-
Welche Faktoren bestimmen Smp. und Sdp.? Begründe mithilfe des Teilchenmodells und der Brownsch'schen Molekularbewegung. In welcher Form spielt die zugeführte Energie dabei eine Rolle?
-
Ein festes Alkan mit der Summenformel C18H38 ist Bestandteil von Wachs. Erklären Sie auf molekularer Ebene die Vorgänge beim Erhitzen der Substanz bis sie gasförmig wird und am Docht verbrennt.
-
Ordne die Verbindungen Tetrafluormethan, Ammoniak (NH3), Dimethylether (H3C-O-CH3) und Methan nach deren Siedepunkten und begründe Deine Einordnung. Schlage nun bei Wikipedia die tatsächlichen Siedepunkte nach.