Kapitel 06: Atombau: Das Kern-Hülle Modell und das Periodensystem der Elemente

Die Elemente der Hauptgruppen 1-8 in ihrer verhältnismäßigen Größe (Atomradien)
Quelle Bild: Creative-Commons-Lizenz „Namensnennung – Weitergabe unter gleichen Bedingungen 3.0 nicht portiert“ by Wikicommonsuser Bleckneuhaus, Danke; https://commons.wikimedia.org/wiki/File:Periodensystem_mit_Atomradien.pdf
John Dalton (1766-1844) und seine Atomhypothese
John Dalton, geboren am 6. September 1766 in Eaglesfield, England, war ein englischer Naturwissenschaftler und Lehrer. Sein Vater war als Weber reich genug, seinen Sohn auf eine Schule zu schicken. Für die damalige Zeit keine Selbstverständlichkeit. Schon im Alter von 12 Jahren wurde er selbst an dieser Schule als Lehrer tätig. Im Alter von 15 Jahren (also 1781) begann er im benachbarten Kendal mit seinem Bruder und seinem Cousin eine neue Schule zu leiten. 12 Jahre später (1793) wird er an das „New College“ nach Manchester berufen, wo er Studenten unterrichteten sollte. Er starb am 27.7.1844, im Alter von 78 Jahren in Manchester.
Sein Interesse galt vielen Dingen, vor allem aber den Vorgängen der Natur. Durch seine meteorologische Beobachtungen vermutete er schon 1787, dass Regen durch ein Sinken der Atmosphäretemperatur entsteht. Weiterhin arbeitete er auf dem Gebiet der Wärmeausdehnung von Gasen und formulierte ein Gesetz dazu (das „Dalton-Gesetz der Partialdrücke“). John Dalton entdeckte auch die Farbenblindheit, an der er selbst litt.
Seine wichtigste Theorie veröffentlichte er 1803 zu den chemischen Elementen. Er vermutet, dass alle Stoffe aus Atomen bestehen. Diese neue Theorie wurde nach ihm „Dalton’sche Atomhypothese“ benannt:
- Jedes Element besteht aus extrem kleinen, bei chemischen Reaktionen ungeteilt bleibenden Teilchen, den Atomen.
- Die Massen der Atome eines bestimmten Elementes sind gleich (alle Atome eines Elements sind gleich). Die Atome verschiedener Elemente unterscheiden sich in ihren Eigenschaften (z.B. in Größe, Masse, usw.).
- Es existieren so viele Atomsorten wie Elemente.
- Bei chemischen Reaktionen werden Atome in neuer Kombination vereinigt oder voneinander getrennt (zersetzt).
- Eine bestimmte Verbindung wird von den Atomen der betreffenden Elemente in einem ganz bestimmten, einfachen Zahlenverhältnis gebildet.
Sein bedeutendster Beitrag dürfte sein 1808 veröffentlichtes Buch „A New System Of Chemical Philosophy" sein. Darin schlug Dalton vor, die Atommasse der Elemente auf das leichteste Element, den Wasserstoff zu beziehen. Diesem ordnete er dabei die Masse 1u zu. (u steht für „unit“ = Einheit). Seine Messungen waren für die damalige Zeit und die zur Verfügung stehenden Messgeräte erstaunlich genau! Er stelle gleichzeitig eine Tabelle der Atommassen auf, in der die Atome nach steigender Masse angeordnet waren. Diese waren eine wichtige Vorlage für die spätere Aufstellung des Periodensystems der Elemente.
1822 wurde er Mitglied der Englischen Royal Society. Von dieser erhielt er als erster die Goldmedaille für seine Verdienste auf dem Gebiet der Chemie. 1830 wählte man ihn als erstes ausländisches Mitglied in die französische „Académie Des Sciences“ in Paris. Letzteres war die höchste Ehrung, die einem englischen Wissenschaftler im
19. Jahrhundert verliehen wurde.
Aufgaben:
- Lese den gesamten Text und Unterstreiche anschließend mit einem Bleistift alle Schlüsselwörter mit einer Wellenlinie, alle Nebeninformationen mit einer geraden Linie.
- Lese den Text nochmals durch, wenn Du keine Änderungen mehr an Deinen Schlüsselwörtern und den Nebeninformationen hast, kennzeichne die Schlüsselwörter mit einem Textmarker und unterstreiche die Nebeninformationen mit einer feinen roten Linie.
- Erstelle einen Spickzettel mit den 12 wichtigsten Schlüsselwörtern (und Zeichnungen/ Skizzen wenn Du möchtest).
Der Rutherford’sche Streuversuch (1909-1911)
1) Beschreibung des Experiments:
Der neuseeländischer Atomphysiker englischer Abstammung, Ernest Rutherford schoss 1909 die Kerne von Heliumatomen, sogenannte Alpha-Strahlung auf eine sehr dünne Goldfolie. Diese hatte er sich extra von seinem Schmied anfertigen lassen. Sie war extrem dünn und nur 2000 Atomlagen dick (entspricht ca. 0,0005 mm). Für die α-Strahlen2 verwendete Rutherford einen radioaktiven Strahler, der ein radioaktives Gestein enthielt. (Wenn Du mehr über Strahlung und die verschieden Arten lesen möchtest: https://de.wikipedia.org/wiki/Strahlung)
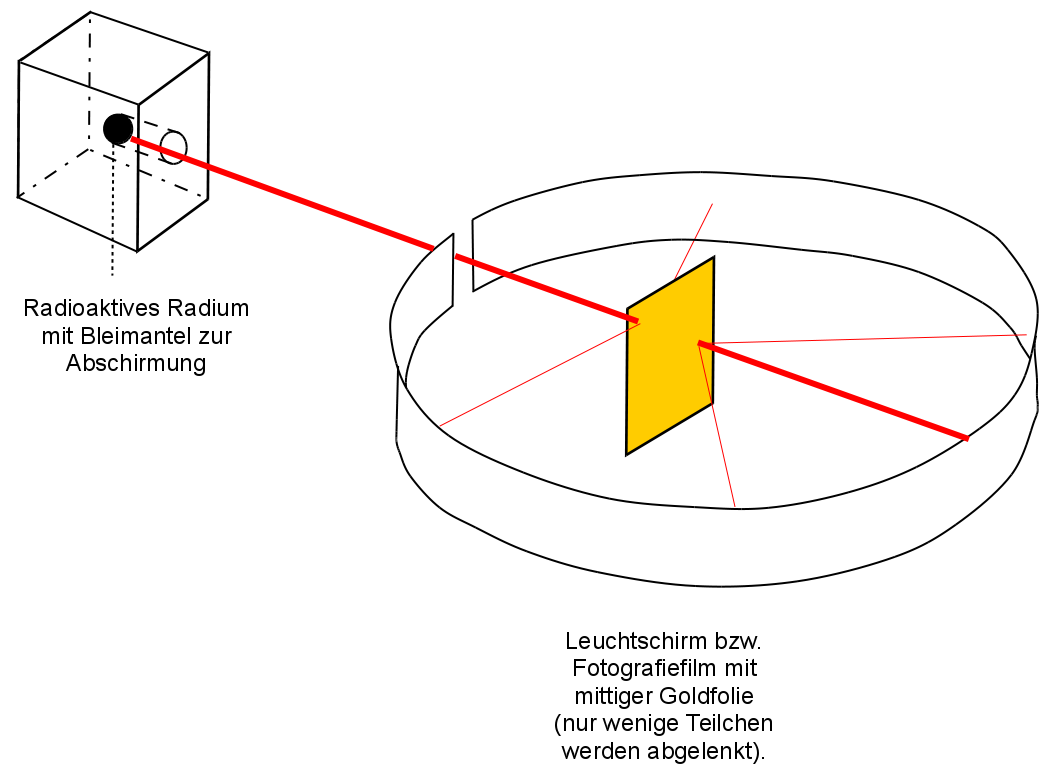
Er konnte mit einem Photographiefilm bzw. einem Leuchtschirm, die Teilchen sichtbar machen, welche seine Goldfolie durchdrangen. Seine erste Vermutung war allerdings, dass alle Teilchen von der Folie abprallen, vergleichbar mit einem Ball, den man gegen eine Wand wirft.
Da er diese erste Vermutung nicht bestätigt fand, wiederholte er das Experiment mehrere Male. Schließlich hätte seine Goldfolie ja auch Löcher aufweisen können. Aber auch neue Goldfolien brachten die gleichen Ergebnisse. Daraus schloss er, dass vielleicht seine Vermutung grundlegend falsch war. Er dachte lange nach und stelle dann eine völlig neue, für uns unglaubwürdige Theorie auf.
2) Beobachtungen und Schlussfolgerungen Rutherfords:
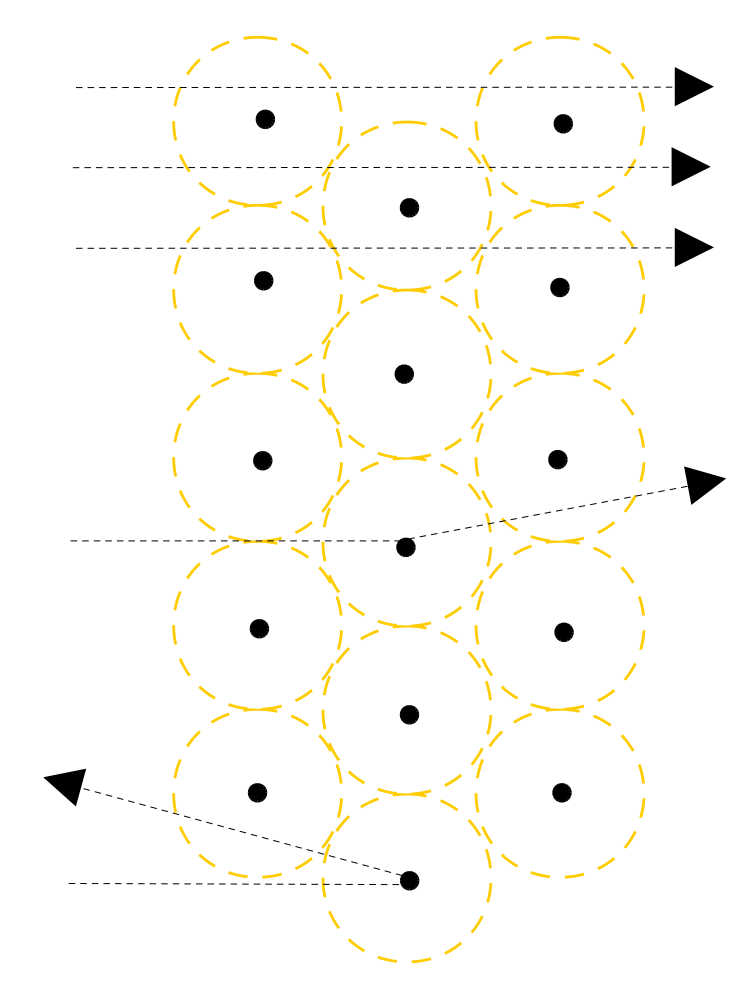
a) 99,9999% der „Geschosse“ durchdringen die Goldfolie ohne Ablenkung. (Als wären die 2000 Lagen von Goldatomen gar nicht existent)
(Vergleich: Dartpfeil durch Bauzaun werfen)
=> Atome müssen demzufolge fast „leer“ sein.
b) Einige Teilchen davon werden ein wenig abgelenkt.
(Vergleich Billard)
=> Im Zentrum des Atoms befindet sich ein „Atomkern“, der im Vergleich zum gesamten Atom sehr viel kleiner ist. Er ist umgeben von einer Elektronenhülle.
(Durchmesser des Kerns ist ca. 100.000 mal kleiner)
Volumenvergleich Kern: 10-45m3: Goldatom: 10-30 m³ = 10-15 : 1)
c) Eines von 100.000 Teilchen wird sogar zurückgeschleudert/ stark abgelenkt (=Querschläger).
=> Da die α-Teilchen positiv geladen sind, muss der Atomkern auch (elektrisch) positiv geladen sein.
Größenverhältnisse:
Durchmesser Atomkern : Durchmesser Atomhülle = 10-15 m : 10-10 m
= 1 : 100.000
Vergleich: wäre der Atomkern im Durchmesser so groß wie ein Tischtennisball (2cm),so wäre die ganze Atomhülle 2km groß
Zusammenfassung:
- Atome sind zu 99,9999% leer
- Atome enthalten einen Atomkern
- der Atomkern enthält positiv geladene Teilchen (=Protonen)
Atome haben eine Masse. Wo ist diese dann lokalisiert?
Fast die gesamte Masse eines Atoms befindet sich im Atomkern. Er hat eine außerordentlich hohe Dichte! (ρ= 4·1014 g/cm3) (Vergleich ρ Pb= 11g/cm3)
Bsp.: Masse eines hypothetischen Stecknadelkopfes, der nur aus Atomkernen besteht.
V Stecknadelkopf = 5 mm3, ρ Kernmaterie = 2,44 · 1014 g/cm3 => m = 1,22 . 1012 Tonnen!
Aufgaben:
- Beschreibe Rutherfords Versuch und erkläre die Beobachtungen mit Deinen Worten.
- Warum hat Rutherford den Versuch so oft wiederholt?
Zusatzinformationen:
https://de.wikipedia.org/wiki/Ernest_Rutherford
Größenverhältnisse bei Atomen
Durchmesser des Au -Atomkerns: 0,25 bis 1,5·10-14 m
Durchmesser des Au -Atoms: 1,3 bis 5·10-10 m (130-500 pm, 0,13-0,5 nm)
Größenvergleiche:
1)
Durchmesser der Sonne 4mm
———————————————— ≈ ——————————
4mm Durchmesser Proton
2) Hätte ein Atomkern den Durchmesser eines Tischtennisballs (1 cm), so würde seine Elektronenhülle einen Radius von 1000m haben.
Kennzeichen chemischer Reaktionen II
Blicken wir zurück: Du hast bereits gelernt, dass es verschiedene Arten der chemischen Reaktion gibt. Du kennst bereits die Vereinigung, Zersetzung und die Umlagerung. Nun wollen wir das ganze auf das Teilchemodell beziehen:
Man kann chemische Reaktionen im Grunde in drei Kategorien einteilen:
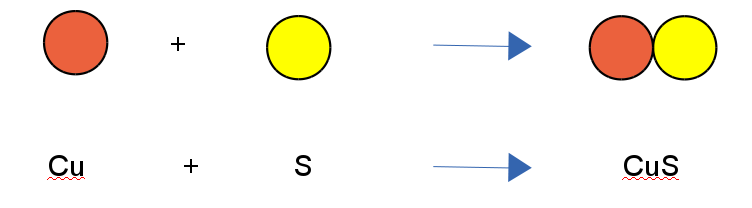
a) Vereinigung: Mehrere Atome vereinigen sich zu einem neuen Stoff => Vereinigung (=Synthese)
Beispiel: Bildung von Kupfersulfid aus den Elementen
b) Zersetzung: Ein Stoff der aus mehreren Atomen besteht (nennt man auch Molekül) wird in einzelnen Atome aufgespalten Zersetzung (auch Analyse) genannt
Beispiel: Zersetzung von Kupfersulfid in die Elemente (die Rückreaktion!)

c) Zwei Stoffe tauschen untereinander Atome aus (also erst zersetzen sich die Stoffe, dann vereinigen sich neu) => Umsetzung genannt. Umsetzungen sind oft die komplizierteren Reaktionen. Dazu später mehr in den beiden Kapitel Redoxreaktionen und Säure-Base-Reaktionen.
Beispiel: Zersetzung von Kupfersulfid in die Elemente (die Rückreaktion!)

Bei allen chemischen Reaktionen spielt Energie eine wichtige Rolle. Energie kann frei werden oder benötigt werden.
Erinnere Dich: Eine chemische Reaktion ist gekennzeichnet durch eine Stoffumwandlung und (!) einen Energieumsatz.
Die „Grundbausteine“ des Atoms
Heute wissen wir mehr über Atome, als z.B. noch Medelejew. Sie enthalten drei Elementarteilchen: Protonen, Neutronen und Elektronen.
Von außen betrachtet sind Atome zwar elektrisch neutral, aber im Inneren bestehen sie aus einem Atomkern mit positiv geladenen Protonen und elektrisch neutralen Neutronen und einer Atomhülle aus negativ geladenen Elektronen:
|
Teilchen |
Symbol |
Masse [kg] |
Masse [u] |
Elementarladung |
Aufenthaltsbereich |
|
Proton: |
p+ |
1,6726·10-27 |
1,0073 |
+1 (positiv) |
Atomkern |
|
Neutron: |
n |
1,6749·10-27 |
1,0087 |
0 (ungeladen) |
Atomkern |
|
Elektron: |
e- |
9,1096·10-31 |
0,0005 |
-1 (negativ) |
Elektronenhülle |
Definition der atomaren Masseeinheit: 1u = 1/12 der Masse eines Kohlenstoffatoms
aus 6 Protonen, 6 Neutronen und 6 Elektronen (12C)
Zusatzinformationen zu Atomen:
- Nahezu die gesamte von uns wahrnehmbare, unbelebte und belebte Materie in unserer irdischen Umgebung besteht aus Atomen oder geladenen Atomen (=Ionen).
- Atome gleicher Anzahl der Protonen, der Kernladungszahl, gehören zu demselben Element.
- Bei (ungeladenen) Elementen ist Anzahl von Protonen und Elektronen gleich.
- Die physikalischen Eigenschaften der Atomhülle bestimmen das chemische Verhalten eines Atoms.
- Atome gleicher Kernladungszahl besitzen dieselbe Atomhülle und sind damit chemisch nicht unterscheidbar.
- alle Atomkerne der Erde dicht aneinander gepackt. Das entspricht einem Würfel von 75m Kantenlänge
- Die Masseneinheit für Elementarteilchen ist 1u (= 1,66056 · 10-27 kg)
- Seit 1932 haben die Physiker weit mehr als einhundert verschiedene Elementarteilchen entdeckt und beschrieben, die jedoch chemische Reaktionen nicht beeinflussen und für die Schule keine Rolle spielen. Nach neueren Erkenntnissen sind alle „Elementarteilchen“ aus 12 Elementarbausteinen und 4 Grundkräften zusammengesetzt. Die bekanntesten Vertreter sind die „Quarks“.
- Die stärkste Kraft, die Menschen kennen, wirkt zwischen Protonen und Neutronen und hält den Atomkern zusammen. Sie ist um 1·1041 mal stärker als die Gravitation der Erde; ihre Reichweite ist sehr kurz – außerhalb des Atomkerns spürt man sie nicht. Wäre die Erdgravitation so stark, so wäre ein Reiskorn 1 Billion mal schwerer als die Erde!
- Die Chemie beschäftigt sich mit den Atomen und ihren Verbindungen, den Molekülen. Dies setzt auch genaue Kenntnisse über die Struktur der Atomhülle voraus.
- Die Atomphysik beschäftigt sich unter anderem mit dem Aufbau der Atomhülle, dem Aufbau der Atomkerne aus Elementarteilchen und weiter mit den Eigenschaften der Elementarteilchen.
- https://de.wikipedia.org/wiki/Atom
Geschichtlicher Überblick über den Atombegriff, Aufbau von Atomen und die Atomtheorie
600-400 vor Christus - Demokrit, (vorher evtl. schon Leukipp und Epikur)
der griechische Gelehrte Demokrit, äußerte vermutlich als erster, dass die Welt aus unteilbaren Teilchen (griechisch a-tomos = unteilbar) Atomen bestände. Dies seien die kleinsten Materieteilchen.
Er vermutete, dass es nur leeren Raum drumherum gäbe.
Stoffeigenschaften lassen sich, so Demokrit, auf die Abstoßung und Anziehung dieser kleinen Teilchen erklären.
Andere gelehrte Griechen lehnte seine Meinung aber ab, da man damals die Welt als etwas göttliches ansah. Demokrits stärkster Gegner war der Philosoph Empedokles, der die Lehre von den vier Elementen Feuer, Erde, Luft und Wasser begründete. Demokrits sollte für 2000 Jahre unbeachtet bleiben, bis man ihm schließlich recht gab.
ca. 1400 Alchemisten finden heraus, dass man Gold kann nicht herstellen kann
Die Alchemisten suchten Jahrhunderte lang den Stein der Weisen, um so Gold aus anderen, wertloseren Stoffen (wie etwa Blei) herzustellen. Sie scheiterten und im 15. Jahrhundert setzte sich dieses Wissen langsam durch. Trotzdem waren viele von ihnen gute Experimentatoren und sie leisteten gute experimentelle Vorarbeit für die spätere chemische Forschung.
1803 - John Dalton - Atomtheorie der Elemente
Der Engländer John Dalton griff als erster wieder die Idee von Demokrit auf. Aus seinen Versuchen zu den konstanten Mengenverhältnissen bei chemischen Reaktionen zieht er den Rückschluss, dass es kleinste Teilchen sind, die miteinander reagieren und dass immer eine bestimmte Anzahl in einem festen (Massen- bzw. Anzahlverhältnis) von Atomen miteinander reagieren muss. Außerdem bemerkte Dalton, dass sich die Gesamtmasse der beteiligten Stoffe nicht verändert.
1832 - M. Faraday forscht an der von H. Davy entdeckte Elektrolyse.
Auf diese Art und Weise bekommt er ein Bild von Atomen, welche sich auf anderen Stoffe absetzten und dem Fluss der Elektronen.
1863/66 - A. R. Newland formuliert das „Oktavengesetz“
Newland leistet so Vorarbeit für die Aufstellung des Periodensystems, da er die Bildung der 8 Hauptgruppen sozusagen vorwegnahm.
1869 - Lothar Meyer und Dimitri Mendelejew
Die beiden Chemiker stellen unabhängig voneinander die Elemente in eine Reihenfolge und verwenden das Atomgewicht als Ordnungsfaktor. So entsteht das erste Periodensystem der Elemente.
1874 - G. J. Stoney
Stoney erkennt und beschreibt als erster den Zusammenhang zwischen Atomen und der elektrischen Ladung der Teilchen.
1896 - Henri Becquerel
Becquerel entdeckt die Radioaktivität und dass sich so Atome von einem Element in ein anderes umwandeln.
1897 - Joseph John Thomson entdeckt die Elektronen
Der britische Physiker Thomson untersucht den elektrischen Strom und findet heraus, wenn man den Strom durch Vakuumröhren leitet, man kleinen Teilchen findet. Er nannte diese Teilchen Elektronen! So wurde das erste Elementarteilchen entdeckt.
1898 - Marie und Pierre Curie - neue Elemente und Radioaktivität
Marie Curie untersucht Pechblende uns isoliert daraus Polonium und Uran. Sie fand heraus, das Uran-Atome zerfallen und dabei Wärme und Strahlen abgeben.
1900 - Ludwig Boltzmann
Boltzmann berechnete Eigenschaften von Gasen und Kristallen. Dabei lagen seine Überlegungen die Ideen von Demokrit zugrunde.
1900 - Max Planck - Quanten und Quantentheorie
Der Berliner Max Planck forscht an der Schwarzkörperstrahlung. Um seine Beobachtungen erklären zu können und das ganze thermodynamisch begründen zu können musste er zu seiner Formel eine neue Größe ein, die sogenannten Quanten! Planck gilt somit als Vater der Quantenphysik.
1906 - Thomson
Thomson berechnet das Verhältnis von Ladung und Masse eines Protons
1909 - R. Millikan
Millikan ermittelt die absolute Elektronenladung und genauen die Massen von Elektronen und Protonen.
1909-1911 - Ernest Rutherfords Experimente zum Atommodell
Ernest Rutherford wollte die Berechnungen von Boltzman und Max Planck experimentell bestätigen. 1906 entdeckte er mit seinem Streuversuch, dass Atome im Grunde kaum Masse haben und auch fast leer sind. Aus diesem Experiment folgerte Rutherford bis 1911 sowohl Größe von Atomkern und Atomhülle ab. Aus den Ladungsunterschieden konnte er die Ladungen zuordnen und so das Proton entdecken.
1913 - Niels Bohr - Schalenmodell
Der dänische Physiker Niels Bohr entwickelt Rutherfords Atommodell weiter. Sein Modell ähnelt dem Planetenmodell und deren Bewegung. Nach Bohr bewegen sich Elektronen auf festgelegten Bahnen (Schalen) um den Atomkern (vergleichbar den Planeten, die um die Sonne kreisen). Die Abstände zwischen den Schalen folgte dabei streng-mathematischen Gesetzmäßigkeiten.
Auch erkannte Bohr, dass Atome voll besetze Schalen anstreben. Schon 1916 begann Bohr zusammen mit dem deutschen Arnold Sommerfeld das Modell zu verbessern. Heute gilt dieses Modell dennoch als veraltet.
1913 - H. G. J. Moseley
Moseley findet eine Ursache für die Diskrepanz zwischen Ordnungszahl und Atommassen.
1918 - W. Aston
Durch seine Forschungen kann er die Existenz von Isotopen beweisen.
1924 - W. Pauli
Pauli formuliert das Pauli-Verbot welches Schrödinger und Heisenberg dann für ihr Atommodell nutzen.
1929 - Erwin Schrödinger und Werner Heisenberg - Das Orbitalmodell
Schrödingers forschte vorher an der Wellenmechanik und Heisenbergs an der Matrizenmechanik. Zusammen formulierten sie darauf aufbauend ein modernes Atommodell, die Orbitaltheorie.
1927 - Werner Heisenberg
Heisenberg formuliert seine „Unschärferelation“, nach der man nicht gleichzeitig Aufenthaltsbereich und Geschwindigkeit eines Teilchens bestimmen kann.
1929 - Ernest O. Lawrence - Bau des ersten Teilchenbeschleunigers (das Zyklotron)
Um noch mehr Informationen über Atomkerne zu erhalten, will Lawrence Atomkerne mit Strahlen beschießen. Von der Beschleunigung durch ein Magnetfeld auf einer kreisrunden Bahn wird das geladene Teilchen beschleunigt.
1932 - James Chadwick entdeckt das Neutron
Durch seine Experimente beweist er die Existenz von Neutronen.
1932 - Paul Dirac und David Anderson - Antimaterie
Der Physiker Paul Dirac stellte eine Formel zur Masse des Universums auf. Diese lässt sich mathematisch sinnvoll aber nur lösen, wenn Materie mit negativer Masse zugefügt wird. Diese sogenannte Antimaterietheorie stieß auf heftigen Widerspruch bis amerikanische Physiker Anderson positive Elektronen (= Positronen) in kosmischer Strahlung nachwies. Treffen ein Elektron und ein Positron zusammen, zerstrahlen als Energie.
1933 - Marie und Pierre Curie - Materie aus dem Nichts
Die Curies beobachteten einerseits, dass sich Masse in Energie umwandeln lässt (gemäß Einsteins Formel: E = mc2). Desweiteren entdeckten sie, dass ein Lichtstrahl sich in ein Elektron und ein Positron „spalten“ lässt.
1938 - Otto Hahn und Lise Meitner - Entdeckung der Kernspaltung
Der deutsche Otto Hahn war Schüler Rutherfords und beschoss Uran-Atome mit Neutronen. Dabei bildeten sich die Elemente Cäsium und Rubidium oder auch Strontium und Xenon. Seine Mitarbeiterin Lise Meitner, die vor den Nazis nach Schweden geflohen war, fand die Lösung, indem sie die Massen der neuen Elemente addierte und feststellte, dass die Massen an Neutronen und Protonen mit den des Urans übereinstimmt. Otto Hahn erhielt dafür den Nobelpreis. Lise Meitner wurde von ihm nie mehr erwähnt.
1938 - Hans Bethe - Kernfusion in der Sonne
Bethe veröffentliche einige Arbeiten zum Aufbau der Atome und erforschte dann die Fusion von Wasserstoffatomen zu Helium in der Sonne. Er fand auch heraus, dass in größeren Sternen Kohlenstoffatomkerne zu Stickstoffatomkernen umgewandelt werden. Dadurch leuchten diese Sterne heller.
1942 - Enrico Fermi - Der erste Kernreaktor
Der italienischer Enrico Fermi nutzte als Erster die Kernspaltung um damit eine Kettenreaktion in Gang zu bringen. Jedes Neutron, welches bei der Spaltung von Uranatomen frei wurde, spaltete neue Uranatome. Dabei wurde sehr viel Energie frei. Fermi war somit der Wegbereiten einerseits für die Atomkraft, der nuklearen Stromgewinnung aber auch der Atombombe!
1942 - Werner Heisenberg - Atomforschung im dritten Reich
Heisenberg sollte für die Nazis eine Atombombe entwickeln. Ob absichtlich oder unabsichtlich, er verrechnete sich bei der notwendigen Menge an spaltbarem Material (der kritischen Masse) um den Faktor 1000. Seine Forschungen blieben ohne Erfolg.
1942 - Albert Einstein und Leo Szilard bringen Präsident Roosevelt dazu eine Atombombe zu bauen
Durch einen Brief an den US-Präsidenten Roosevelt bringen die Forscher die US-Regierung dazu, ein Atombombenprojekt zu starten.
1945 - J. Robert Oppenheimer baut die erste Atombombe
Oppenheimer sammelte in Los Alamos, Texas, die besten Physiker und Ingenieure. Es wurde auch das Manhattan-Projekt genannt. Sie bauten die beiden Atombomben, welche dann in Hiroshima und Nagasaki zum Einsatz kamen. Nach dem Abwurf wurde Oppenheimer zum Gegner der nuklearen Kriegsführung.
1952 - Edward Teller - Die Wasserstoffbombe
Oppenheimers Mitarbeiter, der ungarische Physiker Teller entwickelte die erste Wasserstoffbombe. Mit dieser fand eine Kernfusion von Wasserstoffatomen statt, die Energiemengen, die dabei freiwerden sind enorm!
1951-59 - Kimball und Kollegen
Sie berechnen die ersten Molekülorbitale und stellen die gültige Molekülbindungstheorie auf.
1960 - Donald A. Glaser - Die Blasenkammer zählt Elementarteilchen
Die Entwicklung der Blasenkammer war die erste Möglichkeit, Elementarteilchen und deren kleineren Bausteine aus Teilchenbeschleunigern sichtbar zu machen.
1964 - Murray Gell-Mann - Quarks
Durch die Blasenkammer konnten Physiker nun viele neue, bisher unbekannte Teilchen kennenlernen. Zum Teil stellen diese Teilchen einen Widerspruch zur bis dahin geltenden Physik dar. Gell-Mann ging von Kernbausteinen aus, welche aus Grundbausteinen aufgebaut sind. Eines dieser Teilchen ist das sogenannte „Quark“, was sich einzeln aber nicht beobachten lässt.
1995 - Eric Cornell, Wolfgang Ketterle und Carl Wiemann - Das Bose-Einstein-Kondensat
Die Wissenschaftler kühlten ein Gas aus Rubidiumatomen sehr nahe an den absoluten Nullpunkt (10−7Kelvin) ab. Dabei nimmt es einen sehr merkwürdigen Aggregatzustand ein. Man nennt dies das „Bose-Einstein-Kondensat“. Diesen Zustand der Materie hatte bereits Einstein vorhergesagt. Dieser extreme Aggregatzustand führt zu Eigenschaften wie Suprafluidität, Supraleitung oder Kohärenz.
2000 - CERN - Das Higgs-Boson
Das schweizer Cern forscht mit vielen Wissenschaftler aus der ganzen Welt nach dem Higgs-Boson Teilchen, welches viele ungeklärte Fragen der theoretischen Physik erklären würde. Das Besondere an dem Teilchen ist, dass es elektrisch neutral ist und den Spin 0 hat. Es zerfällt nach sehr kurzer Zeit!
Im Juli 2012 wurde vom CERN dann der den Nachweis eines solchen Teilchens bekanntgegeben. Zumindest ist es sehr wahrscheinlich, dass man es gefunden hat. Da sein Nachweis so kompliziert ist, geht man davon aus, dass der absolute Nachweis durch Auswertung der bisherigen Experimente noch Jahre dauern wird.
2002 - Brookhaven - Materie nach dem Urknall
Im Brookhaven (Amerika) lässt man in einem Schwerionenbeschleunigerring Goldionen mit hoher Energie aufeinanderprallen. So bildet sich für einen kurzen Moment das „Quark-Gluonen-Plasma“. Dieser Materiezustand soll vermutlich kurz nach dem Urknall vorgelegen haben.
Die symbolische Schreibweise und die Elementarteilchen
Im Periodensystem der Elemente werden die Atome in einer besonderen Schreibweise dargestellt.
Sie ist leicht zu verstehen:
4 Massenzahl oder Nukleonen(an)zahl => Zahl an Protonen und Neutronen
He
2 Ordnungszahl (bzw.: Kernladungszahl) => Zahl der Protonen => Zahl der Elektronen
Die Anzahl an Neutronen kannst Du leicht durch folgende Überlegung bestimmen:
Nur Protonen und Neutronen haben eine Masse. Sie ist in der Massenzahl wiedergegeben! Die Ordnungszahl gibt dabei die Zahl der Protonen an. Durch Subtraktion kannst Du so leicht die Neutronenzahl bestimmen:
Neutronenzahl = Massenzahl - Ordnungszahl
=> He besteht aus: 2 Protonen, 2 Elektronen und 2 Neutronen
Mithilfe der symbolischen Schreibweise und den Angaben aus dem Periodensystem kann man leicht errechnen, wie viele Elementarteilchen in jedem Atom vorhanden sind.
7
Li
3
=> Li besteht aus: 3 Protonen, 3 Elektronen und 4 Neutronen
Aufgaben:
1. Berechne für folgende Beispiele die Anzahl an Elementarteilchen: Na, Mg, Ca, Ba, Al, I.
Anordnung der Elementarteilchen im Atomkern
Nachdem Du nun weißt, welche Elementarteilchen im Atom zu finden sind, wird es Zeit, sich Gedanken über deren Anordnung zu machen. Doch Vorsicht, niemand kann ganz genau erklären, wie es im Atom aussieht und man braucht sehr viel Vorstellungskraft, um sich nur ein ungefähres Bild davon zu machen. Vielleicht helfen Dir die angegebenen Vergleiche. Zusätzlich erschwerend ist, dass es verschiedene Modelle zu diesen Vorstellungen gibt (sogenannte Atommodelle), die historisch natürlich nacheinander entstanden sind. In Schulbüchern ist oft das Atommodell von Niels Bohr genannt - lass Dich dadurch nicht verwirren. Es ist falsch3!
Aufbau des Wasserstoffatoms:
Das Wasserstoffatom hat ein Proton und demzufolge ein Elektron.
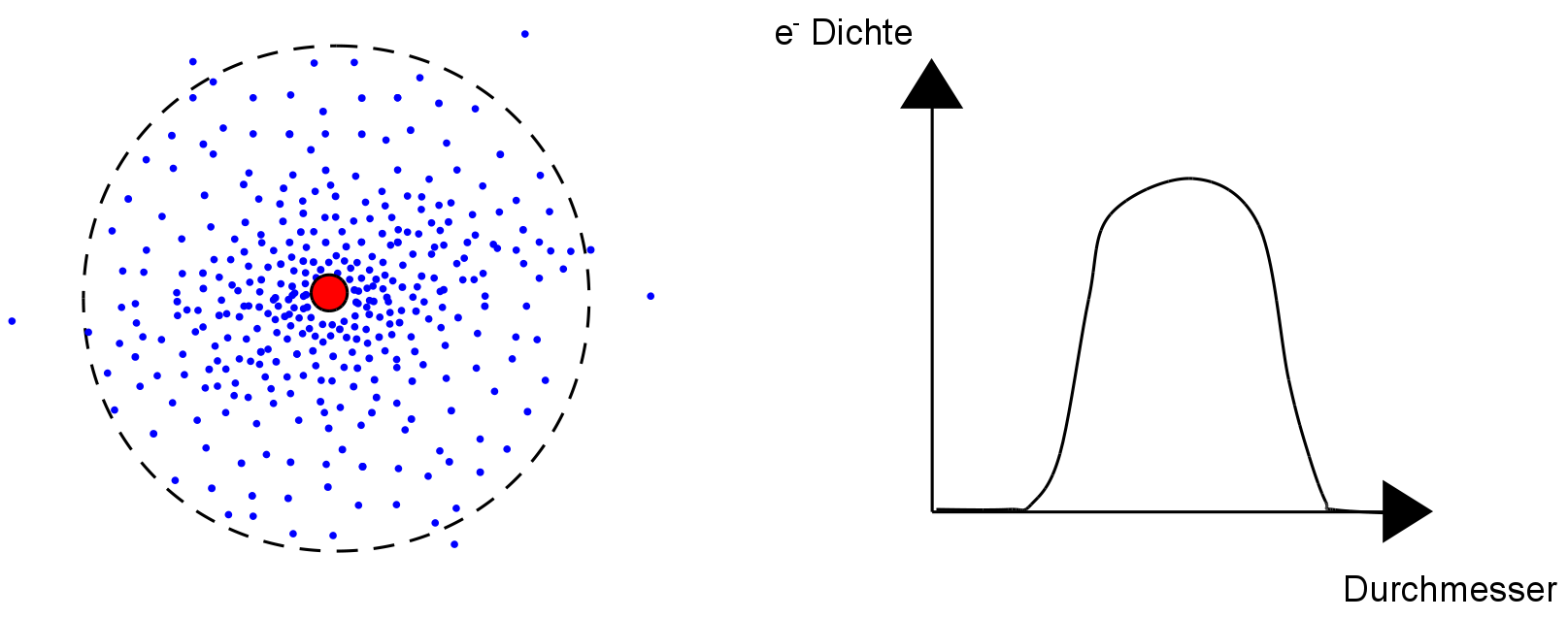
Im Zentrum des Atoms befindet sich der Atomkern, er enthält ein Proton. Um ihn herum bewegt sich ein einzelnes Elektron. Das Elektron bewegt sich um den Kern und hat demzufolge immer unterschiedliche Abstände zum Atomkern. Da es sich zu 95% fast immer innerhalb eines bestimmten Abstandes um das Atom bewegt und dieser einer Art Kugel gleicht, spricht man auch von einer Elektronenhülle oder Elektronenwolke oder auch einem Atomorbital. Die Form ist dabei immer von der Aufenthaltswahrscheinlichkeit des Elektrons abhängig.

Frei bewegliche Elektronen umkreisen den Atomkern. Der Bereich, den sie dabei meistens nutzen ist leer und er hat keine Materie oder eine Grenze. Dieser Aufenthaltsbereich trägt viele Namen: Elektronenhülle, Elektronenwolke, Elektronenschale (veraltet).
b) Aufbau des Lithiumatoms
Das Lithiumatom hat drei Protonen, vier Neutronen und drei Elektronen.
Die Neutronen sind ungeladen und befinden sich zwischen den Protonen. Eine Modellvorstellung beschreibt sie als „Protonenkitt“, also als Klebstoff, der die sich abstoßenden positiven Protonen im Kern zusammenhält.
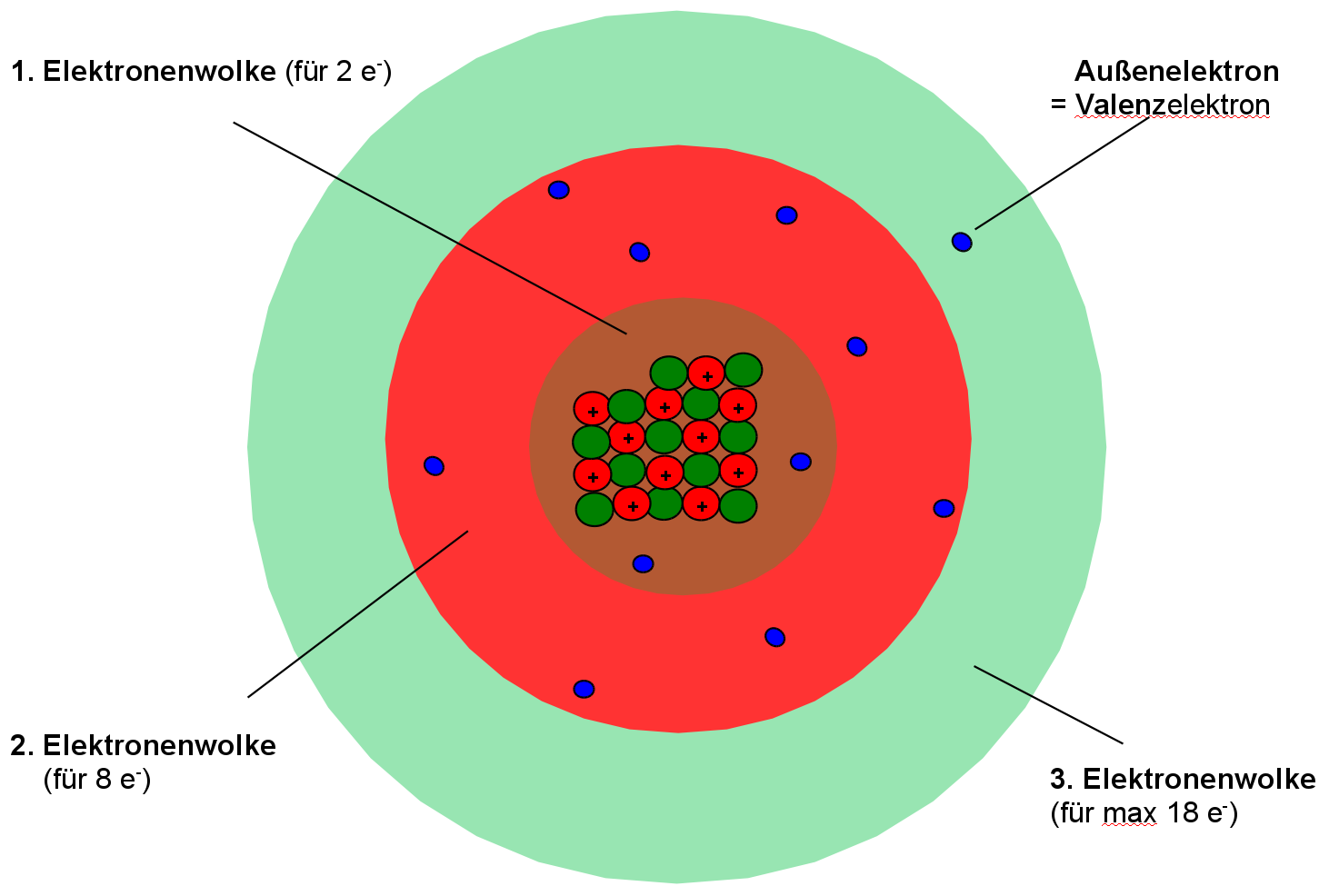
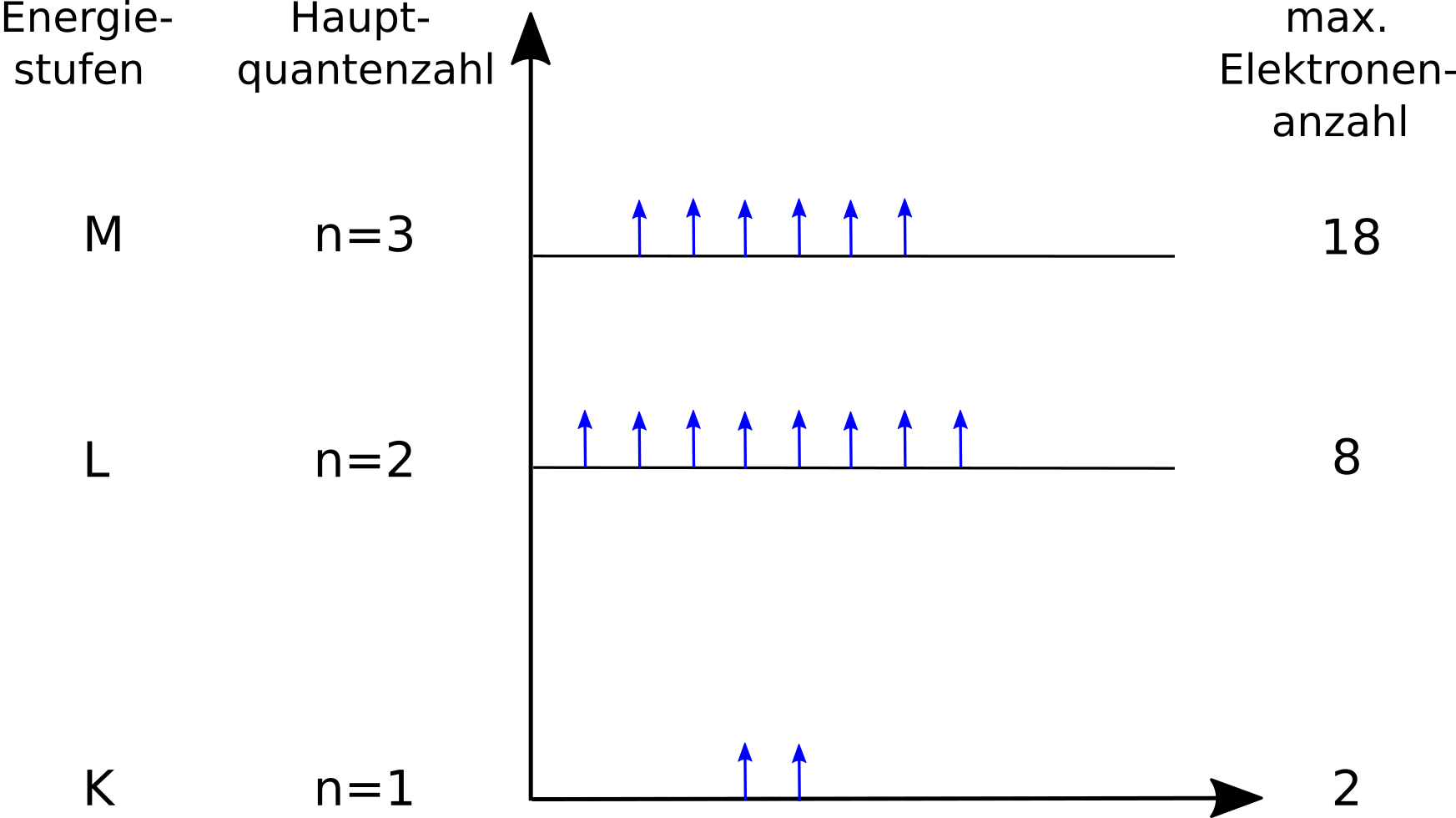
Nicht alle Elektronen können sich gleich weit vom Atomkern entfernen. Also gibt es durch die unterschiedlichen Aufenthaltswahrscheinlichkeiten auch unterschiedliche Elektronenhüllen / Elektronenwolken. In der ersten Elektronenhülle ist nur „Platz“ für zwei Elektronen. Wenn sie voll besetzt ist, dann entsteht automatisch eine neue. In jeder weiteren ist Platz für mindestens 8 Elektronen. Die Elektronen der äußersten Hülle nennt man auch Valenzelektronen oder Außenelektronen.
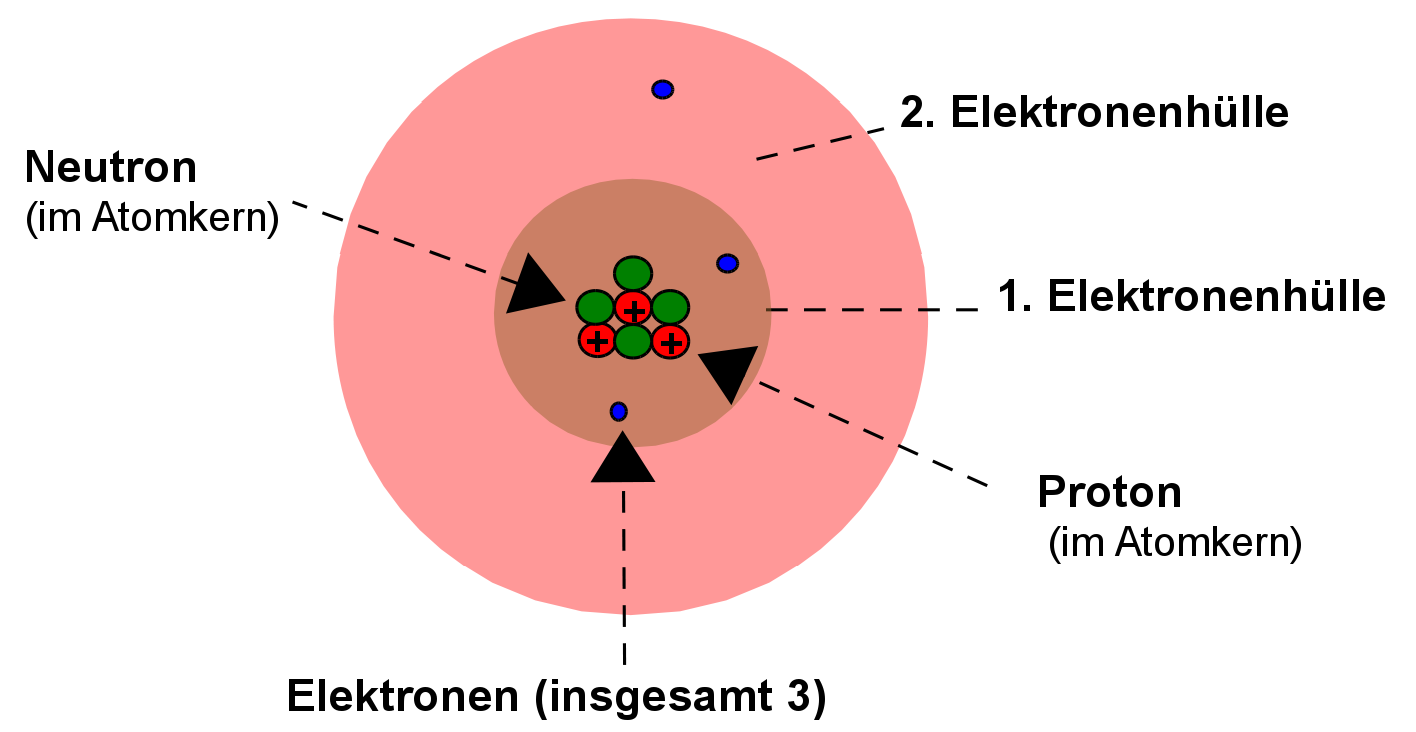
Die Anordnung der Elektronen nennt man Elektronenkonfiguration.
Welche Bedeutung hat die äußere Elektronenhülle?
Bei fast allen Elementen liegen mehrere Elektronenhüllen vor. Bei chemischen Reaktionen sind in der Regel nur die Elektronen der äußeren Hülle, die sogenannten Valenzelektronen beteiligt. Sie können besonders gut reagieren, wohingegen weiter innen liegende Elektronen von den Valenzelektronen abgeschirmt sind d nicht reagieren.
Elemente mit der gleichen Anzahl an Valenzelektronen haben auch die gleiche Hauptgruppennummer und auch meist ähnliche Eigenschaften.
c) Aufbau des Das Kohlenstoffatoms (C):
Das Kohlenstoffatom hat 6 Elektronen, 6 Neutronen und 6 Protonen:

d) Aufbau des Natriumatoms (Na)
Das Natriumatom hat 11 Elektronen in drei Elektronenwolken. Wie Du erkennen kannst, sind die Elektronenwolken farbig gezeichnet, entsprechend den Farben der Perioden Deines PSE gefärbt.
Zusatzinformationen: Atombau
https://de.wikipedia.org/wiki/Atommodell
https://de.wikipedia.org/wiki/Elementarteilchen
Wichtige Aufgaben:
- Zeichne selbst den Aufbau der folgenden Atome: H, He, Li, Na, Mg, Ca, Ba, Al, I
- Erkläre den Zusammenhang zwischen der Anzahl an Elektronenwolken und der Periodennummer.
- Erkläre den Zusammenhang zischen der Anzahl an Valenzelektronen und dem PSE.
- Eine schwere Frage: Wie erklärst Du Dir, dass das Verhältnis von Protonen zu Neutronen bei Zunahme der Ordnungszahl kleiner wird (z.B. Kohlenstoff hat 6p+ und 6n => 1:1=1; Blei hat 82p+ und 126n => 82:126=0,65)?
Geschichtliche Entwicklung der Modelle zum Aufbau der Elektronenhülle
Aufgabe: Lese den Text und entwickele eine eigene gezeichnete Modellvorstellung
Chemiker kennen heute viele Modelle zum Beschreiben der winzigen Atome. Jedes Modell hat Vor- und Nachteile. Lass Dich nicht durch die Vielfalt verwirren und benutze immer das, was Du in der Schule gelernt hast. Letztlich sind alles Modelle, die nur etwas nicht sichtbares verdeutlichen sollen. Aber es ist gar nicht so einfach, sich das immer vorzustellen.
1 913 Niels Bohr:
„Elektronen kreisen als Teilchen auf Bahnen (plantengleich)
um den Atomkern“. Jede Bahn entspricht dabei einem bestimmten
Energiezustand des Elektrons.
1924 Louis de Broglie:
„ Jedes sich bewegende Teilchen, hat neben den Teilcheneigenschaften auch Welleneigenschaften.“ (Diese werden wichtiger, je kleiner das Teilchen wird) (=Welle-Teilchen-Dualismus).
=> Elektronen (auch Photonen) haben: - Teilcheneigenschaften
- Welleneigenschaften (Beweis: ihre Wellenlänge ist messbar!)
Vergleich dies mal mit einer Interferenz (=Auslöschung von Wellen gleicher Wellenlänge):
Wellen können sich auslöschen, für Teilchen gilt das nicht. Je nach Experiment und Aufbau kann man also vom Teilchen- oder Wellencharakter der Elektronen ausgehen.
=> Da Bohr nur den Teilchencharakter des Elektrons berücksichtigt hat, haben seine Schlussfolgerungen also mindestens 50% Fehler. ;-)
1926 Heisenberg:
„Wenn de Broglie recht hat, kann man nicht die Position und die Geschwindigkeit eines Elektrons bestimmen, da man nicht gleichzeitig beides messen kann! (=Unschärferelation).
=> die Wellenlänge ändert sich.
Heisenbergs Messung im Vergleich mit einer Radarfalle:
Photonen zu Messung sind sehr klein, aber nicht soviel kleiner als Atome… Eine Messung mit einem ähnlich großen Teilchen verändert leider die Messergebnisse. Stell Dir folgendes vor:
Die Polizei misst die Geschwindigkeit von Autos in der Stadt. Um ein Objekt zu sehen, brauchen wir Licht. Die Lichtenergie beschleunigt aber das Objekt. Würde man nun ein Auto mit Lichtblitzen wie mit 800 kg Geschossen blitzen, würde das Auto viel schneller oder gebremst werden, je nachdem von wo die Polizei misst. Somit wäre der Polizei zwei die Position während der Messung klar, aber nicht seine Geschwindigkeit.
=> Man kann nicht wissen, wie sich kleine Teilchen, wie z.B. Elektronen bewegen. Somit ist auch sicher, dass sie sich nicht auf Bahnen (siehe Bohr) bewegen.
Man kann aber sagen, dass für so kleine Teilchen, die Gesetze der klassischen Mechanik nur beschränkt Gültigkeit haben. Dies macht eine eigene Vorstellung für Chemiker so schwierig.
1928 Schrödinger:
Der Aufenthaltsbereich des Elektrons (e-) ist die sogenannte Elektronenwolke1 (=Orbital):
Eine alternative Vorstellung zur Verteilung der Elektronen in der Atomhülle nach Schrödinger
Was Du bis hier gelesen hast, reich mindestens an Modellvorstellung bis zur Oberstufe. Dort wirst Du unter Umständen eine Erweiterung des Atommodells lernen. Hier ein Ausblick für alle neugierigen Naturwissenschaftler. Aber keine Angst, wenn Du es nicht verstehst! Die folgenden Seiten sind nur für die Theoriespezialisten!
1. Die Energiezustände der Elektronen:
Betrachtest Du das Licht, welches durch ein Prisma aufgespalten wird, kannst Du verschiedene Farben erkennen. Physiker haben erkannt, das zwischen den verschiedenen Farben und dem Energiegehalt des Lichts ein Zusammenhang besteht (genau genommen zwischen der Wellenlänge und dem Energiegehalt). So ist z.B. UV-Licht besonders energiereich.
Beobachten kann man dies auch durch einen Versuch zur Brennerflammenfärbung mit verschiedenen Salzen.
a) Flammenfärbung
V: Lithium, Natrium und Kalium-Salzlösung werden auf einem Magnesiastäbchen in die Brennerflamme gehalten.
B: Die Brennerflamme färbt sich.
S: Die Li, Na, K - Atome geben Energie in Form von Licht ab.
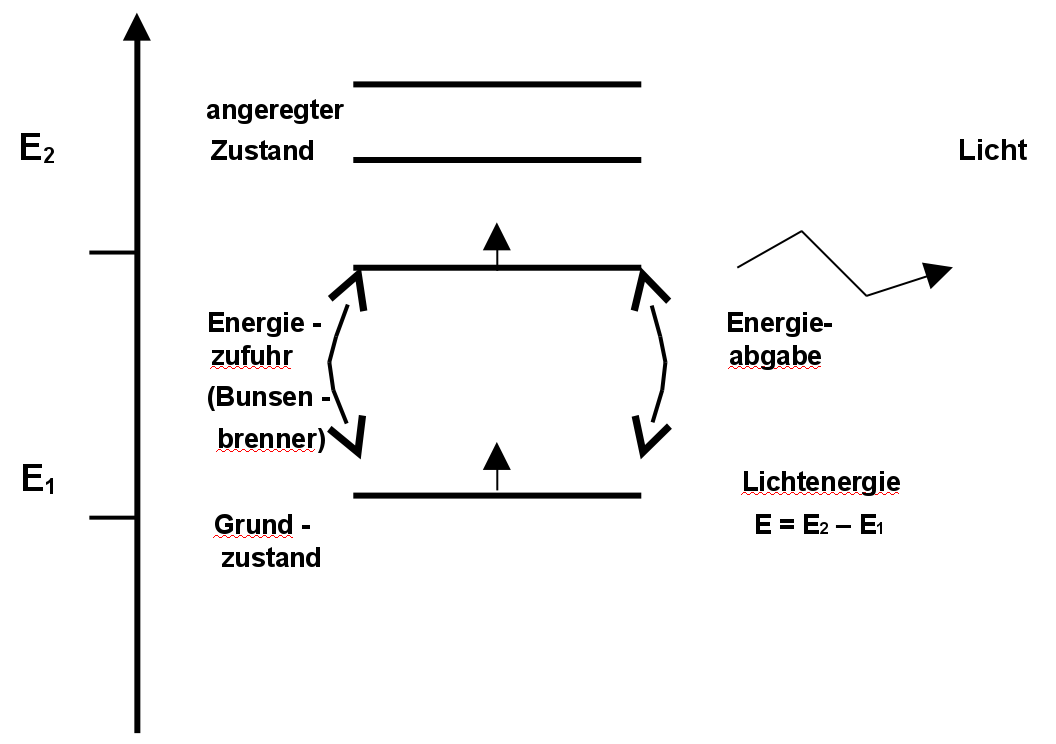
Folgendes Schema zum Energiegehalt erklärt, warum Licht abgegeben wird:
Erklärung zur Flammenfärbung
Bringt man z.B. Natriumsalze in die Brennerflamme, so nehmen die Natriumatome Wärmeenergie der Flamme auf. Dadurch erreichen einige Elektronen einen höheren Energiezustand, den sogenannten angeregter Zustand. Auf diesem Zustand können Elektronen aber nicht lange verweilen. Sie kehren in den Grundzustand zurück und geben diese vorher aufgenommen Energie nach kurzer Zeit in z.B. Form von Licht wieder ab. Ursache ist, dass die Elektronen die Energie nicht behalten können (Energieerhaltungssatz).
Modellvorstellung: Wenn man sich vorstellt, dass die Elektronen sich durch die ursprüngliche Energieaufnahme etwas schneller bewegen und sich so weiter vom Kern entfernen können, hat man eine einfache Vorstellung der Vorkommnisse. Fallen die Elektronen in den Grundzustand zurück, werden sie langsamer und geben die nun nicht mehr benötigte Energie wieder ab.
=> Jedes Elektron hat einen bestimmten Energiezustand, dieser ist jeweils von der Entfernung zum Kern abhängig.
Übung: Flammenfärbung
Welche Energieformen kennst Du bereits, die bei chemischen Reaktionen eine Rolle spielen?
Wärmeenergie, Schallenergie, Bewegungsenergie, Lageenergie, Lichtenergie, usw.)
Material je Gruppe: Magnesia-Stäbchen, Bunsenbrenner, evtl. Tiegelzange
Testsubstanzen, Spatel, Pinzette, verd. HCl, ca. 8 beschriftete Schälchen.
V: Glühe ein Magnesiastäbchen aus und tauche es kurz in eine leicht saure Lösung, die jeweils eines der folgenden Salze enthält: Natriumnitrat, Natriumcarbonat, Kaliumcarbonat, Kaliumchlorid, Calciumsulfat, Calciumcarbonat, Strontiumnitrat.
Bariumnitrat. Dann halte das Stäbchen in die Brennerflamme. Notiere alle Beobachtungen in Tabellenform:
|
Salz |
Formel |
Farbe |
|
Natriumnitrat |
NaNO3 |
gelb |
|
Natriumchlorid |
NaCl |
gelb |
|
Natriumcarbonat |
Na2CO3 |
gelb |
|
Kaliumcarbonat |
K2CO3 |
rotorange |
|
Kaliumchlorid |
KCl |
rotorange |
|
Calciumsulfat |
CaSO4 |
rot |
|
Calciumcarbonat |
CaCO3 |
rot |
|
Calciumchlorid |
CaCl2 |
rot |
|
Strontiumnitrat |
Sr2NO3 |
tiefrosarot |
|
Strontiumchlorid |
SrCl2 |
tiefrosarot |
|
Bariumnitrat |
Ba(NO3)2 |
grün |
|
Lithiumchlorid |
LiCl |
rot |
|
Bariumchlorid |
BaCl2 |
grün |
Die Flammenfärbung ist jeweils charakteristisch für die Metalle. So lassen sich durch die jeweilige Farbe auch unbekannte Stoffproben anhand ihrer Flammenfarbe identifizieren!
Flammenfarben der Alkali- und der Erdalkalimetalle
V: Ein Magnesiastäbchen wird in der Brennerflamme ausgeglüht und dann in eine Salzlösung getaucht, die eines der folgenden Salze enthält. Das Magnesiastäbchen wir nun erneut in die Flamme gehalten, Die Flammenfarbe wird notiert.
B:
Lithium: rot
Natrium: orange-gelb
Kalium: violett (Kobaltglas!)
Strontium: pink-rot
Barium: blassgrün
Calcium: ziegelrot
S: Wie auf den vorherigen Seiten schon erklärt, nehmen Teilchen die Wärmeenergie auf, welche dazu führt, dass Elektronen kurzzeitig auf einen angeregten Zustand gelangen. Beim zurückkehren in den normalen Zustand geben sie die überschüssige Energie in Form von Licht wieder ab. Dieses Licht ist Strahlung genau definierter Wellenlängen (und somit genau definierter Farben). Mit einem Spektroskop kann man dies durch charakteristische Spektrallinien sichtbar machen.
Die Energiezustände der Elektronen
Für Schüler, die es ganz genau wissen wollen und mindestens in der 10. Klasse sind, folgen hier einige weitergehende Modellvorstellungen zum Thema Elektronenhülle.
a) Energiestufen und Elektronenverteilung für das Element Schwefel
Aus dem Versuch der Flammenfärbung wird folgendes Energieschema abgeleitet:
Energiestufen-Schema für das Schwefel-Atom
Als Valenzelektronen werden die Elektronen mit der höchsten Quantenzahl bezeichnet (statistisch haben sie den größten Abstand vom Atomkern (Außenelektronen). Der Energiegehalt ist proportional zur durchschnittlichen Entfernung der Elektronen vom Atomkern.
=> Die Valenzelektronen sind die am weitesten vom Kern entfernten Elektronen!
b) Energieniveaus - die Unterteilung der Energiestufen
Feinbau: Energiestufen sind in unterschiedliche Energieniveaus aufgetrennt.
Vergleich: Stockwerke im Haus = Energiestufen. Man kann nicht wechseln! Aber man kann von einem Niveau auf ein anderes wechseln

Energieniveauschema für Schwefel
Besetzungsregeln:
- Die maximale Elektronenzahl für das s-Energieniveau betragt 2 Elektronen, für das p-Energieniveau 6 Elektronen.
- Der Aufbau des Energieniveauschemas erfolgt immer von Unten nach oben, d.h. es werden zuerst die geringen Energieniveaus, dann die hohen Energieniveaus besetzt (1s --> 2s--> 2p --> 3s --> 3p).
- Hinweis: Die VE der ersten und zweiten HG sind immer auf dem s-Energieniveau, die VE der 3.-8. HG sind auf dem p-Energieniveau
Aufgaben:
1. Zeichen die Elektronenkonfiguration der folgenden Elemente: He, Li, C, Ne, S, Ar
2. Stelle die Elektronenkonfiguration unter Berücksichtigung der Energieniveaus für 7N und 11Na auf.
3. Zeige die Unterschiede in Elektronenkonfiguration bei den Isotopen des Kohlenstoffs:
12 14
C und C
6 6
Edelgase und Edelgaskonfiguration
Als „Edelgase“ bezeichnet man die Elemente der 8. Hauptgruppe (Helium, Neon, Argon, Krypton, Xenon und Radon). Edelgase sind im Gemisch Luft zu finden. Nach ihrem Anteil sortiert, steht an erster Stelle Argon. Es folgen Neon, Helium, Krypton und Xenon. Radon tritt nur in kleinsten Mengen als Produkt radioaktiver Zerfallsprozesse auf. Im All findet man neben Wasserstoff sehr viel Helium.
Alle Edelgase sind farb-, geschmack- und geruchlose Gase, die eigentlich nur elementar und einatomig vorkommen. Sie lassen sich in Wasser auflösen und sind aufgrund ihrer Ähnlichkeit und Reaktionsträgheit fast nicht zu unterscheiden. Sie kondensieren erst bei Temperaturen tief unter
-100°C. Helium hat den niedrigsten Schmelz- und Siedepunkt aller Elemente. Aufgrund dieser Eigenschaften wurden sie als Elemente erst sehr spät entdeckt.
|
2He |
10Ne |
18Ar |
36Kr |
54Xe |
|
|
Atommasse [u] |
4,0 |
20,2 |
39,9 |
83,8 |
131,3 |
|
Dichte [g/l] |
0,17 |
0,84 |
1,66 |
3,48 |
5,49 |
|
Schmelzpunkt [°C] |
-272,3 |
-248,6 |
-189,4 |
-156,5 |
-111,8 |
|
Siedepunkt [°C] |
-269,0 |
-246,0 |
-185,9 |
-152,9 |
-107,1 |
|
Leuchtfarbe in Leuchtröhren |
gelb |
rot |
rot |
gelbgrün |
violett |
|
Verwendungszweck |
Füllgas für Zusatz für Atemluft bei Tiefseetauchern |
Leuchtstoffröhren |
Glühlampen- |
Glühlampenfüllgas |
Edelgase (8. HG) sind die reaktionsträgsten Elemente. Alle Edelgase habe eine vollbesetzte Außenelektronenhülle.
Aus der Trägheit der Edelgase folgt, dass eine Anordnung mit voll besetzter Außenelektronenwolke besonders stabil sein muss (=Oktettregel).
Diese Edelgaskonfiguration ist von allen Elementen angestrebt. Entscheidend ist dafür nur die Anzahl an Valenzelektronen (2 bei He oder 8 bei allen anderen!).
Unter besonderen Bedingungen kann man im Labor Xe und Kr zur Reaktion mit anderen Elementen bewegen. Dazu sind sehr hohe (Ionisierungs)-Energien notwendig. Von den leichten Edelgasen Helium, Neon und Argon sind keine Verbindungen bekannt. Linus Pauling wies 1933 schon darauf hin, dass Xenon eine ähnlich (hohe) 1. Ionisierungsenergie wie Sauerstoff hat. 1962 wurde von Bartlett dann mit Xenonhexafluoroplatinat die erste Edelgasverbindung dargestellt. Man kennt heute bereits 32 Edelgasverbindungen:
Beispiele: XeF2,XeF4, XeF6,XeO3, XeO4,XeOF4, KrF2
Isotope des Wasserstoffs
Alle Atome eines Elementes haben die gleiche Ordnungszahl und somit die gleiche Anzahl an Protonen, aber bei einigen Elementen kommt es vor, dass sie sich in ihrer Masse unterschieden.
=> Sie haben eine unterschiedliche Anzahl von Neutronen. Diese Elemente nennt man Isotope.
Zum Beispiel enthält das häufigste Isotop von Wasserstoff keine Neutronen (siehe Tabelle). Sehr selten findet man aber auch ein Wasserstoffatom mit einem Neutron (z.B. in Kernkraftwerken). Man spricht von schweren Wasserstoff. Oder auch von Deuterium.
Ein weiteres Isotop hat zwei Neutronen. Es heißt Tritium.
Übersicht über die bekanntesten Wasserstoffisotope:
|
1 H 1 |
2 H 1 |
3 H 1 |
|
|
Name |
Wasserstoff |
Deuterium |
Tritium |
|
Kernteilchen |
1p+ / 0 n |
1p+ / 1 n |
1p+ / 2 n |
|
Häufigkeitsverteilung |
1 : 0,00015 : 1·10-18 |
||
|
Massenzahl |
2,015 |
4,028 |
6,032 |
|
Smp [°C] |
-259,20 |
-254,43 |
-252,53 |
|
Sdp [°C] |
-252,77 |
-249,58 |
-248,11 |
Die Isotope des Wasserstoffes sind also durchaus durch ihre Eigenschaften zu unterscheiden3.
Isotope gibt es nicht nur vom Wasserstoff:
35 37
Cl Atommasse = 34,969u Cl Atommasse = 36,996u
17 17
Atome gleicher Ordnungszahl, aber unterschiedlicher Neutronenanzahl nennt man Isotope.
Im PSE ist immer die mittlere Atommasse angegeben.
Zusatzinformationen: Isotope
In der Regel besitzt jedes natürlich vorkommende Element ein oder wenige stabile Isotope, während die anderen Isotope radioaktiv (das heißt instabil) sind und früher oder später zerfallen. Es gibt jedoch auch Elemente, bei denen alle Isotope instabil sind und zerfallen.
- Mit 10 stabilen Isotopen hat Zinn die meisten natürlich vorkommenden Isotope.
- Bei 20 Elementen, den sogenannten Reinelementen, gibt es nur ein einziges stabiles Isotop.
- Diese Elemente sind: Beryllium, Fluor, Natrium, Aluminium, Phosphor, Scandium, Mangan, Kobalt, Arsen, Yttrium, Niob, Rhodium, Iod, Cäsium, Praseodym, Terbium, Holmium, Thulium, Gold, Bismut.
- Ein bekanntes Isotop ist 14C, das zur Altersbestimmung von organischen Materialien in der Archäologie benutzt wird (Radiokarbonmethode). Kohlenstoff liegt hauptsächlich als stabiles Isotop 12C vor.
- Bei natürlich vorkommenden Isotopen, hat ihr Verhältnis immer den gleichen Wert.
Chlor besteht z.B. immer aus 75,77% aus 35Cl (34,969u) und 24,23% 37Cl (36,996u).
Berechnung mittlere Atommasse:
Im Periodensystem sind die Massenzahlen oft mit mehreren Nachkommastellen angegeben. Sicher hast Du Dich schon gefragt, warum das so ist, denn eigentlich sollten die Angaben ja ganzzahlig sein, da Neutronen und Protonen die genau Masse von 1u haben.
Tatsächlich aber berücksichtigt die Massenzahl im PSE das Verhältnis der vorkommenden Isotope:
35Cl: 75,77%
37Cl: 24,23% => mittlere Atommasse: 35,453u4
Zusatzinformationen: https://de.wikipedia.org/wiki/Isotope
Das Periodensystem der Elemente: Die Geschichte des PSE
Demokrit (460-370 v. Chr.)
Der Grieche vermutete, alleine durch Beobachtungen der Natur, dass es Aufbausteine für alle Stoffe (heute würde man sie Atome nenne) gibt.
Robert Boyle (1627-1691)
Der Engländer zeigte als erster, das nicht Feuer, Wasser, Erde und Luft die chemischen Elemente sind. Er vermutete, dass es mehr geben muss. Sonst wäre die Vielfalt der Natur nicht zu erklären. Er vermutete, dass man Stoffe, die man nicht mehr in zwei verschiedene andere Stoffe umwandeln kann Elemente sind. So kann man pflanzlichen Zucker durch Erhitzen in Kohlenstoff umwandeln. Diesen konnte er aber nicht weiter zersetzen, so bestimmte er, dass Kohlenstoff ein Element sei.
Antoine Lavoisier (1743-1794)
Der Franzose Lavoisier übernahm Boyles Elementdefinition und erweiterte sie. Er unterschied Elemente (matière) und deren Fähigkeit Verbindungen zu bilden (principe).
Es gibt also nach Lavoisier keine Stoffe, in denen matière und principe zusammenfielen.
William Prout (1785-1850) und Jeremias Benjamin Richter (1762-1807)
Der Engländer Prout und der deutsche Richter stellen die Gesetzte der einfachen und vielfachen Massenverhältnisse auf. So reagieren 2g Schwefel immer mit 2g Sauerstoff zu 4g Schwefeldioxid oder auch (bei anderen Reaktionsbedingungen) mit 3g Sauerstoff zu 5g Schwefeltrioxid.
John Dalton (1766-1844)
Der Engländer stellte eine Atomhypothese auf, die Atome und ihre Reaktionen beschrieb. Er verband diese mit den Massengesetzen von Prout und Richter, um sie zu erklären.
Jöns Jakob Freiherr von Berzelius, (1779-1848),
Der Schwede Berzelius nannte Reinstoffe, die nicht durch eine Vereinigung entstanden sind „Elemente“. Stoffe, die durch eine Vereinigung entstehen, nannte er „Verbindung“. Er stellte die noch immer gültige Definition auf:
„Ein Element ist ein Reinstoff, der nicht weiter zersetzt werden kann“. Für Elemente legte er neue Symbole fest, die sich vom lateinischen oder griechischen Namen ableiteten (z.B. Wasserstoff = Hydrogenium = H).
Da man nun endlich die Kenntnisse der Chemie vernünftig ordnen konnte, wurde der Wunsch nach einem einheitlichen Ordnungssystem immer größer.
Dimitri Mendelejew (1834-1907) und Lothar Meyer (1830 - 1895)
Der Russe Mendelejew und der Deutsche Lothar Meyer ordneten 1869 als erstes die damals ca. 60 bekannten Elemente nach ihrer Masse. Allerdings fiel auf, dass sich manchmal Eigenschaften der Elemente wiederholten. Diese Elemente schrieb Mendelejew übereinander. So kam er zu einer tabellarischen Anordnung von 7 Gruppen. Manchmal erhielt er allerdings Lücken in seiner Tabelle. Er vermutete, dass es noch unentdeckte Elemente geben musste. (Germanium, Gallium und Scandium). Die 8. Gruppe des PSE (Edelgase) konnten sie nicht aufstellen, da die Edelgase noch nicht entdeckt waren.
Niels Bohr (1885-1962)
Der Däne Bohr forschte an einzelnen Atomen und beschäftigte sich mit deren Zusammensetzung. Er stellte ein nach ihm benanntes Atommodell auf. Gleichzeitig fing er an diese Atome nach ihrer Anzahl an Protonen zu ordnen. (Henry G.J. Mosley bestimmte 1913 mithilfe von Röntgenstrahlen erstmalig die Anzahl an Protonen in Atomen). Deshalb nannte er die Protonenzahl auch Ordnungszahl.
Dieses neue Periodensystem war dem von Mendelejew sehr ähnlich. Nur geringe Änderungen mussten vorgenommen werden.
Die historische Entwicklung des Periodensystems der Elemente (=PSE)
Dmitri Iwanowitsch Mendelejew (8.2.1834- 2.2.1907) war ein russischer Chemiker und Universitätsprofessor, der auf der Suche nach einer Systematik der chemischen Elemente war. Er war sehr umfassend gebildet und sprach neben russisch auch deutsch und französisch.
Zwischen 1859 und 1861 arbeitete er in Paris über die Dichte der Gase und an der Universität Heidelberg beschäftigte er sich bei Gustav Robert Kirchhoff mit der neuen Untersuchungsmethode der Spektroskopie.
Er promovierte 1865 in Chemie in Sankt Petersburg. Sein Bestreben war, die damals bekannten 63 Elemente in einem System zu ordnen. Eine Hilfe war, dass 1866 ein Kollege, der Chemiker John A.R. Newland, das Oktavgesetz vorschlug:
„Wenn die Elemente nach steigender relativerAtommasse geordnet werden, dann ist das achte Element dem ersten ähnlich.“
Dmitri Mendelejew und der Deutsche Lothar Meyer griffen 1869 dieses Gesetz auf und ordneten die Elemente in einer sich periodisch wiederholenden Anordnung in 7 Gruppen an. Mendelejew ordnete die Elemente dabei so an, dass ähnliche Merkmale in den gleiche Gruppen zusammenstehen. Damit dies aber immer aufging, musste er noch 3 Felder frei lassen. Er vermutete, dass diese drei Elemente noch nicht entdeckt waren. Durch seine genauen Forschungen konnte er für diese unbekannten Elemente (Gallium, Scandium und Germanium) allerdings schon einige Vorhersagen über ihre Eigenschaften treffen. Hier zeigte sich sein wahres Genie. Seine Vorhersagen zu Schmelz- und Siedepunkten waren von großer Genauigkeit und Präzision.
Mendelejew war aber auch in anderen Bereichen aktiv. Er gilt heute als Vater der russischen Ölindustrie, da er bereits um 1860 Ölfelder bei Baku in Aserbaidschan besuchte und den Wert des Erdöls erkannte. 1876 reiste er nach Amerika, um in Pennsylvania die dortige Ölförderung zu studieren und um so diese Technik nach Russland zu holen. Er veröffentlichte seine Ergebnisse später in dem Buch: „Die Erdölindustrie in Pennsylvania und im Kaukasus“.
1867 wurde er Professor für Chemie an der Universität Sankt Petersburg. Als Professor war Mendelejew sehr angesehen. Er galt als Freidenker und Liberaler. Seine Vorlesungen waren auch für Frauen zugänglich, was damals nicht üblich war.
Am 6. März 1869 veröffentlichte er das Periodensystem der Elemente (PSE) unter dem Titel „Die Abhängigkeit der chemischen Eigenschaften der Elemente vom Atomgewicht“.
Damit vollendete Mendelejew vorläufig die 50-jährige Suche nach einem Zusammenhang zwischen den Atommassen und den chemischen Eigenschaften der Elemente. Zu seinen Ehren bekam das Element 101 den Namen Mendelevium.
Allerdings trat er von seiner Professur aus Protest gegen neue Gesetze, die die Universitäten zu stark einschränkten zurück. 1893 übernahm er das Amt des Direktors des Russischen „Amts für Maße und Gewichte“, wo er verantwortlich für die Einführung des metrischen Systems in Russland war.
In zwei Punkten lag Mendelejew leider falsch. Die Anordnung der Elemente ____ und ____ sowie ____ und ____ nach ihrer relativen Atommasse entsprach nicht der Anordnung nach ihren Eigenschaften. Man findet im heutigen PSE sogar noch ein weiteres Paar: ____ und ____ .
Die Auflösung war erst möglich, als Henry G.J. Mosley 1913 begann das PSE nach der Anzahl an Protonen/ Elektronen zu ordnen. mithilfe von Röntgenstrahlen gelang es ihm die Ordnungszahl der Elemente zu bestimmen und das heute gültige PSE, geordnet nach der Protonenzahl, aufzustellen.
Heute gelten folgende Regeln:
Das PSE ist nach steigender _______________und nicht nach steigender ____________ angeordnet. Dabei stehen Elemente mit ähnlichen ______________ übereinander. So ergibt sich ein Aufbau des PS in ________________ und ___________________ . (Die __________ -Nummer entspricht dabei der Anzahl an Elektronenwolken, die _____________ - Nummer entspricht der Anzahl an Außenelektronen bzw. Valenzelektronen).
Von Element zu Element nimmt dabei die Anzahl an Valenzelektronen stets um 1 zu. Daraus resultieren wesentliche Änderungen in den Eigenschaften der Elemente. Die Valenzelektronen sind somit maßgeblich für die Eigenschaften der Elemente verantwortlich.
Als Mendelejew schon eine Berühmtheit war, wurde er mal gefragt, was seine anfängliche Motivation war. Er sagte daraufhin, dass er beim Verfassen eines Chemiebuches nach einer Einteilung der chemischen Elemente gesucht, aber wenig gefunden hatte. Also begann er selbst Ideen dazu zu sammeln. Seine ersten Ordnungskriterien waren:
- Atomgewicht
- Ähnlichkeiten bei der Bildung von Verbindungen
- Elektrochemisches Verhalten und Wertigkeit
- Kristallform der Verbindungen
- Neigung zur Isomorphie, d.h. Kristallbildung mit gleichen Strukturen.
Die Kernthesen Mendelejews:
Im März 1869 stellte Mendelejew seine Kernthesen bei einem Vortrag vor der Russischen Gesellschaft für Chemie vor:
- Ordnet man die Elemente nach der Atommasse, zeigen diese wiederholende Eigenschaften und dem chemischen Reaktionsverhalten (Periodizität der Elementeigenschaften).
- Einige Nebengruppenelemente zeigen ähnliches Reaktionsverhalten und haben annähernd gleiches Gewicht (z.B. Platin, Iridium, Osmium.
- Bei Elementen, bei denen sich ihren Eigenschaften und das Reaktionsverhalten ähneln haben eine gleichmäßige Erhöhung der Atommassen (z.B. Kalium, Rubidium, Cäsium).
- Aus 3. folgt die Anordnung der Elemente in Gruppen. Diesen Elementgruppen entspricht ihrer Wertigkeit (später Oxidationszahl genannt). Es gibt aber einige Ausnahmen von dieser Regel.
- Die mengenmäßig häufigsten Elemente haben nur eine geringe Atommasse.
- Die Atommasse bestimmt die chemischen Eigenschaften des Elements mit.
- Bei Molekülen bestimmt das Volumen die chemischen Eigenschaften.
- Fehlende Elemente (z.B. unter Aluminium und Silizium), mit Atommassen zwischen 65u und 75u müssen noch entdeckt werden.
- Aus der logischen Verknüpfung von Atommassen mit den jeweiligen Eigenschaften der Elemente gilt, dass die Atommassen des Tellurs nicht 128u betragen kann, da es zu weit rechts im PSE stehen würde was nicht mehr mit seinen Eigenschaften zusammenpassen würde. Tellur wird vermutlich eine Atommasse zwischen 123u und 126u haben.
- Bei fehlenden Elementen im Periodensystem der Elemente können jetzt schon Vorhersagen ihrer Eigenschaften und des chemischen Reaktionsverhaltens vorhergesagt werden.
Aufgaben:
- Vervollständige den Text und fasse dann sein Leben und seine Leistungen in einem eigenen Text zusammen.
- Nimm zu jeder These Stellung und beurteile, inwiefern sie sich erfüllt hatte bzw. inwiefern sie heute noch gültig ist.
Wiederholungsaufgaben zum Thema Atombau, Atomvorstellung und Kern-Hülle Modell
1. Rutherford hat einen Versuch durchgeführt, der als Streuversuch bekannt wurde. Eines seiner Ergebnisse dabei war, dass Atome im Grunde leer sind. Erkläre den Versuchsaufbau mit einer Zeichnung.
2. Stelle Rutherfords Ergebnisse verständlich dar, indem Du seine drei wichtigsten Beobachtungen und Schlussfolgerungen nennst.
3. Nenne die Elementarteilchen und ordne ihnen ihre Masse und Ladung zu.
4. Erkläre ein Modell zum Aufenthaltsbereich der Elektronen.
5. Warum hat Rutherford als Strahlenquelle α-Strahlen (=Heliumkerne) verwendet? Zeichne einen solchen Helimatomkern und vergleiche mit einem Goldatom. Begründe Deine Meinung.
6. Zeichne selbst den Aufbau der folgenden Atome: H, He, Li, Na, Mg, Ca, Ba, Al, I.
7. Welcher Zusammenhang besteht zwischen der Anzahl an Elektronenwolken und der Periodennummer?
8. Nach welchen Kriterien ist das PSE aufgebaut?
9. Besteht ein Zusammenhang zischen der Anzahl an Valenzelektronen und dem PSE?
10. Wie erklärst Du Dir, dass das Verhältnis von Protonen zu Neutronen bei Zunahme der Ordnungszahl kleiner wird (z.B. Kohlenstoff hat 6p+ und 6n => 1:1=1; Blei hat 82p+ und 126n => 82:126=0,65)?
11. Der russische Physiker Mendelejew hatte das PSE noch nach der Massenzahl geordnet. Finde im PSE Beweise, dass die Elemente heute nach ihrer Ordnungszahl und nicht nach der Massenzahl geordnet sind.
12. Was vermutest Du, war der Grund, warum es so lange gedauert hat, die Elemente sinnvoll anzuordnen?
13. Berechne den Anteil an metallischen Elementen im PSE.
14. Erkläre die Begriffe Hauptgruppe und Elementperiode.
15. Was sind Isotope? Nenne Beispiele und vervollständige dann die Tabelle:
|
1 H 1 |
2 H 1 |
3 H 1 |
12 C 6 |
14 C 6 |
|
|
Protonenzahl |
1 |
||||
|
Neutronenzahl |
0 |
||||
|
Elektronenzahl |
|
Wasserstoff |
Deuterium |
Tritium |
16. Erkläre die Begriffe „Ordnungszahl“, „Protonenzahl“, „Massenzahl“.
17. Warum sind bestimmte Kombinationen von Protonen und Neutronen bei einem Element häufiger zu finden als andere? Was vermutest Du, ist der Grund, dass es nicht von jedem Element Isotope gibt?
18. Nenne verschiedene die verschiedenen Typen Radioaktiver Strahlung und zeige, wie sie entstehen (nur falls im UR besprochen).
19. Erkläre das Prinzip der Radio-Karbon Methode (14C-Methode) zur Altersbestimmung (nur falls im UR besprochen).