Kapitel 05: Wasser, Lösungen, Wasserstoff und das Teilchenmodel

Wasser ist Lebensraum für viele Tiere und unverzichtbar für den Menschen!
In der Biologie und Chemie ist es so wichtig, dass es bei fast allen Reaktionen
und in fast allen Produkten eine Rolle spielt.
Fakten zum Thema „Wasser“
- Ca. 70% der Erde sind von Wasser in Form von Flüssen, Seen oder Meeren bedeckt
- Aber nur 3% des kompletten Wassers des Planeten sind trinkbares Süßwasser.
- Der Mensch enthält ca. 60% Wasser. Dies ist teilweise flüssig oder auch gebunden in Körperzellen zu finden. Dieser Wert variiert etwas nach Alter und Geschlecht.
- Weltweit wird das meiste Süßwasser dazu verwendet, Lebensmittel herzustellen. Gerade Getreideanbau aber auch die Produktion von Fleisch benötigen sehr viel Trinkwasser.
- Wasser dient der Gewinnung von elektrischem Strom durch rund 850.000 Staudämme.
- Weltweit haben ca. 900 Millionen Menschen keinen Zugang zu sauberem Trinkwasser.
- Schmutziges Trinkwasser, vor allem in Entwicklungsländern, verursacht jährlich bis zu 1,5 Millionen Infektionen mit Todesfall bei Kindern. Insgesamt 3,5 Millionen Menschen haben Krankheiten durch schlechte Wasserversorgung.
- Sehr viele chemische Reaktionen laufen in wässrigen Lösungen ab. Dies passiert auch in unserem Körper. Er enthält sehr viel Wasser und benötigt auch viel Wasser.
- Wasser ist ein chemisches Lösungsmittel.
- Wasser ist für den Menschen unverzichtbar zum Leben. Man findet es in allen Bereichen unseres Lebens.

Wasser dient uns nicht nur als Grundlage für alle Getränke und als Lösungsmittel, es dient auch dem Spaß und der Freizeit und natürlich auch dem Schiffsverkehr. Findest Du noch andere Bereiche, wo Menschen Wasser verwenden?
Stoffe bestehen aus winzigen „Teilchen“ , die "Atome" genannt werden
Wasser ist für den Menschen die wichtigste Verbindung überhaupt. In diesem Kapitel wirst Du vieles über Wasser und Lösungsvorgänge lernen, denn schließlich sind im Wasser fast immer Salze aufgelöst. Außerdem lernst Du die Atome kennen und auch noch mehr über Trennungen und Trennungsvorgänge - denn auch dort spielt Wasser oft eine Rolle.
Versuch: In zwei große Bechergläser werden jeweils warmes und kaltes Wasser gegeben. Dann wird je ein Kristall Kaliumpermanganat (= Salz) zugefügt und ca. 60 min. beobachtet (Kaliumpermanganat dient nur als kristalliner Farbstoff.). Die beiden Bechergläser dürfen nicht berührt werden, es darf zu keinen Erschütterungen kommen!
Beobachtung: Im kalten Wasser verteilt sich der Farbstoff langsam, im warmen sehr schnell. Nach ca. 60 min. hat sich der Farbstoff in beiden Bechergläsern gleich gut verteilt, obwohl nicht umgerührt wurde.
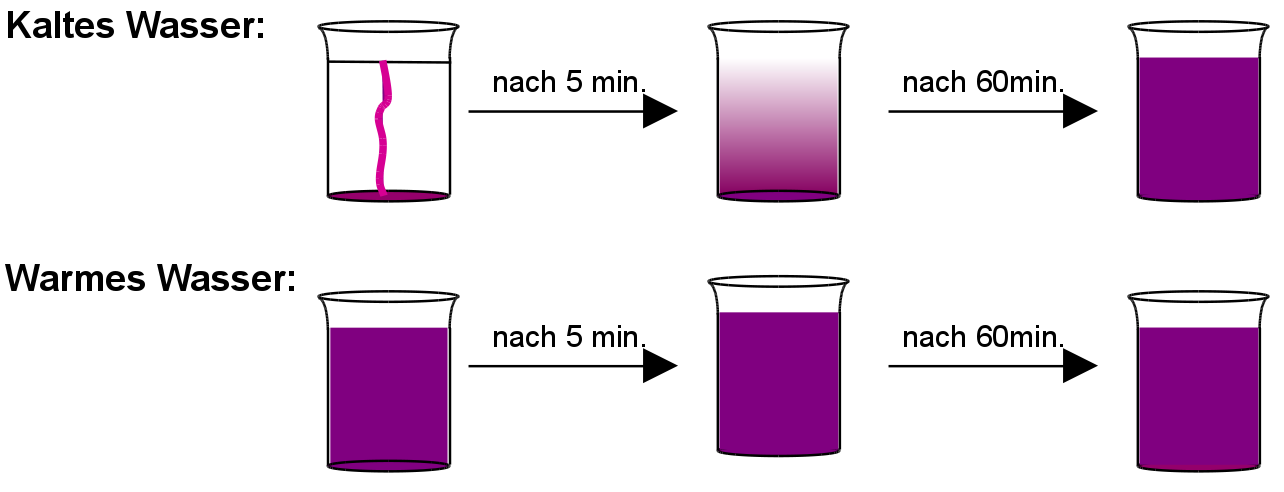
Schlussfolgerung: Lösen des Salzes:
Durch das Wasser zerfällt der Salzkristall in winzige kleine Teilchen. Es ist eine Lösung entstanden! Man sagt auch, das Salz hat sich aufgelöst. Wasser ist dabei das Lösungsmittel für das Salz.
Diese winzigen Teilchen sind sehr klein und in sehr hoher Anzahl vorhanden. Ein winziger Kristall kann davon so viele enthalten, dass die Anzahl mehr wäre als eine Milliarde mal eine Milliarde (es dürften so ca. 100 000 000 000 000 000 000 000 Teilchen sein).
Stoffe bestehen aus winzigen Teilchen. Diese sind nicht weiter teilbar und man nennt sie Atome (griechisch: atomos = unteilbar). Jeder Stoff besteht aus solchen winzigen kleinen Atomen.
2. Verteilen des Farbstoffes
Alle Atome bewegen sich ständig und stoßen dabei auch aneinander. Diese Eigenbewegung kann man sich als ein Zittern oder Schwingen vorstellen. Sie wurde von dem schottischen Biologen Robert Brown 1827 entdeckt. Dadurch kommt es zur Verteilung der Atome in der ganzen Lösung.
Die Ausnahme für die sich bewegenden Teilchen ist der absolute Nullpunkt! An diesem kommt die Eigenbewegung zum Erliegen. Er ist die theoretisch tiefste mögliche Temperatur, die auch als 0 Kelvin definiert ist, was minus 273,15°C entspricht.
Je wärmer es ist, desto schneller bewegen sich diese Teilchen dabei,
deshalb funktioniert der Versuch im warmen Wasser auch so gut.
Ein Video mit diesem Versuch findet ihr in meinem Kanal: https://www.youtube.com/watch?v=wAq-uakdzow
Aufgaben:
- Lies den Text und markiere die wichtigen Schlüsselwörter.
- Erkläre mit Deinen Worten, was man unter Lösungsvorgängen versteht und wovon sie abhängig sind.
- Löst sich Zucker im Tee, auch wenn man nicht umrührt? Probiere es mit einem Glas Wasser aus, in welches Du ein Stück Würfelzucker fallen lässt.
- Wenn jemand eine Mandarine isst, riecht man das bald im ganzen Raum, erkläre, warum das so ist.
- Warum wird Wäsche mit 40°C heißem Wasser gewaschen?
- Was kann man versuchen, wenn ein hartnäckiger Fleck bei 40°C sich nicht löst?
Was ist Sieden?
Dieser Versuch wird Dir sicherlich gefallen - er ist einfach und in der Erklärung faszinierend. Angeblich sind bei diesem Versuch schon Schüler durchgedreht ;-)
V: Man füllt Wasser in einem Becherglas und stellt es auf ein Dreibein mit darunter stehendem Brenner. Während die Temperatur im Glas ansteigt, beobachtet man es genau. Mit einem wassergefüllten Reagenzglas sollen die aufsteigenden Gasbläschen aufgefangen werden.
|
Beobachtung |
Schlussfolgerung |
|
1. Becherglas beschlägt von außen |
=> Wasser aus dem Erdgas setzt sich auf dem kalten Glas von außen ab. |
|
2. Schlierenbildung |
=> Warme und kalten Wasserschichten (=> Dichteunterschiede) vermischen sich. |
|
3. Kleine Gasblasen steigen auf |
=> gelöste Gase (Stickstoff und Sauerstoff) entweichen. |
|
4. Große Gasblasen steigen auf |
=> Wasser wird gasförmig und Dampfblasen steigen auf. Diese können im Gegensatz zu 3) nicht mit einem wassergefüllten RG aufgefangen werden, da sie im etwas kälteren Reagenzglaswasser sofort wieder flüssig werden. |
|
5. Wassertropfen am Becherglas |
=> Wasserdampf kühlt sich an der Glaswand ab und kondensiert. |
Sieden ist ein Übertritt der Moleküle in die Gasphase
(und zwar im ganzen Gefäß, nicht nur an der Flüssigkeitsoberfläche => das nennt man dann „Verdunsten“).
Der Siedepunkt ist abhängig von:
- Der Masse der Teilchen (Für Profis in Physik ist dies erklärbar aus: Ekin = ½ mV2).
- Zwischenmolekularen Kräften (Vergleich H2S , H2O ,...).
- Luftdruck, der dem „Austritt“ der Moleküle entgegenwirkt.
(Vergleich: ein Bergsteiger siedet im Himalaja Tee bei 80°C, im Dampfkochtopf hingegen siedet Wasser bis 120°C). Wenn der Dampfdruck gleich dem Umgebungsdruck ist, so ist die flüssige Phase nicht mehr stabil, es kommt zum Verdampfen.
Aufgaben:
- Erkläre, wie gelöste Gase ins Wasser (z.B. in Mineralwasser) gelangen.
- Warum blubbert kochendes Wasser?
- Kann man aus sprudelndem Mineralwasser eigentlich einen Tee kochen, der normal schmeckt?
- Welches Gas ist eigentlich in Mineralwasser aufgelöst?
- Erkläre, warum eine gewischte Tafel eigentlich trocknet, sie ist doch kälter als der Siedepunkt von Wasser?
- In einem heißen heißem Sommer sind alle Fische in einem flachen See gestorben. Ein Biologe meint, dass es daran liege, dass die Fische erstickt seien. Hat der Biologe recht? Begründe.
- In welchen Jahreszeiten fühlen sich Fische demzufolge am wohlsten? Begründe Deine Antwort.
Vorgänge beim Erhitzen von Wasser
Auf einer der vorherigen Seiten hast Du gelernt, dass alle Stoffe aus den winzig kleinen Teilchen, den Atomen bestehen. Natürlich gilt das nicht nur für Feststoffe, sondern auch für Flüssigkeiten und Gase. Außerdem weißt Du schon, dass diese Atome ständig zittern und dieses Zittern von der Temperatur abhängig ist. Was passiert denn nun eigentlich mit den Atomen, wenn man gefrorenes Wasser kocht? Diese Skizze zeigt die Anordnung von Atomen in den drei Aggregatzuständen fest, flüssig, gasförmig.
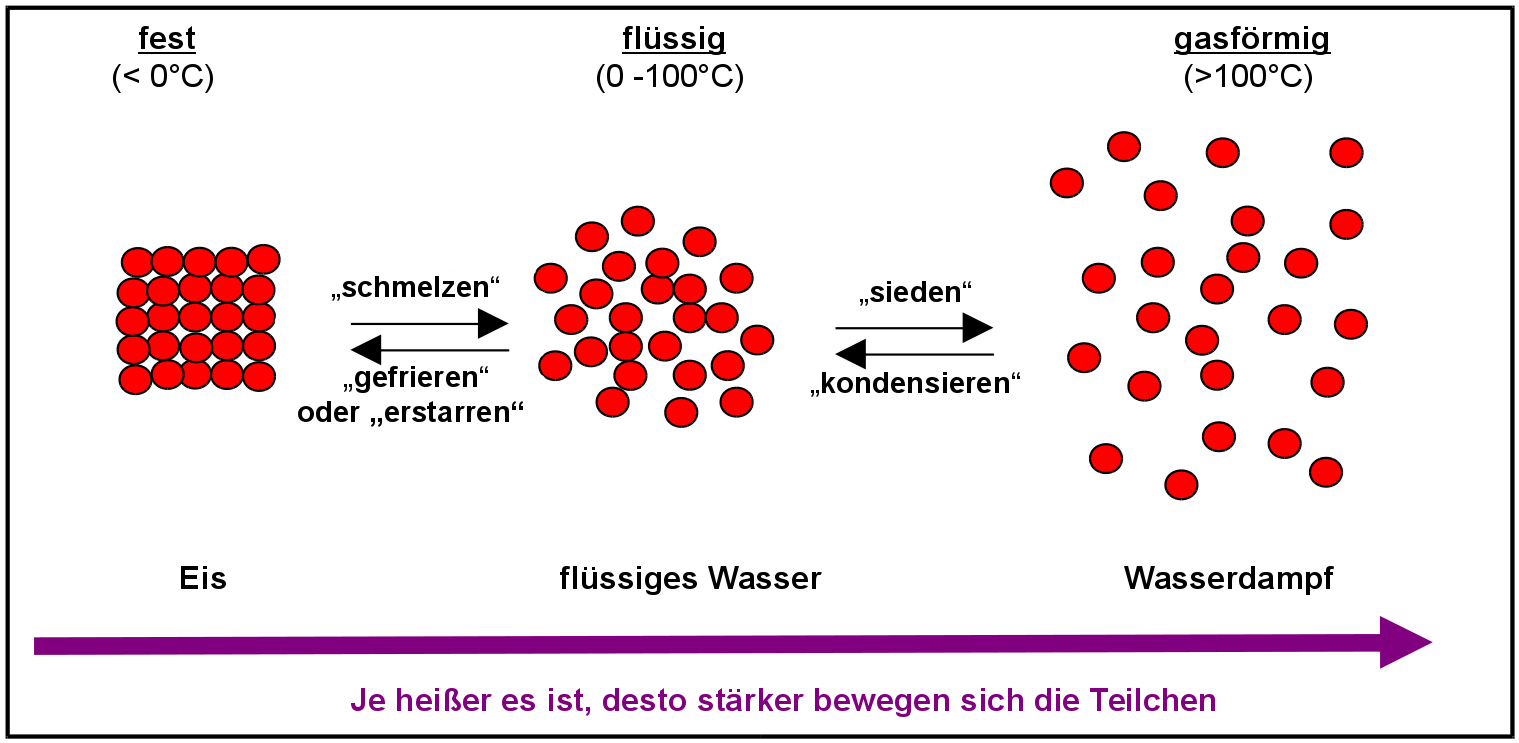
Wird der Schmelzpunkt (=Smp.) überschritten, lösen sich die Teilchen vom Eisblock ab, weil sie sich zu stark bewegen. Der Feststoff schmilzt. Bei weiterer Erwärmung benötigen die Teilchen immer mehr Platz, bis sie schließlich am Siedepunkt (=Sdp.) in die Gasphase übergehen (dort ist noch genügend Platz vorhanden - wäre der Platz nicht vorhanden (wie z.B. im geschlossenen Feuerzeug), so würde der Stoff flüssig bleiben.).
Je wärmer es ist, desto schneller bewegen sich die Teilchen.
=> Die Zahl der Zusammenstöße nimmt zu
=> Die Teilchen benötigen mehr Platz, dabei geht beim Schmelzen die feste Form verloren und beim Sieden kommt es zu derart starken und häufigen Kollisionen, dass der zur Verfügung stehende Raum den Teilchen nicht ausreicht. Die Teilchen verlassen die Flüssigkeit und gehen in die Gasphase über.
=> Gase benötigen sehr viel mehr Platz als Flüssigkeiten (Wenn das dabei Gefäß nicht offen ist und somit der Platz nicht vorhanden ist, steigt der Druck enorm (=> Explosionsgefahr)
Umgekehrt macht man sich das Phänomen das Gase sehr viel Platz benötigen bei der Verflüssigung von Gasen zunutze. Möchte man also ein Gas (z.B: Feuerzeuggas), welches man bei Raumtemperatur im flüssigen Zustand haben möchte (z.B. um es besser transportieren zu können) verflüssigen, so braucht man es nur durch Druck komprimieren. Es wird bei fehlendem Platz also flüssig.
Je näher der Siedepunkt des Gases an der Raumtemperatur liegt, desto weniger Druck braucht man.
Warum verdunstet Wasser bei Raumtemperatur?
Durch mehr Kollisionen können einzelne Wasserteilchen immer schneller beschleunigt werden, solange bis einzelne Teilchen schnell genug sind (also genug Energie haben), den flüssigen Aggregatzustand zu verlassen. Wie oben schon erwähnt, findet dieser Vorgang vor allem an der Flüssigkeitsoberfläche statt.
Diffusion
V1: Ein Kaliumpermanganatkristall (KMnO4) wird in eine mit Wasser gefüllte Petrischale gegeben und dann auf den auf Overhead-Projektor gestellt.

Diffusion = selbständige Durchmischung von Flüssigkeiten und Gasen, die auf der Eigenbewegung der Teilchen beruht.
Dabei bewegen sich die Teilchen immer vom Ort der hohen Konzentration zum Ort der geringen Konzentration.
Durchschnittsgeschwindigkeit der Teilchen nimmt mit steigender Temperatur zu (vgl. Zucker in Kaffee)!
Wichtig: nur gelöste Teilchen und Gase diffundieren
Vergleichbares findet man auch bei Duftstoffen (wie Hähnchengeruch, Mandarinengeruch usw.) in Luft (Geruchsstoffe, Rauch).
Ein Diffusionsversuch für zu Hause
V: Ihr nehmt identische Gläser. In das eine Glas füllt ihr Leitungswasser und in das andere heißes Wasser aus dem Wasserkocher (bitte nicht verbrennen!). Wer ein drittes Glas dazu nehmen möchte, nimmt eiskaltes Wasser mit Eiswürfeln, oder besser, ein Glas Wasser, was im Kühlschrank/Eisfach gut abgekühlt wurde.
In jedes Glas wird ein Beutel mit schwarzem Tee gehängt und die Zeit gestoppt, bis der Tee im Glas, ohne umzurühren, eine gute Farbe hat. Den heißen Tee dann trinken :-)
Zur Auswertung macht ihr ein Versuchsprotokoll mit Versuchsdurchführung, einer Skizze der zwei oder drei Gläser (oder einem Foto!) und der Beobachtung mit der gemessenen Zeit.
Die Schlussfolgerung könnt vom Versuch der Vorseite übernehmen.
Schmelz- und Siedepunkt
Der Schmelz- und der Siedepunkt sind eine Stoffeigenschaft. Jeder Stoff hat andere Schmelz- und Siedepunkte. Man kann dadurch Stoffe erkennen und zuordnen:
|
Wasser |
Alkohol |
Eisen |
Zink |
Quecksilber |
Helium |
Wasserstoff |
Sauerstoff |
|
|
Smp. |
0°C |
-117°C |
1535°C |
419°C |
-39°C |
-272°C |
-259°C |
-219°C |
|
Sdp. |
100°C |
79°C |
2870°C |
906°C |
357°C |
-269°C |
-253°C |
-183°C |
Anwendungen im täglichen Leben:
- Dampfkochtopf,
- Feuerzeuggas (wird erst beim Öffnen gasförmig)
- Mikrowellenofen (kehrt Prozess um, indem Wasserteilchen beschleunigt und in Schwingung versetzt werden und so Wärme entsteht).
Aufgaben:
- Beschreibe mit Deinen Worten das Teilchenmodell und erkläre die Änderungen der Aggregatzustände beim Erwärmen.
- Warum ist es sinnvoll, genaue Tabellen mit Siedepunkten und Schmelzpunkten zu haben?
- Warum bricht kaltes Eis auf einem See nicht so schnell, wie Eis bei genau 0°C?
- Erkläre die folgenden Anwendungen kurz mit dem Teilchenmodell:
Dampfkochtopf, Feuerzeuggas wird erst beim Drücken der Taste gasförmig, Mikrowelle (Achtung Umkehrung des Prozesses). - Iod geht beim Erwärmen oft vom festen in den gasförmigen Zustand über (=Sublimation). Kannst Du erklären, warum das funktioniert? Was verrät uns das über Schmelz- und Siedepunkt des Iods?

Wasser im festen Zustand: Eis bedeckt einen großen Teil des Planeten. Somit ist Wasser das einzige Element, welches in allen drei Aggregatzuständen auf unserem Planeten vorkommt.
Zusatzinformationen:
https://de.wikipedia.org/wiki/Aggregatzustände
Lösen von Salzen in Wasser
Was passiert eigentlich, wenn Du Zucker oder Salz in ein Glas mit Wasser gibst? Beobachte doch mal.
a) Die gesättigte Lösung
V: Zu 100ml Wasser wird Salz zugefügt. Löst sich alles nach dem Rühren auf, wird ein weiterer Löffel Salz hinzugefügt. Besonders schöne Kristalle erhält man mit „Alaun“ (=Kaliumaluminiumsulfat).
B: In der Lösung löst sich die Menge von zwei Löffeln auf, der dritte Löffel bildet einen Bodensatz (das ist der Teil, der sich nicht auflöst).
S: Eine Lösung ist ein homogenes Gemisch, das aus einem oder mehreren gelösten Stoffen und einem Lösungsmittel besteht. Viele Salze lösen sich in Wasser auf, aber das Lösungsmittel Wasser kann nicht unendlich viel Salz auflösen. Ist die Menge zu groß bleibt ein Rückstand am Boden zurück. Man spricht von einer gesättigten Lösung.
Lösungsmittel sind üblicherweise Flüssigkeiten. Die gelösten Stoffe können fest, flüssig oder gasförmig sein.

Ein Lösung ist ein Gemisch aus einem Lösungsmittel und einem Stoff,der sich darin auflöst.
Nicht alle Salze lösen sich gut in Wasser.
Einige Salze wie z.B. Marmor lösen sich so gut wie gar nicht.
Solche Salze werden schwerlösliche Salze genannt.
b) Die übersättigte Lösung
Wenn man zu einer gesättigten Lösung weiter Salz zufügt, entsteht ein Bodensatz. Dieser löst sich unter Umständen beim Erwärmen auf. Es entsteht eine übersättigte Lösung. Diese enthält mehr Salz, als sie eigentlich aufnehmen kann.

Beim Abkühlen gibt die übersättigte Lösung zu viel gelöstes Salz unter Umständen wieder ab. Wenn man einen Faden (am besten mit einem winzigen Kristall daran) dazu in die Lösung hängt, „wächst“ ein großer Kristall heran.
Die Löslichkeit von Salzen (und anderen Stoffen, wie z.B. Zucker) ist von der Temperatur abhängig.
Unterkühlte Salzlösung und Siedepunktserhöhung
Nachdem Du jetzt den Schmelzpunkt und den Siedepunkt von Wasser kennengelernt hast, stellt sich die Frage, ob sich Wasser sich erwärmt, wenn man es erhitzt. Und was passiert, wenn man nicht reines Wasser, sondern Wasser mit gelöstem Salz kocht? Bleiben Schmelzpunkt und Siedepunkt dann gleich?
V: Je 6 Eiswürfel werden in einem Becherglas mit etwas Wasser vermischt. Die Temperatur wird gemessen. Das Wasser wird nun gekocht und die Temperatur alle 20s gemessen. Eine zweite Gruppe kocht die Eiswürfel, fügt aber 5 Löffel Kochsalz hinzu. Nach Versuchsende wird ein Koordinatensystem (z.B. mit Hilfe des Computers und beispielsweise der freien und kostenlosen Software LibreOffice) erstellt.
B:
-
Zeit [s]
Temperatur Wasser [°C]
Temperatur Salzwasser [°C]
0
0
-8
20
40
60
…
-
Man sieht, dass sich Wasser und die Salzlösung gleichmäßig erwärmen.
-
Schwimmen noch Eiswürfel in der Lösung, ist allerdings eine genaue Messung sehr schwierig, da große Temperaturunterschiede im Becherglas vorliegen!
-
Die Temperaturkurve von Salzwasser beginnt allerdings bei geringeren Temperaturen und erreicht ihren Sättigungspunkt bei höheren Temperaturen, als die von reinem Wasser.
S: Wasser schmilzt bei 0°C und siedet bei 100°C. Gibt man Kochsalz hinzu, wird der Schmelzpunkt herabgesetzt, da sich Salzteilchen zwischen die Wasserteilchen drängeln und so die Anordnung im gefrorenen Kristall „stören“. Das Eis schmilzt, obwohl es noch nicht seinen Schmelzpunkt erreicht hat.
=> Man spricht von einer Schmelzpunktserniedrigung (bzw. Gefrierpunktserniedrigung).
Beim Sieden passiert etwas Ähnliches. Die Salzteilchen bewegen sich sehr schnell und entnehmen so dem System zusätzlich Energie.
=> Man muss mehr Hitze zufügen, damit alle Wasserteilchen in die Gasphase übertreten können.
=> Man spricht von einer Siedepunktserhöhung.
Genaue Erklärung zur Siedepunktserhöhung:
Beim Erhitzen von Wasser bewegen sich die Wasserteilchen (=Wassermoleküle) immer schneller und es kommt zu immer mehr Kollisionen. Dadurch werden einige Wasserteilchen so schnell, dass sie in die Gasphase übergehen.
Sind nun Salzteilchen zusätzlich in der Lösung, so nehmen sie erstens auch etwas der Energie auf, um sich schneller zu bewegen (wobei sie insgesamt viel langsamer schwingen als die Wasserteilchen) und zweitens fangen sie auch einen Großteil der Kollisionen ab. Die Wasserteilchen werden also weniger stark beschleunigt. Folglich wird mehr Energie (also eine höhere Temperatur) benötigt, um die Wasserteilchen zu beschleunigen.
Genaue Erklärung zur Gefrierpunktserniedrigung:
Durch das Salz wird der Gefrierpunkt (Schmelzpunkt) herabgesetzt. Beim Abkühlen von Wasser unter 0°C entsteht ein regelmäßiger Eiskristall aus sorgfältig angeordneten Wasserteilchen. Sie schwingen nur sehr langsam.
Befinden sich gelöste Stoffe im Wasser, z.B. Spiritus oder Salz, dann wird die Bildung des Kristalls durch die Fremdkörper gestört. Folglich muss die Lösung stärker abgekühlt werden, damit sie gefrieren kann.
Hat man bereits gefrorenes Eis und gibt Salz hinzu, z.B. Streusalz, schmilzt dieses Eis. Der Grund liegt darin, dass sich Salzteilchen zwischen die Wasserteilchen „drängeln“ und so den Kristall zerstören.
Beachte die allgemeinen Aussagen eines Diagramms:
-
Je steiler die Gerade, desto höher die Geschwindigkeit
-
Unterbrechungen sagen etwas über den Versuchsverlauf aus. Steigt die Kurve danach wie gewohnt weiter, so liegt ein Messfehler vor, entsteht eine Stufe, so war vielleicht der Brenner aus. Fällt die Temperatur, so wurde vielleicht kälteres Wasser zugefügt.
Aufgaben:
-
Erkläre die Wirkung von Streusalz.
-
Warum wird in die Scheibenwaschanlage (im Winter) Alkohol zum Seifenwasser zugefügt?
-
Warum gefriert im Winter eine mit Alkohol enteiste Autoscheibe schneller wieder, als eine, die freigekratzt wurde.
Lösungsmitteleigenschaften
V1: in Wasser werden Kochsalz, Zucker, Octan (=Benzin), Öl und Ethanol (=Trinkalkohol) gelöst.
B1: In Wasser lösen sich: Kochsalz, Zucker und Ethanol
V2: In Benzin werden Wasser, Kochsalz, Zucker, Öl und Ethanol (=Trinkalkohol) gelöst.
B2: In Benzin lösen sich gut: Öl, Ethanol
Nicht löslich: Kochsalz, Zucker, Wasser
S: Wasser ist ein polares Lösungsmittel, Benzin ein unpolares (apolares). In diese beiden Gruppen kann man eigentlich jedes Lösungsmittel einteilen.
Welche Stoffe lösen sich nun in diesen Lösungsmitteln?
Der Versuch zeigt, dass sich in Wasser besonders gut Kochsalz, Zucker und Alkohol lösen. Im zweiten Teil sieht man, dass sich insbesondere Kochsalz und Zucker in Benzin nicht lösen.
Öl löst sich aber gut in Benzin.
Wenn sich zwei Flüssigkeiten nicht miteinader vermischen und es nicht zu einer Auflösung kommt, dann sieht man die Bildung von zwei Phasen.
Generell kann man sagen:
1. Wasser ist ein polares und somit hydrophiles Lösungsmittel. Darin lösen sich polare und hydrophile (=lipophobe) Stoffe.
2. Benzin ist ein unpolares Lösungsmittel. In unpolaren Lösungsmitteln lösen sich unpolare (lipophile) Stoffe. Da diese Stoffe gleichzeitig wasserabstoßend sind, nennt man sich auch hydrophob.
Alle Begriffe sind weiter unten definiert.
Man kann also folgende Faustregel festhalten:
Gleiches löst sich in gleichem (oder genauer: ähnliches Stoffe lösen sich in ähnlichen Lösungsmitteln)!
Hydrophiles löst sich also in Hydrophilem und lipophiles löst sich in Lipophilem.
Aber Achtung: Der einzige Stoff in diesem Experiment, der von dieser Regel abweicht, ist Ethanol. Der Trinkalkohol hat beide Eigenschaften! Er ist tatsächlich eher hydrophil und löst sich in beliebigen Mengen in Wasser.
Er hat aber genügend lipophile Eigenschaften, um sich auch recht gut in Benzin, Öl und Fett zu lösen.
Diese Besonderheit macht Alkohol (meistens als Spiritus, da dieser billiger ist) zu einem so gutem Reinigungsmittel. Neben wasserlöslichem Schmutz löst er auch gut Fett und Öl.
Begriffe zu Lösungsmitteln
phil = liebend
phob = abstoßend
hydra = Wasser
lipo = Fett
Gruppe 1: polar
→ hydrophil = wasserliebend
lipophil = festtabstoßend
Gruppe 2: unpolar/ apolar
→ lipophil = fettliebend
hydrophob = wasserabstoßend
Ein Video mit diesem Experiment könnt ihr in meinem Kanal finden: https://youtu.be/1E0uaPs43pI
Trennung von Öl und Wasser
Wenn man nun zwei Phasen hat, wie kann man sie geschickt voneinander trennen? Ganz einfach, indem man die Flüssigkeiten nicht wie üblich oben abkippt (dekantiert), sondern sie einfach von unten ablässt.
Das passende Gerät dazu ist der „Scheidetrichter“:

Öl-Wasser-Trennung mit dem Scheidetrichter
Mit gutem Auge und etwas Fingerspitzengefühl kann man leicht die beiden Phasen in getrennte Gefäße abfüllen. Schaut einfach selbst:
Ein Video mit diesem Experiment könnt ihr in meinem Kanal finden: https://youtu.be/DRcDgrgL1VY
Übung: Eigenschaften von Lösungsmitteln
Welche Stoffe lösen sich eigentlich in Wasser auf? Sind es alle Stoffe, oder unterscheiden sie sich?
Außerdem gibt es noch andere Lösungsmittel außer Wasser (z.B. Benzin oder Alkohol). Dieser Versuch soll klären, ob es für das Auflösen von Stoffen eine Gesetzmäßigkeit gibt.
V: Nimm dir die verschiedenen Lösungsmittel (wenn Du den Versuch zu Hause machst, nimmst Du nur die Substanzen, die auch tatsächlich vorrätig sind, Du kannst dann auch eigene Substanzen zufügen) und untersuche, wie viel sich von den angegebenen Feststoffen darin löst. Beachte, dass eine Trübung immer bedeutet, dass sich ein Stoff nicht aufgelöst hat. Kennzeichne dann mit den Symbolen „+“, „·“ Und „–“, wie gut sich die Feststoffe in den jeweiligen Lösungsmitteln auflösen.
|
Kochsalz (=NaCl) |
Zucker (C6H12O6) |
Mehl/ Stärke |
Kaffeepulver |
Essig |
Vit. C Pulver |
Butter/ Fett |
Terpentin/ Verdünner |
|
|
Wasser |
||||||||
|
Spiritus |
||||||||
|
Benzin/ Waschbenzin |
||||||||
|
Aceton/ Nagellackentferner |
||||||||
|
Speiseöl |
S: Nicht alle Stoffe können sich in jedem Lösungsmittel auflösen.
Viele Stoffe lösen sich in Wasser oder in Benzin/ Aceton. Kein Stoff löst sich gut ein beiden Flüssigkeiten. Einige Stoffe lösen sich in gar keinem Lösungsmittel auf (Stärke/ Mehl).
Die Ursache ist die so genannte Polarität, die die Du in den nächsten Kapiteln noch besser kennen lernen wirst. Es gibt sogenannte polare und apolare (=unpolare) Lösungsmittel. Wasser ist ein Beispiel für ein polare, Benzin und Öl sind Beispiele für apolare Lösungsmittel.
Man unterscheidet dabei nicht nur hinsichtlich der Polarität von Lösungsmittel, sondern auch der Polarität des zu lösenden Stoffes.
In einem polaren Lösungsmittel können sich nur polare Stoffe lösen.
In einem apolaren hingegen nur apolare Stoffe.
Es gilt grob die Regel: „ähnliches löst sich in ähnlichem“.
Salz ist ein polarer Stoff. Er löst sich also nur in polaren Lösungsmittel wie z.B. Wasser. Fette hingegen sind apolar und lösen sich gut in apolaren Lösungsmitteln wie Benzin, Terpentin, Verdünner, Öl oder Aceton.
Es gilt:
Stoffe die sich in Wasser lösen, nennt man „hydrophil“,
Stoffe, die sich nicht in Wasser lösen „hydrophob“.
Im Alkohol liegt eine Mittelstellung vor, da er weniger polar als Wasser, aber polarer als Benzin ist.
In ihm lösen sich sowohl polare, als auch apolare Stoffe, aber in jeweils geringerer Menge, als im entsprechendem Lösungsmittel.
Aufgaben:
-
Warum gehen Fettflecken und Schmiereflecken so schlecht in der Waschmaschine aus der Kleidung?
-
Schlage ein Lösungsmittel vor, um Fett von der Fahrradkette zu entfernen.
-
Nagellack und Edding sind nicht wasserlöslich. Wie kann man sie stattdessen entfernen.
-
Nenne verschiedene Möglichkeiten mit „Hähnchen“ verschmierte Fettfinger zu reinigen.
-
Ein Schüler hatte einen Motorschaden mit seinem Mofa. Er vermutet, dass ihm jemand Zucker in den Tank getan hat.
a) Warum ist Zucker für den Motor gefährlich und wie wirkt er sich aus?
b) Kann man den Zucker noch nachweisen - und wie? -
Warum schwimmen die Fettaugen in der Suppe oben?
-
Ordne alle Begriffe der Tabelle zu: lipophob, lipophil, hydrophil, hydrophob, fettliebend, wasserliebend
fettlöslich
wasserlöslich
Versuche mit anderen Lösungsmitteln I
Sicher kennst Du das Gefühl, wenn Du gerade Hähnchenfleisch oder ein andere fettiges Essen mit den Händen gegessen hast und versuchst das mit Wasser abzuwaschen. Das funktioniert ohne Seife kaum. Fette lösen sich nicht in Wasser.
Fette und Öle lösen sich in fettähnlichen Substanzen:
V: Aceton, Benzin, Waschbenzin, Terpentin, Fleckenwasser, Butter und ein Pflanzenöl werden untereinander versucht zu lösen. Jeder der Stoffe sollte auch mit Wasser gemischt werden, um zu sehen, was passiert.
B: Alle Stoffe lassen sich untereinander gut auflösen mit Ausnahme von Wasser. Mit Wasser bilden sich zwei Phasen, welche sich nicht mischen lassen.
S:
Stoffe, die sich in Fett lösen, nennt man lipophil. Dazu gehören neben Butter und allen Ölen auch Schmierfette, Benzin und viele andere Stoffe. Stoffe, die sich nicht in Fett lösen und fettabstoßend sind, nennt man lipophob.
Versuche mit anderen Lösungsmitteln II
Auf zwei Blätter malst Du jeweils mit einem Edding/Folienstift einen Strich auf Papier und in etwas Abstand einen Strich mit dem Füller.
1. Nimm ein Papiertaschentuch oder einen Schwamm, mache mit Wasser nass und reibe über Blatt1 und beobachte.
2. Ein zweites Taschentuch kannst Du mit Benzin (oder Spiritus) anfeuchten und über Blatt zwei streichen. Beobachte und beurteile die Lösungsmitteleigenschaften von Tinte und Folienstiften.
Fortgeschrittene Versuche mit Wasser
Versuch 1: Elektrolyse von Wasser:
Die Elektrolyse von Wasser kennst Du aus den ersten Kapiteln. Im Hoffmann´schen Wasserzersetzungsapparat wird reines Wasser durch elektrischen Gleichstrom zersetzt. Um die Leitfähigkeit zu erhöhen, kann man etwas Schwefelsäure zufügen.
Bei einer Spannung von ca. 12-15 V (Stromstärke mindestens 0,5 A) entstehen nun die Gase Sauerstoff und Wasserstoff (im Verhältnis 2 Raumteile Wasserstoff zu 1 Raumteil Sauerstoff).
Zur Bestätigung werden die beiden Gase in zwei Reagenzgläsern aufgefangen und Knallgasprobe sowie Glimmspanprobe durchgeführt.
Reaktionsgleichungen für fortgeschrittenere Schüler:
Kathode: 4 H3O+ + 4 e- --> 2 H2 + 4 H2O
Anode: 4 OH- ---> 2 H2O + O2 + 4 e-
-------------------------------------------------------
2 H2O --> 2 H2 + O2
Versuch 2: Kondensation von Wasserdampf zu Wasser - ein Springbrunnenversuch
a) Durchführung im Reagenzglas
2 bis 4 ml Wasser mit dem Brenner in einem großen Reagenzglas zum Sieden gebracht. Nun verschließt man das große Reagenzglas mithilfe eines durchbohrten Gummistopfens, in dem Glasröhrchen steckt.
Nun wird solange weiter erhitzt, bis das gesamte Wasser verdampft ist und nur noch (unsichtbarer) Wasserdampf vorhanden sind.
Das Reagenzglas wird nun, mit dem Röhrchen voran, in ein mit Wasser gefülltes Becherglas gehalten. Der Wasserdampf kühlt ab, kondensiert, verringert sein Volumen und durch den entstehenden starken Unterdruck wird Wasser in das Reagenzglas gesaugt.
Versuch 3: Kristallwassernachweis durch blaues Kupfersulfat oder Cobaltchlorid
Kupfersulfat ist im absolut trockenem Zustand weiß. Kommt eine geringe Menge Wasser hinzu, wird
es blau, da das Wasser als Kristallwasser in die Kristallstruktur des Salzes einlagert. Die korrekte Formel des Kupfersulfats ist dann: CuSO4 x 5 H2O.
Um absolut trockenes Kupfersulfat herzustellen, wird im Reagenzglas Kupfersulfat langsam mit dem Brenner erhitzt.
B: Es entsteht ein weißes, fein krümeliges Salz.
Am oberen Rand des Reagenzglases kondensiert Wasser.
Trockenes Cobalt-(II)-chlorid hat eine blaue Farbe. Durch Kontakt mit Wasser wird es rosarot. In der Schule sind leider keine Versuche mehr mit Cobaltsalzen erlaubt.
Die Trocknung von feuchtem, rosa Cobaltchlorid wird genauso wie bei Kupfersulfat im Reagenzglas durchgeführt.
Reaktionsgleichungen für fortgeschrittenere Schüler:
Erwärmen
2 [Co(H2O)6] ----> Cl2 Co[CoCl4] + 12 H2O
rosa blau
Wasser
Wasser ist eine tolle Flüssigkeit, wir benötigen es zum Trinken, Waschen und für unsere Freizeit (z.B. im Schwimmbad). Chemisch gesehen ist es eine Verbindung aus den beiden Elementen Sauerstoff und Wasserstoff. Wasser hat die chemische Formel H2O.
- Die Bezeichnung Wasser wird umgangssprachlich oft für den flüssigen Aggregatzustand verwendet.
- Im festen Zustand nennen wir es Eis und im gasförmigen Zustand Wasserdampf.
- Die chemisch korrekteste Bezeichnung wäre Wasserstoffoxid. Sie wird allerdings nicht verwendet.
a) Wasservorkommen der Erde
Große Teile unseres Planeten sind von Wasser bedeckt. Dieses Wasser ist meist Salzwasser. Trinkwasser ist vor allem in den nördlichen und stark südlichen Regionen unseres Planeten zu finden. In manchen Gebieten der Erde haben die Menschen nur sehr wenig Wasser. 
Man schätzt, dass sich auf der Erde circa 1386 Milliarden km3 Wasser befinden. 1338 Milliarden km3 (also 96,5%) sind davon Salzwasser. Ca. 35 Millionen km3 (also 2,53%) sind so genanntes Süßwasser. Das ist Wasser, welches nur geringe Mengen gelöster Salze enthält und für den Menschen gut zum Trinken geeignet ist. Allerdings sind ca. 24,4 Millionen km3 (1,77%) nicht als Trinkwasser verfügbar, da es als Eis an den Polen oder in Gletschern und Dauerfrostböden fest gefroren ist. Wasser ist die einzige chemische Verbindung, die auf unserem Planeten in allen drei Aggregatzuständen vorkommt (98,2% in flüssiger, 1,8% in fester und 0,001% in gasförmiger Form).


Regenwasser aus Wolken ist meist sehr rein, da es durch eine Verdunstung von Bodenwasser oder Meereswasser entstanden ist. Man nennt Wasser, welches so entsteht auch destilliertes Wasser. Es ist sehr rein und enthält keine gelösten Salze, da diese nicht mit verdunsten oder verdampfen können. Bei Kontakt mit dem Boden versickert das Regenwasser. Auf dem Weg zum Grundwasser löst es sofort im Boden befindliche Mineralien auf. Es entsteht ein mineralienhaltiges Wasser. Besonders die Stoffe Sulfat, Chlorid, Carbonat und die Elemente Natrium, Kalium, Calcium und Magnesium sind dann in gelöster Form im Grundwasser enthalten.
b) Eigenschaften des Wassers
Die Eigenschaften des Wassers sind so besonders, dass sie es zu dem bedeutendsten Stoff der Erde machen. Bis heute werfen einige Eigenschaften des Wassers selbst Forschern Rätsel auf:
-
Wasser hat vergleichsweise hohe Schmelz- und Siedepunkte. Diese wurden als Fixpunkte für die Celsius-Temperaturskala festgelegt.
-
Wasser siedet unter Normalbedingungen bei 100°C und gefriert bei 0°C. Durch gelöste Salze kann man diese Punkte allerdings verändern.
-
Wasser zeigt eine Dichteanomalie, d.h. es hat seine höchste Dichte bei 4°C, bei tieferen Temperaturen nimmt die Dichte wieder ab (eigentlich müsste sie zunehmen!). Aus diesem Grund schwimmt Eis auf Wasser, da es eine geringere Dichte hat.
-
Wasser ist ein hervorragendes polares Lösungsmittel für viele Stoffe.
-
Die Löslichkeit in Wasser ist oft stark von der Temperatur abhängig. Dabei verhalten sich Feststoffe und Gase unterschiedlich. Gase lösen sich besser in kaltem Wasser, dagegen lösen sich Feststoffe bei zunehmender Temperatur meist besser in Wasser (wovon es aber auch viele Ausnahmen gibt, wie zum Beispiel das Salz Lithiumsulfat.).
-
Tritt Licht von der Luft ins Wasser ein, so wird es abgelenkt (gebrochen).
-
Wasser weist eine vergleichsweise große Oberflächenspannung auf, da sich die Wassermoleküle gegenseitig recht stark anziehen. Wasserläufer, Mückenlarven und andere Tiere machen sich dies zunutze.
-
Wasser ist im reinen Zustand geschmack- und geruchlos.
-
Wird Wasser aus Wasserstoff und Sauerstoff gebildet (=Knallgasreaktion), so wird viel Energie freigesetzt.
-
Wasser hat im Vergleich zu anderen Flüssigkeiten eine hohe Wärmeleitfähigkeit und im Vergleich mit Metallen eine sehr geringe.
c) Bedeutung des Wassers für das Weltklima
Wasser ist als Klimaphänomen entscheidend für unser Wetter verantwortlich! Eine Ursache ist seine ständige Kondensation als Regen und sein erneutes verdunsten. Eine weitere Ursache ist seine Kapazität als Wärmespeicher, denn Wärme der Sonnenenergie wird in den Ozeanen und Seen gespeichert. So sorgt beispielsweise das Mittelmeer auch im Winter für angenehme Temperaturen, da es selten kälter als 12°C wird.
Durch eine regional unterschiedliche Erwärmung der Wasser- und Landmassen kommt es zu Ausgleich der Temperatur, welche sich als Wind äußert. Desweiteren führen Wärmeunterschiede auch zu globalen Meeresströmungen, die sehr große Wärmemengen transportieren (z. B. Golfstrom, Humboldtstrom, äquatorialer Strom und ihren Gegenströmungen).
Der Golfstrom ist für Europa besonders wichtig. Warmes Wasser aus dem Golf von Mexiko zirkuliert um den halben Erdball und erwärmt unser Klima in Europa um ca. 10-15°C.

Als Regen ist Wasser für die Natur, das Leben und die Landwirtschaft sehr wichtig! Für manche Gebiete in Europa, wie z.B. Südspanien reicht der Regen kaum aus, um alle Menschen mit genügend frischen Wasser zu versorgen. Der minimale Bedarf eines Menschen liegt bei 2-3l/ Tag. Zum Waschen, duschen und zur Nahrungsmittelproduktion benötigen wir im Schnitt 150l/Tag.
d) Wassergehalt in einigen Nahrungsmitteln
|
Butter 18 % |
Käse 30 bis 60 % |
Fleisch 60-75 % |
Wassermelone 90 % |
|
Brot 40 % |
Joghurt, Milch 75 % |
Apfel, Birne 85 % |
Gurken, Tomaten 98 % |



Drei Bilder aus Spanien: Das erste zeigt die trockene Landschaft Andalusiens. Der Boden ist so trocken, sodass hauptsächlich Oliven angebaut werden. Das zweite Bild zeigt den trockenen Boden im Oktober aus der Luft. Beim dritten Bild muss man genau hinschauen. Es ist eine Talsperre im Zentrum Spaniens, die roten Randbereiche sind die, bis zu der sie mal mit Wasser gefüllt war. Der Boden hat sich durch die enthaltenen Eisensalze, welche bei Dürre nach oben steige und so stärker konzentrieren, rotgefärbt.
Wasserverbrauch
Der Wasserverbrauch des Menschen ist von der Entwicklung des Landes, in dem er lebt und vom Angebot stark unterschiedlich. Es wird verwendet für den Verzehr (Trinkwasser), Waschen, Kochen, Landwirtschaft, Industrie u.a.
Der Wasserbedarf in Deutschland betrug 1991 47,9 Milliarden m3, wovon allein 29 Milliarden m3 als Kühlwasser in Kraftwerken dienten. Rund 11 Milliarden m3 wurden direkt von der Industrie genutzt, 1,6 Milliarden m3 von der Landwirtschaft. Nur 6,5 Milliarden m3 dienten der Trinkwasserversorgung.
Täglicher Wasserverbrauch:
- In Deutschland bis zu 130-300l/ Person
- In USA bis zu 600l/ Person (z.B. durch viele Golfplätze oder Städte in der Wüste, wie Las Vegas)
- In Entwicklungsländern teilweise 4l/ Person
Der durchschnittliche Trinkwasserverbrauch beträgt in Deutschland ca. 130 Liter pro Einwohner und Tag. Dieser Wert ist leicht im Sinken. So lag nach dem zweiten Weltkrieg der Verbrauch noch bei ca. 150l/ Tag. An dieser Ersparnis haben v.a. effizientere Wasch- und Spülmaschinen, wassersparende Toilettenspülungen und ein umweltfreundlicheres Bewusst sein einen großen Anteil. Auch die Industrie muss heute wassersparender produzieren als noch in den Nachkriegsjahren.
Aufgaben:
1. Vergleiche die Zahlen des täglichen Verbrauchs. Brauchst Du wirklich soviel Wasser?
2. a) Messe mindestens eine Woche lang den täglichen Wasserverbrauch und trage die Werte in die Tabelle ein (beachte, dass ihr unter Umständen mehr als einen Wasserzähler im Haus habt).
b) Erstelle dann ein Koordinatensystem. Wie erklärst Du Dir die Sprünge darin?
|
Tag |
Zähler 1 [m3] |
Zähler 2 [m3] |
Verbrauch [l] |
|
Mo |
|||
|
Di |
|||
|
Mi |
|||
|
Do |
|||
|
Fr |
|||
|
Sa |
|||
|
So |
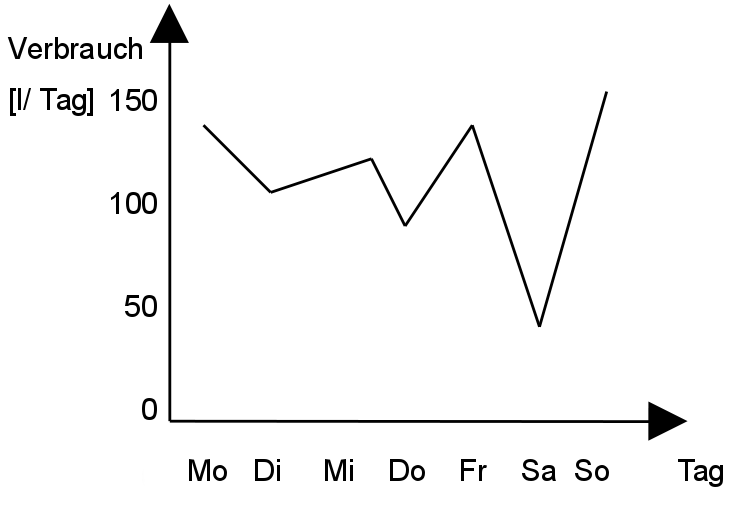
3. a) Nenne die Deiner Meinung nach größten Wasserverschwender im Haus.
b) Erarbeite Tipps, wie man Wasser sparen kann.
4. Wasserverschmutzung: Informiere Dich über verschmutzte deutsche Flüsse und Gewässer. Was sind diese „Verschmutzungen“? Wie kann man Wasser reinigen?
Versuche für zu Hause
Manchmal kann man auch kleine Versuche zu Hause durchführen. Suche dir einen der folgenden Versuche aus und dokumentiere ihn mit einem Versuchsprotokoll. Wer möchte, kann auch Fotos einbinden oder ein Erklärvideo erstellen.
a) Diffusion von Tee in warmen und kalten Wasser
Öffne einen Teebeutel (oder nimm lose Teeblätter) und erstelle zwei gleich große Portionen Tee. Nun nimmst Du zwei gleich große Gläser und füllst sie einmal mit kaltem Wasser und einmal mit heißem Wasser. Gib nun den Tee von oben hinzu und messe die Zeit, bis in beiden Gläsern die Farbe gleichmäßig verteilt ist.
Die Schlussfolgerungen sollten u.a. auch das Teilchenmodell sowie eine Erklärung zur Diffusion enthalten.
b) Färbung bei Rotkohl
Nimm Rotkohlblätter (kann auch aus der Konserve sein), zerkleinere sie und kippe warmes Wasser drauf. Wenn das Wasser eine gute Färbung angenommen hat, teile die Lösung auf mindesten 5 Gläser auf und untersuche damit nun Haushaltsmittel. Mögliche Substanzen zur Untersuchung können sein:
Fruchtsaft, Cola, WC-Reiniger, Essig, Abflussfrei (Vorsicht!), Backpulver, Zitronensaft und viele mehr!
Die Schlussfolgerungen sollten u.a. auch das Teilchenmodell und die Wirkung von Säuren und Laugen enthalten.
c) Löslichkeit von Kochsalz
Für den nächsten Versuch benötigst Du ca. ein halbes Paket Kochsalz. Frag Deine Eltern erst, ob ihr preiswertes habt. Normalerweise kostet ein solches Paket nicht mehr als 20ct, verwendet also bitte nicht das Feinschmeckersalz aus dem Himalaya für 100 Euro ;-)
Nimm ein Glas mit kaltem Wasser und fülle es bis zu einer Markierung mit ca 0,1 - 0,2 l Wasser. Nun gib nach und nach immer mehr halbe (oder genau gestrichen volle) Teelöffel Kochsalz hinzu, rühre und schaue, ob es sich noch auflöst. Notiere diesen Wert.
Das Glas wird ausgekippt und ausgespült und nun wird der Versuch mit möglichst heißem Wasser wiederholt. Die Anzahl an gestrichenen Teelöffeln wird ebenfalls notiert.
Die Schlussfolgerungen sollten Gedanken enthalten, was sich bei heißem Wasser geändert hat. Bedenke das Teilchenmodell!
Bei allen Versuchen vorher die Eltern fragen! Kein Feuer oder Flammen verwenden! Für heißes Wasser reicht es einen Teekocher zu benutzen! Aber achtet darauf, dass auch heißes Wasser Verbrennungen verursachen kann. Das Wasser muss nicht kochen und Eure Gefäße müssen stabil stehen, ohne umzufallen.
Viel Spaß :)
Übung: Trennungen und Trennungsmethoden
Wir haben in einer der vorherigen Lektionen schon Gemische getrennt. Hier lernst Du weitere Methoden. Sie können auch benutzt werden, um z.B. verunreinigtes Wasser zu reinigen.
Die folgenden fettgedruckten Wörter bezeichnen Methoden, die für die davor stehenden Gemische gut geeignet sind.
Sand & Wasser => Sedimentieren und dann Dekantieren
Der Ausdruck Dekantieren bezeichnet den Prozess der Abtrennung eines ungelösten Feststoffes oder einer nicht vermischten Flüssigkeit aus einer zweiten Flüssigkeit. Nach einer Ruhezeit in einem Gefäß setzt sich der Feststoff am Boden ab (wie Kakaopulver in der selbst gemachten Trinkschokolade). Dieser Vorgang heißt Sedimentieren.
Die Flüssigkeit schwimmt über dem Feststoff, oder das Öl auf dem Wasser. Durch vorsichtiges Abgießen einer Schicht kann man die Stoffe trennen, sozusagen "an einer Kante trennen" (=Dekantieren). Diese Methode funktioniert z.B. auch bei Benzin und Wasser.
Alkohol & Wasser => Destillieren
Wenn zwei Stoffe unterschiedliche Siedepunkte haben, verdampft ein Stoff früher als der andere (in dem Fall würde der Alkohol zuerst verdampfen, da sein Siedepunkt bei ca. 78°C liegt)
Kieselsteine & Sand => Sieben
Mit einem Sieb können Sand und Steine leicht getrennt werden.
Sand & Wasser => Filtern
Mit einem Filterpapier und einem Trichter lassen sich Sand und Wasser leicht trennen. Diese Methode funktioniert immer dann, wenn einer der beiden Stoffe größer und der andere kleiner als die Poren des Filters ist. Diese Methode ist dem Sieben sehr ähnlich, nur dass die Poren viel kleiner sind.
Eisen & Schwefel => Trennung mit Magneten
Sofern sich zwei Stoffe in ihren magnetischen Eigenschaften unterscheiden, können sie leicht durch einen Magneten getrennt werden. Auf diese Weise können auch zwei Metalle getrennt werden, sofern eines davon aus Eisen, Nickel oder Cobalt besteht.
Sand & Wasser => Zentrifugieren
Beim Zentrifugieren werden die unterschiedlichen Dichten der beiden Stoffe ausgenutzt. Der Stoff mit der höheren Dichte, wird stärker nach außen geschleudert (vergleiche mal mit einer Fahrt in der Berg-und-Tal-Bahn oder einem Kettenkarussell). Diese Methode funktioniert ebenso mit zwei Flüssigkeiten verschiedener Dichte oder auch nasser Wäsche in der Wäscheschleuder.
Inhaltsstoffe in Filzstiften => Chromatographie
Mache mal auf ein Filterpapier Punkte in 1,5 cm Höhe mit einem schwarzen Filzstift. Stelle alles in ein mit Wasser gefülltes Becherglas (nur 1cm). Was kannst Du sehen?
Die Erklärung hierzu ist für Deinen Wissensstand noch sehr schwierig. Es hängt mit der unterschiedlichen Polarität der im Filzstift enthaltenen Farben zusammen. Sie werden je nach Polarität bis zu einer gewissen Höhe „mitgenommen“
Weitere Infos: https://de.wikipedia.org/wiki/Chromatographie
Aufgaben:
- Erkläre mit Deinen Worten das Prinzip, was hinter allen Trennungsvorgängen steht
- Erstelle eine tabellarische Übersicht (oder ein Mindmap), welches die verschiedenen Methoden wiedergibt und finde zu jeder Methode mindestens noch ein Beispiel aus dem täglichen Leben.
Trennen eines Sand/ Salz Gemisches
V: Mit verschiedenen Mitteln soll ein Sand/ Kochsalzgemisch getrennt werden. Die Schüler dürfen selbst entscheiden, wie sie vorgehen.
Eine Möglichkeit besteht, darin Wasser als dritten Stoff zuzufügen und das Salz darin aufzulösen. Dann wird der Sand vom Salzwasser abfiltriert. Das Wasser lässt man verdampfen. Salz bleibt über.
Angewandte Trennung: Wasseraufbereitung
Eine praktische Bedeutung erhalten Trennungen beim Aufbereiten von Flusswasser als Trinkwasser:

Hier fließt die sehr saubere Isar durch die bayerischen Alpen. Bei Regen und Unwetter wird allerdings Schlamm aufgespült, welcher das Wasser braun färbt (siehe die Reste rechts im Bild). Durch nur wenige Trennungsschritte kann man daraus sauberes Trinkwasser gewinnen.
Extraktion von Erdnussöl aus Erdnüssen
Um Erdnussöl im Labor aus Erdnüssen zu extrahieren, bzw. um zu zeigen, wie viel Öl allein in einer Packung enthalten sind, eignet sich folgender kurzer Versuch:
V: Eine Packung Erdnüsse wird im Mörser mit Diethylether oder Aceton zermörsert. (Diethylether ist gründlicher, Aceton evtl. gesünder). Es entsteht zuerst ein Brei, aus dem dann Öltropfen austreten. Das freiwerdende Öl wird abgegossen und mit dem noch enthaltenen Aceton an die frische Luft gestellt. Es verdampft innerhalb weniger Minuten.
B: Es entsteht zuerst ein Brei, aus dem dann Öltropfen austreten.
S: Nüsse enthalten sehr viel Öl. Dieses wird durch das Lösungsmittel Aceton herausgelöst. Im Luftzug des Abzugs verdampft es schnell - zurück bleibt das Öl.
Info: Erdnussöl
Erdnussöl ist ein Pflanzenöl, welches große Anteile an ungesättigte (essentiellen) Fettsäuren enthält. Weiterhin enthält es Vitamin E und eignet sich für die cholesterinarme Kost. Es ist hoch erhitzbar (Rauchpunkt 230°C).
Kaltgepresstes Erdnussöl ist erkennbar am nussigen, milden Geschmack und Geruch sowie der leicht gelben Färbung. Raffiniertes Öl ist eher geruchsneutraler und farblos-transparenter. Es wird nicht so schnell ranzig, wie andere Fette. Eine Aufbewahrung von mehreren Monaten ist problemlos möglich. Bei Kühlung sogar bis zu einem Jahr!
Bei Temperaturen unterhalb 10°C wird es aber sehr dickflüssig und dann schließlich fest.
Verwendung
- die asiatische Küche verwendet es zum Braten im Wok
- generell alles in der Küche, wo hohe Temperaturen gewünscht sind (Braten, Grillen, Frittieren).
- Wegen des Aromas gut zum Würzen
- Massageöl
- Herstellung von Margarine
- Kosmetische Hautöle
- Badeöle bzw. Badeölzusatz
- Haarkuren bei Kopfschuppen
Zusatzinformationen
https://de.wikipedia.org/wiki/Pflanzenöl
https://de.wikipedia.org/wiki/Erdnuss
https://de.wikipedia.org/wiki/Erdnussöl
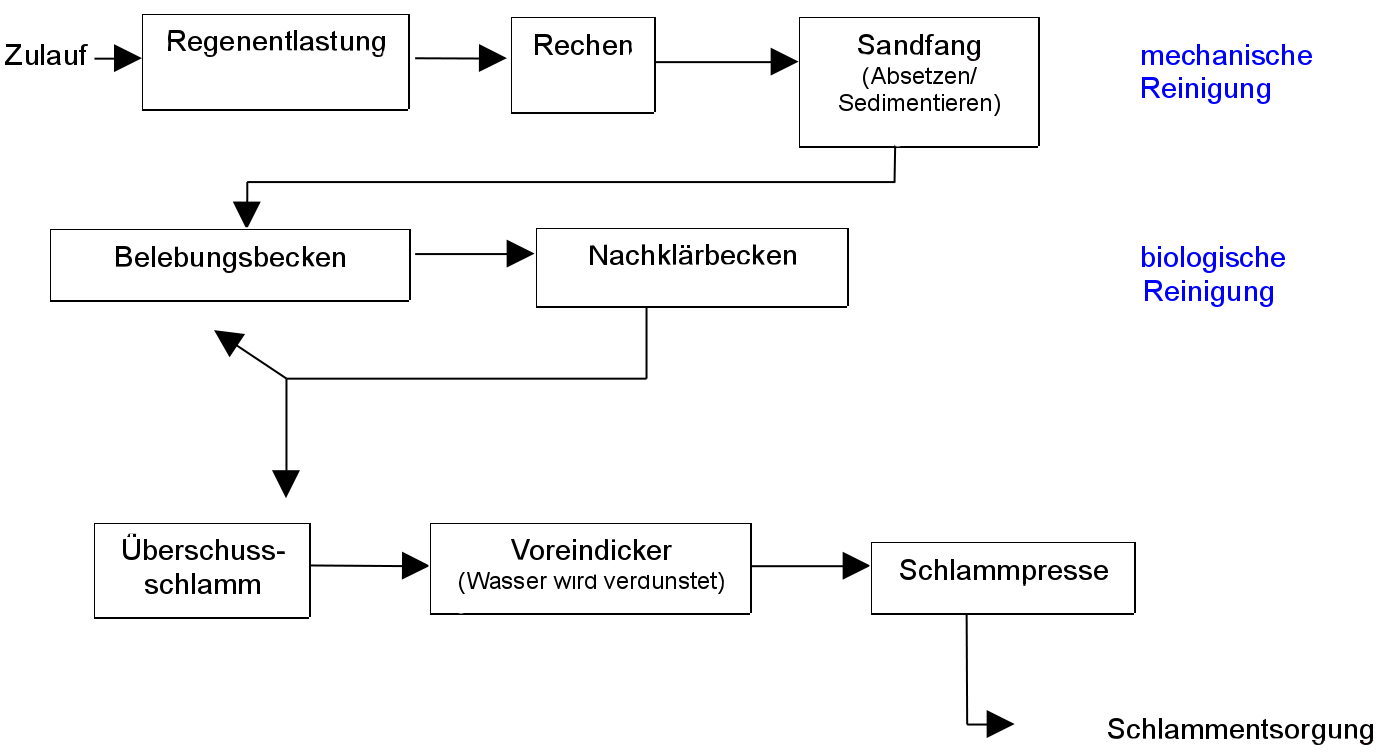
Die Kläranlage
mechanische Stufe biologische Stufe chemische Stufe
Rechen Sandfang Vorklärbecken Belebtschlammbecken Denitrifikation Nachklärbecken Flockungsbecken
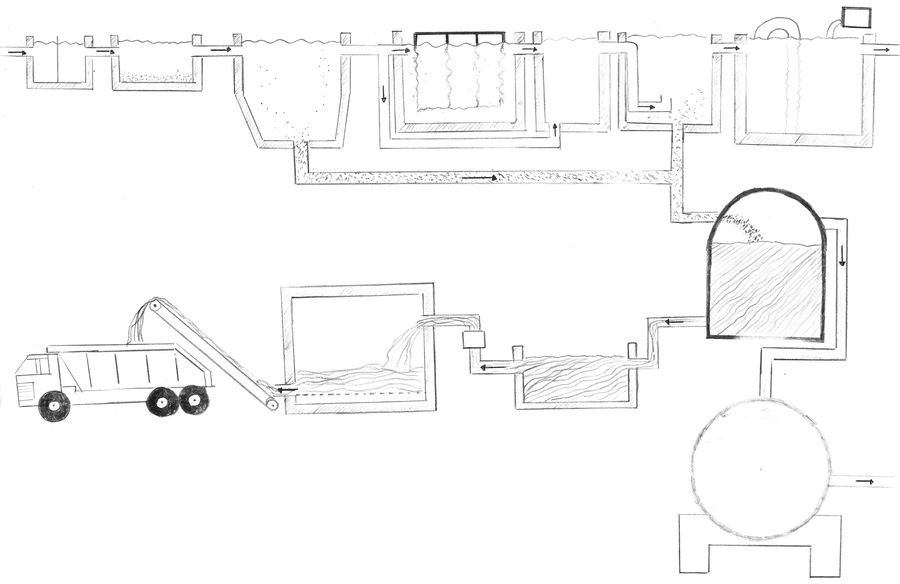
Abtransport des Schlamms Schlammentwässerung Eindicker Schlammfaulraum mit Gasbehälter

Kläranlage aus der Luft: Welche Bereiche der oberen Grafik, kannst Du zuordnen?
Abwasserreinigung im Detail
Die Reinigung in Kläranlagen erfolgt in drei Reinigungsstufen. Jede dieser Stufen kann in weitere Unterstufen unterteilt werden, um verschiedene Arten von Stoffen zu entfernen:
Mechanische Reinigungsstufe
Überwiegend Trennung durch physikalische Unterschiede, wie Teilchen Größe, Dichte usw. Dabei werden bis zu 30 % der festen Schwimm- und Schwebstoffe durch Abfiltern und Reusen von Feststoffen und Fremdkörpern durch eine Rechenanlage, einem folgenden Sandfang und einem Vorklärbecken, wo feinste Feststoffe sedimentieren, entfernt.
1.1 Regenentlastung
Aus den Straßengräben und Kanalsystem entlang der Straßen gelangt immer auch Regenwasser in die Kanalisation. Zum Teil ist dies notwendig, um das mit fäkalien verschmutzte Wasser zu verdünnen, aber es darf nicht zu viel werden, um die Kläranlage nicht zu überspülen. Deshalb wird Regel ein Teil des Regenwassers über einen Regenüberlauf in einem Regenüberlaufbecken gespeichert.
1.2 Der Rechen:
Ein Rechen ist ein metallisches Gitter, durch den das Wasser läuft. Große Schwimmstoffe, wie Papier, Holz, Fäkalstoffe, Damenbinden, Laub und tote Tiere (z.B. Ratten aus den Kanälen) bleiben hier hängen und werden dann mechanisch entfernt. Manchmal sind hintereinander mehrere Rechen aufgestellt, welche ein immer engmaschigeres Netz haben, sodass immer feinere Stoffe abgefiltert werden.
1.3 Der Sandfang
Feste und vor allem sehr kleine Schwebstoffe wie feine Lebensmittelreste, Kieselsteine, Lehm und Sand kann der Rechen nicht entfernen! Im Sandfang steht das Wasser eine Zeitlang still und so setzten sich die feinsten Schwebstoffe langsam ab. Man sagt, sie sedimentieren.
1.4 Das Vorklärbecken (nicht immer vorhanden)
Letzte Reste der organischen, festen und ungelöste Stoffe setzen sich in diesem Becken ab, in welchem das Wasser noch länger verharrt, um auch kleinste Teilchen die Chance zu geben, zu Boden zu sinken.
Biologische Reinigungsstufe
Abbau durch Mineralisierung von organischen Substanzen durch luftliebende (=aerobe) Mikroorganismen (v.a. Bakterien und Wimperntierchen). Damit die aeroben Bedingungen erhalten bleiben, muss aufgrund von Mangel an Produzenten das Wasser mit Sauerstoff belüftet werden.
2.1 Das Belebtschlammbecken
Ion diesem Bereich werden zum Klärwasser große Mengen von Bakterien zugegeben, welche sich von den organischen Stoffen, insbesondere den gelösten Fäkalstoffen ernähren und diese dabei aufbrauchen. Die Bakterien scheiden vor allem dann harmlose anorganische Stoffe wieder aus.
Damit diese Bakterien sich gut vermehren können, muss Sauerstoff vorhanden sein. Dies verhindert im Übrigen auch Fäulnis. Durch ein Gebläse wird ständig etwas Sauerstoff dem Becken zugefügt.
Im Detail werden Kohlenstoffverbindungen mit großen Molekülen in kurzkettigere und kleinere Moleküle umgewandelt. Dabei entsteht Biomasse, Kohlendioxid und Stickstoff (meist in Form von Nitrat). Am Ende bleibt der Klärschlamm zurück.
2.2 Das Nachklärbecken
Im Nachklärbecken wird der vorher entstandene Klärschlamm von den Bakterien (=Belebtschlamm) getrennt. Die Bakterien gelangen zurück ins Belebtschlammbecken. Reste des Klärschlamms werden oft in Faultürmen unter anaeroben Bedingungen (=kein Sauerstoff) zu Biogas (=Methan) umgesetzt.
Chemische Reinigungsstufe
Falls notwendig, werden in einer dritten Stufe gelösten anorganische Salze, v.a. Phosphate, durch Zugabe von Fällungsmitteln, wie z.B. von Eisenionen ausgefällt. So bildet sich das schwerlösliche Eisen(III)-phosphat, welches als Feststoff leicht dem Wasser durch Sedimentation entzogen werden kann. Auch Oxidationen werden angewendet, um so das Wasser sauberer zu bekommen.
Aufgabe:
1. Markiere alle Schlüsselwörter und bereite einen Vortrag zum Thema „die Kläranlage“ vor. Zur Unterstützung kannst Du im Internet Bilder von Kläranlagen suchen und den einzelnen Stufen zuordnen.
Informationen zum Thema „Wasserstoff“
Wasserstoff ist das erste Element des Periodensystems. Es hat das Symbol H (vom lateinischen Wort „hydrogenium“). Allerdings kommt Wasserstoff in der Natur nicht elementar als H vor, sondern als H2 (vergleichbar dem Sauerstoff, der als O2 vorkommt).
In der Natur kommt das Element Wasserstoff vor allem auch gebunden an andere Elemente vor. Die bekannteste dieser Verbindungen ist Wasser mit der Formel H2O.
Demoversuche zu den Eigenschaften:
Füllen eines Standzylinders
Umfüllen von H2 in zweiten Standzylinder => Dichte ist sehr gering
Luftballon mit H2 füllen => Dichte ist geringer als die der Luft (H2 = 0,09 Kg/ m³ ; Luft = 1,29 Kg/m³ (=> leichtestes Element, Zeppelingas)
Das Element Wasserstoff:
Zuerst entdeckt wurde Wasserstoff vom englischen Chemiker Henry Cavendish im Jahre 1766. 21 Jahre später wurde es von Antoine Lavoisier auf zuerst Französisch „Wasser-Bildner“ benannt: hydro-gène (hydro - Wasser, genes = erzeugend). Im Grunde bedeutet es dies ja auch im Deutschen, der Stoff, der Wasser bildet.

Wasserstoff ist das am einfachsten aufgebaute und das leichteste Atom. Bei Raumtemperatur ist es ein Gas und leichter als Luft (etwa 14-mal leichter). Der Schmelzpunkt liegt bei -262°C, der Siedepunkt bei -253°C.
Wasserstoff ist geruchlos und farblos. Es hat von allen Gasen die beste Wärmeleitfähigkeit. Es diffundiert aufgrund seiner Größe sehr schnell. Das bedeutet, dass sich das Gas sehr schnell im Raum verteilt.
Da es als Teilchen so klein ist, kann es selbst durch Stahl hindurchdiffundieren, sodass seine Aufbewahrung und Lagerung, z.B. in Gastanks bei Wasserstoffautos sehr schwierig ist.
Vorkommen des Elementes Wasserstoff:
Im Weltall ist elementarer Wasserstoff das häufigste Element (75 % der gesamten Masse des Universums, was ca. 90% aller Atome entspricht.
Sterne/ Sonnen bestehen hauptsächlich aus Wasserstoffplasma. Dabei verschmelzen unter Energiefreisetzung zwei Wasserstoffatome zu Heliumatomen, welches keine chemische Reaktion ist, sondern eine sogenannte Kernfusion. Diese physikalische Reaktion ist die hauptsächliche und größte Energiequelle. In einer Wasserstoffbombe sowie in (bisher nur experimentellen) Fusionsreaktoren wird diese Energie ebenfalls freigesetzt. Könnten die Menschen diese Reaktion sicher kontrollieren und die hohe Energie Freisetzung richtig nutzen, dann wären sämtliche Energieprobleme der Menschheit gelöst!
Verbindungen von Wasserstoff:
Wasserstoff vereinigt sich mit sehr vielen anderen Elementen. Von keinem anderen Element sind so viele Verbindungen bekannt. Neben Wasser kommt es auch in Ammoniak (NH3) Methan (Hauptbestandteil des Erdgases (CH4) und fossilen Brennstoffen (z.B. Octan aus Benzin: C8H18) vor.
Alle Lebewesen enthalten es, nicht nur in Form von Wasser, sondern auch in den Eiweißen, Fetten und in unzähligen Verbindungen.
Gewinnung von Wasserstoff:
- Säuren bilden mit unedlen Metallen (z. B. Zink oder Magnesium) Wasserstoff
- durch Zersetzung / Elektrolyse von Wasser
- Elektrolyse von Natronlauge
- Reaktion von Wassers mit Alkalimetallen (Metalle der ersten Hauptgruppe)
- Gewinnung aus Erdgas oder anderen Kohlenwasserstoffen mit Wasserdampf (=Dampfreformierung)
Reaktionen von Wasserstoff:
- Bei Zimmertemperatur reagiert Wasserstoff kaum => Aktivierungsenergie ist notwendig
- Wasserstoffbildung durch Zersetzung von Wasser im Hoffmann'schen Wasserzersetzungsapparat/ Dreischenkelgerät
- Verbrennung von Wasserstoff / Knallgasreaktion:
2H2 + O2 --> 2H2O + E (E = -570 kJ/ mol) - Diese Reaktion dient auch als Nachweis (Knallgasprobe): Hört man beim Entzünden i Reagenzglas ein „ploppendes Bellen“, dann lag Wasserstoff vor.
- Seifenblasen mit Wasserstoff füllen, anzünden
- Verbrennung in einer Blechdose oder einem Luftballon. Das Produkt ist H2O
- Verbrennung im umgekehrten Standzylinder
- Sonne: Fusion von zwei Wasserstoffatomen: H + H --> He (Achtung: keine chemische Reaktion)
Aufgaben:
1. Fasse den Text mit eigenen Worten zusammen und bereite einen Vortrag zum Thema „Wasserstoff und seine Verwendung“ vor.
Zusatzinformationen:
https://de.wikipedia.org/wiki/Wasserstoff
https://commons.wikimedia.org/wiki/Category:Zeppelin
Wasserstoff [H2]
a) Eigenschaften
Wasserstoff ist ein farb- und geruchloses Gas geringer Dichte und steht im Periodensystem an erster Stelle. Mit nur 1,0079u hat Wasserstoff die geringste Atommasse aller Elemente und ist daher das leichteste Gas überhaupt (ca. 15 mal leichter als Luft).
Es kann nur schwer gelagert werden, da seine Atome sehr klein sind und durch alle anderen Stoff hindurch diffundieren. Der Smp. beträgt -262.0°C. Der Sdp. liegt bei -252,7°C. Flüssiger Wasserstoff ist somit ein sehr gutes Kühlmittel.
Verwendet wird das Wasserstoffgas als Treibstoff für Raumschiffe, in Brennstoffzellen und als Ausgangsstoff für chemische Reaktionen. Bis 1935 wurde es als Treibgas für Zeppeline verwendet.

Quelle Bild: public domain - https://commons.wikimedia.org/wiki/Image:Hindenburg_burning.jpg (US Navy)
b) Herstellung
Wasserstoff entsteht durch:
- die Reaktion verdünnter Säuren mit Metallen (z. B. Zink oder Magnesium),
- durch chemische Reaktion von Erdgas mit Wasserdampf (=Steam-Reforming).
- durch Zersetzung (=Elektrolyse) von Wasser mit Gleichspannung.
E + 2 H2O ---> 2H2 + O2
c) Verbindungen & Reaktionen
Wasserstoff ist das häufigste chemische Element auf der Erde und im Weltall. Es kommt meistens in Verbindungen (z.B. in Wasser, Erdgas und Erdöl) vor.
Es geht mit den meisten chemischen Elementen Verbindungen ein. Dabei werden die Verbindungen mit Metallen Hydride genannt. Metallhydride sind sehr reaktiv und hochexplosiv.
Wasserstoff reagiert mit Sauerstoff zu Wasser. Führt man dies als Nachweis (im Reagenzglas) durch, nennt man es Knallgasreaktion.
2H2 + O2 ---> 2H2O +E
Wichtige Wasserstoffverbindungen:
- Wasserstoffoxid (H2O),
- Wasserstoffperoxid (H2O2),
- Ammoniak (NH3),
- Zucker (C6H12O6),
- Erdgas (CH4)
- sowie alle Säuren
d) Die Brennstoffzelle
"Das Wasser ist die Kohle der Zukunft. Die Energie von morgen ist Wasser, das durch elektrischen Strom zerlegt worden ist. Die so zerlegten Elemente des Wassers, Wasserstoff und Sauerstoff, werden auf unabsehbare Zeit hinaus die Energieversorgung der Erde sichern." (Jules Verne, Paris 1874)
Eine Brennstoffzelle ist eine elektrochemische Zelle, die die Reaktionsenergie der Reaktion von Wasserstoff mit Sauerstoff in nutzbare elektrische Energie umwandelt. Als Produkte entstehen dabei keinerlei Abgase, sondern nur Wasser!
Die modernsten deutschen U-Boote (Klasse 212) werden seit 2003 durch Brennstoffzellen angetrieben. Mehrere Automobilfirmen (u.a. DaimlerChrysler, Ford, Honda, Opel) forschen seit zum Teil 20 Jahren an Automobilen, deren Treibstoff Wasserstoff ist und die Brennstoffzellen zur Energieumwandlung sowie einen Elektromotor zum Antrieb nutzen.
Der Grund für diese teure Forschung ist die Einsicht, dass unsere Erdölvorkommen begrenzt sind.
Wiederholungsfragen
Kapitel 5: Teilchentheorie, Löslichkeit und Lösungsmittel
- Warum blubbert kochendes Wasser?
- Kann man aus sprudelndem Mineralwasser eigentlich einen Tee kochen, der normal schmeckt? Erkläre an diesem Beispiel das Lösen von Gasen in Wasser.
- Welches Gas ist eigentlich in Mineralwasser aufgelöst?
- Warum trocknet eine gewischte Tafel eigentlich, sie ist doch kälter als der Siedepunkt von Wasser?
- Wie kann es in einem heißen Sommer passieren, dass die Fische in kleineren Seen sterben? In welchen Jahreszeiten fühlen sich Fische demzufolge am wohlsten?
- Beschreibe, was man beobachtet und was mit den Atomen passiert, wenn man Wasser kocht
- Nenne drei Lösungsmittel und ordne ihnen Stoffe zu, die sich darin auflösen.
- Warum kann sich Salz nicht in Waschbenzin auflösen. Welche Stoffe löst Waschbenzin besser? Nenne eine passende Regel.
- In welcher Lösungsmittelgruppe lösen sich: Säuren, Laugen, Salze, Nagellack, Butter, Ölflecken,
- Ein starker Raucher hat gelbe Finger und Zähne und in der Wohnung gelb-verschmutzte Gardinen. Nur mit Wasser bekommt er es nicht sauber. Was ist für die Verschmutzung verantwortlich und wie kann dem Raucher geholfen werden?
- Erkläre, wie man eine übersättigte Salzlösung herstellen und wie man mit dieser einen Kristall züchten kann.
- Beim Kochen einer gefrorenen Salzlösung kann man zwei interessante Beobachtungen machen. Erkläre sie.
- Erkläre die Wirkung von Streusalz.
- Warum wird in die Scheibenwaschanlage (im Winter) Alkohol zum Seifenwasser zugefügt?
- Warum gefriert eine mit Alkohol enteiste Autoscheibe schneller wieder, als eine, die freigekratzt wurde?
- Stark verschmutze Wäsche wird bei 60°C aber leicht verschmutzte Wäsche nur bei 40°C gewaschen. Nenne Gründe, warum das so empfehlenswert ist.
- Nenne zwei Methoden, wie man fettige Hände nach dem Essen eines Hähnchens reinigen kann.
- Ein Schüler hatte einen Motorschaden mit seinem Mofa. Er vermutet, dass ihm jemand Zucker in den Tank getan hat.
a) Warum ist Zucker für den Motor gefährlich und wie wirkt er sich aus?
b) Kann man den Zucker noch nachweisen - und wie? - Warum schwimmen die Fettaugen in der Suppe oben?
- Beschreibe die chemische Verbindung H2O. Nenne Vorkommen, Eigenschaften und Bedeutung
- Wie erklärst Du Dir den hohen Wasserverbrauch in Deutschland von bis zu 300l/ Tag und Person? (zum Vergleich: in einigen Entwicklungsländern liegt er bei 4l/ Tag und Person!).
- Wie stellt man aus Wasser eigentlich Wasserstoff her? Kann man das auch „kostenlos“ machen?
- Beschreibe Wasserstoff mit seinen Eigenschaften und Reaktionen.
- Nenne chemische Trennungsmethoden und ordne ihnen passende Stoffgemische zu
- Wie funktioniert eigentlich eine Kläranlage?
- Beschreibe die Extraktion von Erdnussöl.
- Beschreibe die Trennung eines Sand-Salzgemisches?
- Vervollständige die allgemeinen Aussagen eines Diagramms:
Je ................ die Gerade, desto höher die Geschwindigkeit. Unterbrechungen hingegen sagen etwas über den .................................... aus. ................... die Kurve , wie gewohnt, danach weiter, so liegt ein ................................ vor, entsteht eine Stufe, so war vielleicht der ..................... aus. Fällt die .................................. , so wurde vielleicht kälteres Wasser zugefügt. - Nenne Messfehler, welche bei der Messung einer Temperatur-Zeitkurve auftreten können.