Einführung in die anorganische Chemie
Christian Ziegler & Holger Hoffmeister
Dieses Buch steht allen Menschen zur freien Verfügung,
solange damit Gutes bewirkt werden kann
Der komplette Inhalt des Buches ist von uns erstellt und steht unter der GNU-Lizenz.
Permission is granted to copy, distribute and/or modify this document under the terms of the GNU Free Documentation License, Version 1.2 or any later version published by the Free Software Foundation; with no Invariant Sections, with no Front-Cover Texts, and with no Back-Cover Texts. A copy of the license is included in the section entitled "GNU Free Documentation License".
Übersetzung: Kopieren, Verbreiten und/oder Modifizieren ist unter den Bedingungen der GNU Free Documentation License, Version 1.2 oder einer späteren Version, veröffentlicht von der Free Software Foundation, erlaubt. Es gibt keine unveränderlichen Abschnitte, keinen vorderen Umschlagtext und keinen hinteren Umschlagtext. Eine Kopie des Lizenztextes ist unter dem Titel GNU Free Documentation License enthalten.
Lizenztext siehe:
https://www.gnu.org/licenses/fdl.txt
https://nautix.sourceforge.net/docs/fdl.de.html
Kapitel 01: Einführung und erste Grundlagen
Vorwort
Dies ist der Versuch ein für alle Menschen frei benutzbares Chemiebuch zu erstellen. Es entstand in Zusammenarbeit von C. Ziegler, Regensburg und H. Hoffmeister, Fulda. Es ist ein freies Buch und "Work in progress", d.h. das ständig Verbesserungen und neue Kapitel hinzu kommen.
Hinweise für Schüler:
Führt keine Versuche alleine ohne das Wissen Eurer Eltern durch. Ich bin sicher, dass wenn ihr etwas versuchen wollt, sie Euch gerne dabei helfen und beobachten. Vor allem entzündet keine Gegenstände oder Chemikalien eigenständig! Führt die Versuche lieber mit Eurem Lehrer in der Schule durch.
- Das aktuelle Dateiformat ist etwas widerspenstig, wenn es darum geht Seiten auf allen Rechner gleich anzuzeigen. Bitte stellt unbedingt einen Seitenrand von jeweils 2cm ein!
- Bis jetzt sind die Einleitungen noch recht knapp. Wenn Du Lust hast, darfst Du gerne ein Kapitel bearbeiten und es mir schicken.
- Wenn Dir Dinge offensichtlich unlogisch erscheinen, so ist es realistisch, dass ich Fehler gemacht habe. Bitte informiere mich darüber.
- Merksätze sind violett gefärbt.
- Meistens entspricht eine Seite einer Unterrichtsstunde und somit einem Thema
- Die Chemie ist im Gegensatz zu anderen Wissenschaften durchgängig, d.h. es gibt keine neuen Themen, welche mit dem vorherigen wenig zu tun haben (Vergleiche in Physik Optik mit Elektronik oder Mechanik). Daraus folgt, dass man nichts vergessen darf. Da das für Menschen beinahe unmöglich ist, ist ein ständiges Wiederholen von Inhalten unverzichtbar. Dieses Buch soll dabei helfen.
- Am Ende einer Seite findest Du oft Zusatzinformationen und Internetlinks, die auf Wikipedia zeigen.
Hinweise an Lehrer:
- Die klassische Reihung, angefangen von den Stofftrennungen hin zu Elementdefinitionen und Atombau ist ein sehr langweiliger Einstieg in so eine spannende Wissenschaft. Leider hält sie sich in vielen Lehrplänen. Ich bin einen anderen Weg gegangen, beim aufmerksamen Lesen werden die Vorteile sicherlich schnell deutlich.
- Es sind so gut wie keine pädagogischen Tipps oder Methodische Hinweise vermerkt, da sich dieses Buch in erster Linie an Schüler richtet, die Chemie erlernen wollen.
- Dieses Buch ist im Sinne des Spiralcurriculums in drei Kreisen aufgebaut. Viele Themen wie Oxidationen, Säuren und Lauge, Atombau usw. tauchen also mehrfach auf, wobei dann bestehendes aufgegriffen wird und Vorwissen erweitert wird. Dabei wurde besonderen Wert auf das Vermeiden von „Einbahnstraßen“, nicht erweiterbaren oder schlicht falschen Konzepten gelegt. Das Buch soll so, wie es ist, von Schülern gelesen werden und sie in ihrer Ausbildung begleiten. Ein Schulbuch eben, kein reines Nachschlagewerk!
Was ist Chemie? Eine Experimentalwissenschaft
Betrachtet man zum Beispiel verschiedene Gegenstände, wie einen Kunststoffbecher, verschiedene Medikamente, ein Glas, einen Metalllöffel, Weihnachtsgebäck, Papier, eine Brille und Deine Kleidung, so kommt man schnell zu dem Schluss, dass es tausende verschiedener Werkstoffe geben muss.
Aber, was hat das alles mit Chemie zu tun? Ganz einfach, in all diesen Stoffen ist Chemie enthalten.
Das folgende Schema zeigt eine Übersicht über die Bedeutung der Chemie im Alltag.
Chemie ist u.a.:
Farben, Lacke, Duftstoffe, Cremes, Kosmetika, Nahrungsmittel, Medikamente, Baustoffe, Pflanzenschutz
Explosionen, Rauch, Gestank, Farbänderungen
Methoden: Destillation, Filtration, Erwärmen, Reinigungen,
Gefahren für Personen
Gefahren für die Umwelt
Säuren, Laugen, Salze, Metalle
Energie und Wärme
Chemie beschäftigt sich mit den Eigenschaften aller Stoffe und den Möglichkeiten,
diese umzuwandeln (Eisen rostet, Gestein verwittert, Holz verrottet, Papier brennt usw.).
In der Natur kann man Chemie unter anderem dadurch beobachten, dass Stoffe vergehen und so andere Stoffe entstehen. Die Wissenschaft Chemie untersucht nun die dahinter liegenden Vorgänge und versucht Erklärungen für diese zu finden. Dazu muss die Chemie Experimente durchführen, welche die Lösung für Unerklärtes und Probleme beantworten sollen.
Vorgehensweise beim Experimentieren - der wissenschaftliche Erkenntnisweg:
Ungelöstes Problem => Hypothese / Vermutung => Experiment => Beobachtung => Schlussfolgerung =>Bestätigung der Fragestellung?
(falls nicht, muss eine neue Frage, evtl. auch eine genauere Fragestellung erfolgen!)
Zu Beginn geht man von einer Problemstellung (bzw. Problemfrage aus). Eine solche Fragestellung könnte z.B. lauten: „Welcher Bestandteil der Luft ist für eine Verbrennung notwendig?“. Anschließend entwickelt man eine Hypothese dazu und daraus dann ein Experiment, um diese Hypothese zu bestätigen oder zu verwerfen. Dazu muss man die Beobachtungen, die man während des Experimentes gemacht hast aufschreiben und untersuchen, was die Gründe für deine Beobachtungen sein könnten. Nun leitet man für das Gesehene eine logische Schlussfolgerung ab, welche im besten Fall einen allgemeinen Sachverhalt erklärt oder beschreibt.
Danach stellst Du dir eventuell zu der vorausgegangenen Fragestellung eine neue, genauere Frage, die Du mit Hilfe eines weiteren Experimentes beantworten möchtest, um genauere Werte oder noch präzisere Aussagen zu erhalten.
Laborordnung
- Schüler dürfen den ………………………. nur in Begleitung des Fachlehrers betreten.
- Mäntel, Jacken und Kleider dürfen nicht auf dem ....................... liegen => Brandgefahr.
- Kleidung mit weiten Ärmeln, Halstücher und Schals sowie lange Haare sind ......................, vor allem wenn eine .......................... in der Nähe ist.
- Gasgeruch sowie Beschädigungen an Gas- oder elektrischen Steckdosen sowie an Geräten oder anderen Gefahrstellen sind dem Lehrer sofort zu melden.
- Das Experiment wird vom Lehrer erst .................. , dabei wird zugehört, dann fragt der Lehrer, ob es noch Fragen gibt, erst danach darf man Aufstehen und mit dem Experimentieren anfangen.
- Die Experimentieranleitungen stets genau beachten. Sie dienen Deiner ........................ . Wenn ein Schüler nicht zuhört, kann er aus ..................................... nicht am Experiment teilnehmen.
- Zu Beginn des Experimentes kontrollieren alle Schüler, ob die .............................. verschlossen sind.
- Bei allen Versuchen wird die ........................... getragen.
- Während des Experimentes und auch danach wird am .............. geblieben und aufgepasst. Umherlaufende Schüler stören die anderen und den Lehrer. Außerdem blockieren sie die ........................
- .................................und das Essen im Chemieraum sind zu Deinem Schutz verboten.
- Halte niemals Dein ...................... über die Öffnung von Gefäßen!
- Halte die Öffnung von ................................... stets fern von Mitschülern.
- Wische alle Flüssigkeitsreste gut und gewissenhaft ab!
- Niemals Chemikalien mischen, ohne vorher den Lehrer zu fragen. Es können unvorhergesehene ............................ stattfinden große Gefahr!
- Gieße Flüssigkeiten so aus den Flaschen, dass keine Tropfen am Gefäß herunter laufen (.........................)
- Nach Versuchsende wird in der Regel erst ........................und ......................... (Reagenzgläser mit der Bürste!). Das heißt nicht, dass die Stunde beendet ist. Danach wird immer der Versuch ausgewertet.
- Chemikalienreste werden nur nach den Anweisungen des Lehrers ……………………...
- Damit alle Freude an den Experimenten haben, reinige alle von Dir benutzten ........................... gründlich.
- Nicht alle Flüssigkeiten dürfen im ........................... entsorgt werden. Das gilt besonders für Säuren! Sie schädigen die Rohre. Auch feste Abfälle gehören nicht in das Waschbecken, hierfür ist der .................. da!
- Am Ende der Stunde werden die ............................ vom Lehrer „abgenommen“, dann wird aufgestuhlt und erst dann ist die Stunde beendet.
- Bei Unfällen das „Notaus“ betätigen, den Raum verlassen und im Sekretariat nachfragen, was zu tun ist. Bei Bedarf, erste Hilfe leisten. Bei Feuer die vorgeschriebenen ………………… benutzen.
Führe nicht selbstständig Versuche mit gefährlichen Stoffen durch!!! Du könntest den kurzen Knall ein Leben lang bereuen.
Lösungsblatt
1. Schüler dürfen den Chemie-Fachraum nur in Begleitung des Fachlehrers betreten.
2. Mäntel, Jacken und Kleider dürfen nicht auf dem Tisch liegen => Brandgefahr
3. Kleidung mit weiten Ärmeln, Halstücher und Schals sowie lange Haare sind gefährlich, vor allem wenn eine Flamme in der Nähe ist.
4. Gasgeruch sowie Beschädigungen an Gas- oder elektrischen Steckdosen sowie an Geräten oder anderen Gefahrstellen sind dem Lehrer sofort zu melden.
5. Das Experiment wird vom Lehrer erst erklärt, dabei wird zugehört, dann fragt der Lehrer, ob es noch Fragen gibt, erst dann darf man Aufstehen und mit dem Experimentieren anfangen.
6. Die Experimentieranleitungen stets genau beachten. Sie dienen Deiner Sicherheit. Wenn ein Schüler nicht zuhört, kann er aus Sicherheitsgründen nicht am Experiment teilnehmen
7. Zu Beginn des Experimentes kontrollieren alle Schüler, ob die Gashähne verschlossen sind.
8. Bei allen Versuchen wird die Schutzbrille getragen.
9. Während des Experimentes und auch danach wird am Tisch geblieben und aufgepasst. Umherlaufende Schüler stören die anderen und den Lehrer. Außerdem blockieren sie die Fluchtwege.
10. Geschmacksproben und das Essen im Chemieraum sind zu Deinem Schutz verboten.
11. Halte niemals Dein Gesicht über die Öffnung von Gefäßen!
12. Halte die Öffnung von Reagenzgläsern stets fern von Mitschülern.
13. Wische alle Flüssigkeitsreste gut und gewissenhaft ab!
14. Niemals Chemikalien mischen, ohne vorher den Lehrer zu fragen. Es können unvorhergesehene Reaktionen stattfinden => große Gefahr!
15. Gieße Flüssigkeiten so aus den Flaschen, dass keine Tropfen am Gefäß herunter laufen (Barkeeperdreh)
16. Nach Versuchsende wird in der Regel erst aufgeräumt und abgewaschen (Reagenzgläser mit der Bürste!). Das heißt nicht, dass die Stunde beendet ist. Danach wird immer der Versuch ausgewertet.
17. Chemikalienreste werden nur nach den Anweisungen des Lehrers entsorgt.
18. Damit alle Freude an den Experimenten haben, reinige alle von Dir benutzten Gegenstände gründlich.
19. Nicht alle Flüssigkeiten dürfen im Waschbecken entsorgt werden. Das gilt besonders für Säuren! Sie schädigen die Rohre. Auch feste Abfälle gehören nicht in das Waschbecken, hierfür ist der Mülleimer da!
20. Am Ende der Stunde werden die Arbeitsplätze vom Lehrer „abgenommen“, dann wird aufgestuhlt und erst dann ist die Stunde beendet.
21. Bei großer Gefahr oder Unfällen das „Notaus“ betätigen, den Raum verlassen und im Sekretariat nachfragen, was zu tun ist. Bei Bedarf, erste Hilfe leisten. Bei Feuer die vorgeschriebenen Fluchtwege benutzen.
Eigenschaften von Stoffen
Wenn man einzelne Stoffe genau im Experiment untersucht, stellt man fest, dass sie sich oft in mehreren Eigenschaften unterscheiden.
Diese Tabelle beschreibt diese Eigenschaften der Stoffe. Aber Achtung! Man muss beachten, dass sich durch ein Experiment die Eigenschaften von Stoffen stark verändern (so ändern sich die Eigenschaften von Stoffen durch Verbrennung oder Auflösen in Wasser).
|
Eigenschaften |
Kohlenstoff |
Eisen |
Schwefel |
Zucker |
|
Farbe: |
schwarz |
silbrig, glänzend |
zitronengelb |
weiß |
|
Zustand: |
Feststoff |
Feststoff |
pulvriger Feststoff |
pulvriger, kristallartiger Feststoff |
|
Geruch: |
kein Geruch |
kein Geruch |
stinkt nicht! |
kein Geruch |
|
Sonstiges: |
nicht magnetisch wasserunlöslich spröder Feststoff |
magnetischer Feststoff leitet den elektrischen Strom wasserunlöslich dehnbar / biegsam |
pulvriger Feststoff wasserunlöslich spröder Feststoff |
kristalliner Feststoff wasserlöslich spröder Feststoff |
=> Stoffe unterscheiden sich in ihren Eigenschaften.
Bei unbekannten Stoffen, kann man diese anhand ihrer Eigenschaften identifizieren.
Wenn man einzelne Stoffe genau im Experiment untersucht, stellt man fest, dass sie sich alle in mehreren Punkten unterscheiden. Solche Unterschiede werden „chemische Eigenschaften“ genannt.
=> Stoffe können wir an ihren Eigenschaften erkennen
Solche chemischen Eigenschaften sind z.B. Farbe, Geruch, Geschmack, Löslichkeit, Brennbarkeit, Leitfähigkeit, Dichte und viele mehr. Sie sind unveränderbar.
Die Dichte (Formelzeichen: ρ (griechisch: rho)), ist das Verhältnis der Masse (m) eines Körpers zu seinem Volumen (V).
Die Einheit der Dichte ist kg/m3. Oft sieht man die Dichte auch noch in g/cm3 notiert.
=> Zwei Stoffe können nicht in allen Eigenschaften gleich sein.
Aber Achtung! Man sollte aber diese Eigenschaften nicht mit physikalischen Zuständen, wie z.B. den drei verschiedenen Aggregatzuständen (fest, flüssig, gasförmig) verwechseln. Bei Wasser kennt man z.B. die Aggregatzustände: Eis - Wasser - Wasserdampf.
Zusatzinformationen:
https://de.wikipedia.org/wiki/Stoffeigenschaften
Bilder von Metallen: Kupfer und Eisen
Kupfer:

Kupfer mit oxidierten Bereichen

Kupfer
Eisen:


Verschiedene Verarbeitungsformen von Eisen (oben und unten als Eisen- oder auch Stahlwolle))
Zink:

Verschiedene Verarbeitungsformen von Zink. Metalle könne als Blech, Draht, Wolle oder Pulver vorkommen.
Bilder von Nichtmetallen: Kohlenstoff




Aufgaben:
1. Kannst Du die Begriffe „Holzkohle“, „Graphit“, „Kohlepulver“ den Bildern zuordnen?
Bilder von Nichtmetallen: Schwefel
Schwefel ist spröde, das heißt, als Feststoff ist er nicht verformbar oder biegsam. Er würde dabei zersplittern. Durch Druck oder Verformung zerbricht Schwefel.

Schwefelpulver sowie Schwefel gepresst in Stangen.
Das Element Schwefel ist ein Stoff, welcher in der Chemieindustrie zu Herstellung wichtiger Stoffe verwendet wird. Im Körper des Menschen spielt er ebenfalls eine Rolle.
Metalle: Herstellung von Gold und Silber
Die Vorgänger der heutigen Chemiker hießen im Mittelalter Alchemisten. Die Alchemie war von der Idee der künstlichen Herstellung von Gold getrieben. Viele Herrscher hatten Alchemisten für sich arbeiten und hofften durch die Entdeckung des „Steins der Weisen“ Gold herstellen zu können. Es gelang allerdings niemanden! Gold kann man nicht einfach so hergestellt werden. Mancher Alchemist bezahlte für diesen Misserfolg mit dem Leben…
In diesem Versuch wirst Du lernen, wie man leicht „Gold“ und „Silber“ herstellen und reich werden kann… ;-)
Außerdem lernst Du hier, wie man ein Versuchsprotokoll erstellt:
Die grün getippten Wörter sollten in jedem Deiner zukünftigen Protokolle auftauchen,
die blauen können zusätzlich ein Protokoll bereichern.
Unverzichtbar ist der violette Merksatz!
Versuch 1 - Herstellung von „Silber“:
Geräte: 2 Bechergläser, Uhrglas, Bunsenbrenner, Dreifuß
Chemikalien: Kupfermünze, Natronlauge, Zinkstaub, Wasser
Versuchsdurchführung:
Gib einige blanke Kupfermünzen in ein Becherglas und übergieße sie mit konzentrierter Natronlauge (20 Pastillen auf 0,5l Wasser). Arbeite sehr gewissenhaft und vorsichtig dabei! Natronlauge schädigt die Augen in Sekundenbruchteilen! Füge dann eine winzige Menge Zinkstaub hinzu, schließe das Becherglas mit dem Uhrglas und erhitze alles mit kleiner Bunsenbrennerflamme ca. 5 min. zum Sieden (Vorsicht: Lauge spritzt!).
Nach einigen Minuten stellst Du die Flamme ab und gießt nach Erkalten in ein anderes Gefäß ab, so dass die Münzen im ersten Becherglas bleiben. Die Münzen werden nun abgespült und anschließen mit einem Tuch poliert.
Zeichnung vom Versuch:
|
Beobachtung |
Schlussfolgerung |
|
- die Lauge kocht und brodelt
- das Centstück färbt sich silbrig
|
=> Nicht nur Wasser kann kochen, auch andere Flüssigkeiten kochen. Chemiker nennen dies auch „sieden“.
=> Das Zinkpulver setzt sich auf der Münze fest und färbt sie silbrig. Die Natronlauge hat dabei die Aufgabe Schmutz und Fett auf der Münze zu lösen, damit sich das Zinkpulver möglichst überall festsetzen kann. |
Verzinken ist in der Technik wichtig als Verfahren zum Schutz vor Rost!
Das Verzinken wird fast überall eingesetzt, wo mit reinem Eisen gearbeitet wird. Da Eisen durch Kontakt mit Luft und Wasser rostet, möchte man es vor Wasser und Sauerstoff schützen, so dass es nicht rosten kann. Diesen Schutz bietet z.B. eine Zinkschicht, welche den Eisengegenstand umhüllt.
Mögliche Einsatzbereiche sind z.B. das Verzinken von Autoblechen, Brückenpfeilern, Geländern, Zäunen, Leitplanken, Werkzeugen usw.
Schülerversuch 2 - Herstellung von „Gold“:
Geräte: Tiegelzange, Bunsenbrenner
Durchführung:
Halte die bearbeiteten Münzen kurz in die rauschende Brennerflamme und wende sie einige Male. Wenn sich ihre Farbe ändert, nimm sie sofort heraus. Lege die heiße Münze NICHT auf den Tisch!
|
Beobachtung |
Schlussfolgerung |
|
Die Münze wird „vergoldet“
|
=> Zink und Kupfer verschmelzen miteinander. Es ist ein neuer Stoff entstehenden. Es hat sich Messing gebildet |
Zusatzinformationen:
Messing ist ein Gemisch und besteht aus Kupfer und Zink. Man nennt Gemische von Metallen auch Legierungen. Die Menschheit hat vor ca. 5000 Jahren erstmalig Messing hergestellt. Waren es anfangs vor allem Waffen, Gefäße, Schmuck und Kunstgegenstände, so werden heute daraus auch Elektrobauteile, Musikinstrumente, Zäune und vieles mehr hergestellt.
Gerade die goldähnlichen Farbe macht Messing für Verzierungen und Beschläge sehr nützlich. Blechblasinstrumente (sowie die Bedienelemente bei Holzblasinstrumenten) werden zum Beispiel aus Messing gefertigt.
Eigenschaften von Messing:
- rötlich glänzendes Metall (je nach Mischungsverhältnis variiert die Farbe von goldorange (bei hohem Kupferanteil) bis hellgelb)
- härter als reines Kupfer
- Schmelzpunkt ca. 900-925 °C (hängt von der Mischung ab)
- Dichte: ca. 8,3 g/cm³
- unmagnetisch
Das Metall Messing ist der Bronze nicht unähnlich. Während Bronze eine Kupfer-Zinn-Lergierung ist, ist Messing eine Kupfer-Zink-Legierung.
Siehe auch: https://de.wikipedia.org/wiki/Bronze
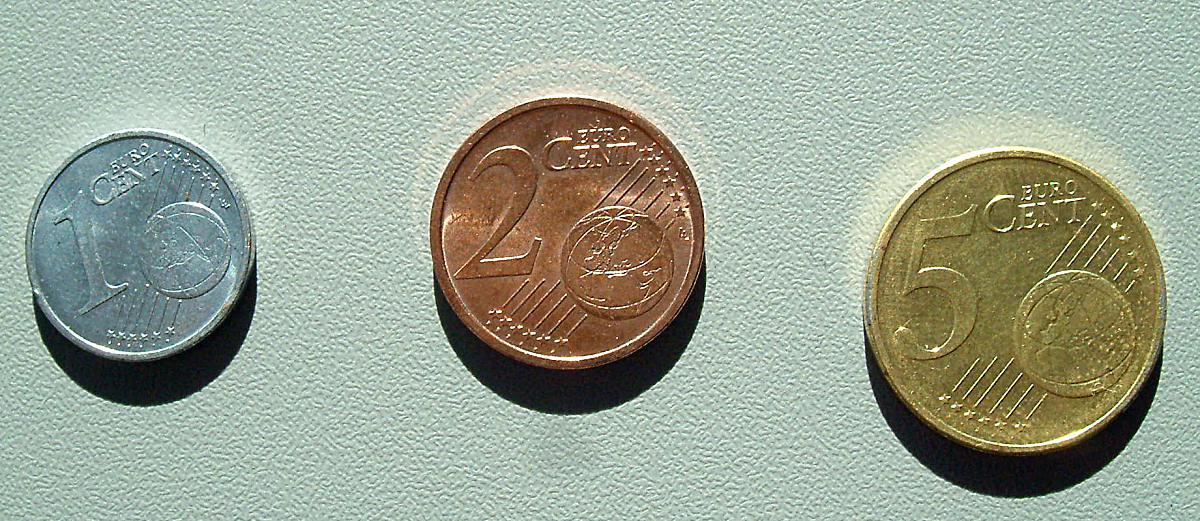
verzinkte Münze - Kupfermünze - messingfarbene Münze
Kennzeichen chemischer Reaktionen
Bei chemischen Versuchen passiert eine ganze Menge, aber was genau unterscheidet sie eigentlich von physikalischen Versuchen? Untersuche im Unterricht verschiedene Alltagsgegenstände und versuche sie dann zu entzünden. Der Pfeil ---> bedeutet übrigens „daraus folgt“.
|
Versuch |
Beobachtung |
Schlussfolgerung |
||
|
Erhitzen von: |
Ausgangsstoff |
Endstoff |
Sonstiges |
|
|
Magnesium- |
- silbrig glänzend |
- weißer, spröder |
- weißer Rauch |
Stoff hat sich verändert |
|
Kerzenstummel |
- rot, fest, wachsartig |
keine Veränderung |
schmilzt |
=> Physik |
|
Rübenzucker |
- weiß, kristallin |
schwarze, feste Masse; enorme Volumenvergrößerung; brennbarer weißlicher Rauch |
brenzliger Geruch |
Stoff hat sich verändert => Chemie |
|
Kupfer |
- metallisch glänzend |
- schwarz |
kurzzeitig grüne Flamme |
Stoff hat sich verändert => Chemie |
|
Magnesium |
- metallisch glänzend |
- weißer, spröder Fest- |
- weißer Rauch |
Stoff hat sich verändert |
|
Zink |
metallisch glänzend |
metallisch glänzend |
=> Physik |
Die Physik befasst sich mit Zuständen und Zustandsänderungen.
Die Chemie befasst sich mit Stoffen und deren Stoffänderungen.
Eine chemische Reaktion ist gekennzeichnet durch eine Stoffumwandlung
und einen Energieumsatz.
Wenn Du also nicht weißt, ob gerade eine chemische Reaktion stattfand, dann untersuche genau, ob einer der beiden Punkte aus der Definition zutrifft:
- Hat sich der Stoff dauerhaft in seinen Eigenschaften verändert?
- Wurde Energie freigesetzt oder wurde Energie benötigt? Wurde es beispielsweise wärmer oder kälter?
Trifft nur einer der beiden Punkte zu, so lag eine chemische Reaktion vor.
Schülerversuch: Untersuchung der Kerzenflamme
Beobachte und zeichne die Kerzenflamme mit ihren verschiedenen Temperaturzonen. Damit Du weißt, welche Zone die heißeste ist, führe anschließend folgende Versuche durch:
V1: Streichholz auf Dochthöhe: V2: Zwei Streichhölzer:
Zeichne die heißeste Stelle ein und dann die Temperaturunterschiede in Deine Zeichnung ein. Kannst Du die Unterschiede erklären?
Im Flammenkern ...............................................................................................................................................
...........................................................................................................................................................................
Im Flammenmantel............................................................................................................................................
...........................................................................................................................................................................
Im Flammensaum .............................................................................................................................................
...........................................................................................................................................................................
V3: Springende Flamme:
Lösche die Kerzenflamme und näher Dich mit brennendem Streichholz von oben dem Docht. Was passiert?
...........................................................................................................................................................................
...........................................................................................................................................................................
...........................................................................................................................................................................
...........................................................................................................................................................................
Fragen für Profis:
1. Woraus besteht der Kern der Flamme?
2. Welcher Vorgang läuft im äußersten Bereich der Flamme (Saum) ab?
Wissenschaftliche Fakten zur Kerzenflamme
Vergleiche die beiden Bilder:

Die Kerzenflamme hat ihre heißeste Stelle an ihrer Spitze, da dort die optimale Mischung aus Sauerstoff und dem Brennstoff Wachs vorliegt.
Der Kern hingegen ist von der Luft abgeschirmt, deshalb kann hier kaum Luft zutreten und der Wachsdampf kann nicht optimal verbrennen.
Im Mantel wird das verdampfte Wachs durch die Hitze zersetzt, es entstehen Rußteilchen und brennbare Gase. Allerdings ist der Mantel noch geringfügig durch den Saum abgeschirmt.
Im Saum können Rußteilchen und Gase optimal verbrennen.
Wissenschaftiche Fakten zur Brennerflamme
Im inneren Flammenkegel ist die Brennerflamme am heißesten, da dort die optimale Mischung von
Erdgas und Sauerstoff vorliegt => optimale Verbrennung
Merke: Für jede Verbrennung werden Sauerstoff und ein Brennstoff benötigt.
Bei optimaler Mischung beider Stoffe, ist die Verbrennung heiß und rußfrei.
Warum brennt eine Kerze?
Was brennt eigentlich an der Kerze - Wachs oder Docht? Mache doch mal den Versuch und entzünde ein Stück Wachs oder einen Wollfaden. Welcher von beiden brennt wie die Kerze?
|
Versuch |
Beobachtung |
Schlussfolgerung |
|
1. Verbrennen des Dochtes |
Docht glimmt, brennt aber nicht |
|
|
2. Versuche ein Wachsstück an Kerze zu entzünden |
Wachs schmilzt, brennt nicht |
|
|
3. Wachs stark erhitzen |
Entzündet sich selbst |
Wachsgase brennen |
=> Nur durch Zusammenwirken von Wachs und Docht kann die Kerze brennen!
Beweis durch Annähern eines Streichholzes an eine gerade erloschene Kerze!
Die Entzündung der Flamme, obwohl der Docht nicht berührt wird, ist der Beweis, dass gasförmiges Wachs der Brennstoff ist.
Weitere Versuche mit der Brennerflamme:
V: Fixiere ein Kupferblech mit einem am Stativ befestigten Reagenzglashalter unmittelbar über dem Mischrohr des Bunsenbrenners. Erhitze mit rauschender Flamme. Zeichne die Flamme, so wie sie auf dem Blech erscheint. Kennzeichne farbig, wo das Kupfer glüht, wo es sich schwarz färbt bzw. blank bleibt.
B: Das Gas brennt zunächst nur unterhalb des Netzes. Erst nachdem das Netz glüht, brennt die Flamme auch oberhalb.
S: Das Gas brennt zunächst nur über dem Netz. Schließlich wird so heiß, dass die Entzündung nach unten durchschlägt.
Das Kupfernetz leitet so viel Wärme ab, dass die Entzündungstemperatur des Gases oberhalb (unterhalb) des Netzes zunächst nicht erreicht wird.
Arbeitsblatt: Die Brennerflamme
1. Der Aufbau der Brennerflamme
a) Skizziere das Aussehen einer Brennerflamme.
b) Für die verschiedenen Flammenzonen wurden folgende Temperaturen gefunden:
400 °C, 1500 °C und 1550 °C.
Versuche diese Zonen zu finden, indem du ein Magnesiastäbchen in verschiedene Zonen der Flamme hältst und beobachtest, wie stark sie jeweils glühen..
Außerdem kannst Du ein Holzstäbchen in zwei verschiedenen Höhen durch die Flamme führen und ausgehend vom Verkohlungsgrad Rückschlüsse ziehen.
c) Halte einen Zündholzkopf unmittelbar über die Mündung des Brennerrohrs (bei einem entzündetem Brenner!) kannst Du es so entzünden? Notiere Deine Beobachtungen:
2. Die „kopflose“ Flamme
Halte ein Kupferdrahtnetz in halber Höhe der rauschenden Flamme waagrecht über den Brenner und zünde das Gas unterhalb des Netzes an!
3. Die Flamme ohne Unterleib
Halte ein Kupferdrahtnetz in gleicher Position wie bei 2. und entzünde den Brenner über dem Netz!
Die Dichte - eine Stoffeigenschaft

Ein Problem der Naturwissenschaftler: Wie kann man die Masse von Stoffen miteinander vergleichen, wenn zwei Körper nicht die gleiche Form und das gleiche Volumen haben?
Betrachte einmal diese Schraubenmuttern, welches Metall mag wohl das schwerste sein?
Dichtewürfel veranschaulichen das Problem des Vergleiches:

Wie kann man zwei Körper unterschiedlicher Form hinsichtlich ihrer Masse vergleichen?
Im Grunde gar nicht! Es sei denn, sie haben das gleiche Volumen, so wie die Dichtewürfel.
Bei Massenvergleichen muss das Volumen mit in Betracht gezogen werden!
Lässt man das Volumen außer acht, könnte man meinen, Kohle sei schwerer als Blei, nur weil man vielleicht zufällig ein großes Stück Kohlenstoff mit einem kleinen Bleiwürfel vergleicht.
Die Lösung dieses Problems: Wir berechnen das Volumen eines Körpers mit ein, indem wir die Masse durch das Volumen teilen. Man erhält so die Dichte.
Die Dichte ist eine Stoffeigenschaft. Jedes Element hat eine andere Dichte.
Man spricht deshalb auch von der spezifischen Dichte.
Bestimmung der Dichte von Aluminium in drei Schritten:
Zur Bestimmung der Dichte muss man die Masse und das Volumen eines Körpers bestimmen:
1. Bestimmung der Masse eines Aluminiumwürfels: Waage: 2.7g
2. Bestimmung des Volumens (zwei Wege sind möglich):
Weg 1: Bestimmung des Volumens durch Messen der Kantenlänge: 1cm3
Weg 2: Bestimmung des Volumens durch Wasserverdrängung: 1ml, das entspricht 1cm3
3. Berechnung der Dichte:
Masse m [g]
Dichte = ——————— = —— ——
Volumen V [cm3]
=> Die Dichte von Aluminium beträgt 2,7 g/ cm3
Die Dichte (Formelzeichen: ρ (griechisch: rho)), ist das Verhältnis der Masse (m) eines Körpers zu seinem Volumen (V). Die Dichte ist eine Stoffeigenschaft.
Die SI-Einheit der Dichte ist kg/m3. Oft sieht man die Dichte auch in g/cm3 angegeben.
Manchmal wird die Dichte auch als spezifisches Gewicht ausgedrückt1.
Versuch zur Bestimmung der Dichte von Feststoffen
V: Schüler bestimmen die Dichte von Alltagsgegenständen
Masse
Dichte = ——————
Volumen
Bestimme die Masse der ausliegenden Stoffe und die Menge an verdrängtem Wasser, wenn der jeweilige Gegenstand in einen Messzylinder gelegt wird.
Erinnere Dich: 1ml Wasser entspricht 1cm3 Volumen.
|
Stoff |
Masse [g] |
Volumen [cm3] |
Dichte |
|
Eisennagel |
g/cm3 |
||
|
Zinnstäbe |
g/cm3 |
||
|
Spielsteine aus Kunststoff |
g/cm3 |
||
|
Gummischeibe |
g/cm3 |
||
|
Holz |
g/cm3 |
||
|
Aluminium |
g/cm3 |
||
|
Reißzwecke |
g/cm3 |
Bestimmung der Dichte einer Flüssigkeit
Die bisher verwendete Methode wird schwierig,wenn der Gegenstand Wasser nicht verdrängt und man so nicht das Volumen bestimmen kann.
Aufgabe: Bestimme die Dichte von Pflanzenöl (1 Flasche Sonnenblumenöl steht zur Verfügung).
Ergebnis:
Im Messzylinder ein bestimmtes Volumen an Öl abmessen (z.b. 50ml) und dass dann wiegen. Dazu den Messzylinder mit und ohne Öl messen.
Als Ergebnis wird ca.0,90 g/cm3 gemessen.
Aufgaben:
- Überlege einmal, Wie man die mittlere Dichte Deines Körpers bestimmen kann? Schlage ein Experiment vor (Tipp: Überlege Dir die Lösung in einer voll gefüllten Badewanne ;-) )
- Vergleiche im Experiment die Dichten von Holz, Aluminium und Blei.
- Betrachte die Dichtetabelle. Aus welchen Materialien würdest Du umweltfreundlichere Autos bauen? Warum?
- Begründe, warum Angler gerne einen kleinen Massekörper (z.B. aus Blei) an ihrer Angelschnur befestigt haben.
- Stoffe dehnen sich beim Erwärmen aus. Hat das einen Einfluss auf die Dichte? Wenn ja, finde eine Lösung, wie man weltweit, in verschiedenen Klimazonen die Dichten vergleichen kann.
Zusatzinformationen: https://de.wikipedia.org/wiki/Dichte
Dichtetabelle
Diese Tabelle gibt die Dichte einiger Stoffe und Elemente bei Normaldruck an:
-
Stoff
Dichte
Osmium
22,6 g/cm3
Platin
21,5 g/cm3
Gold
19,3 g/cm3
Uran
18,7 g/cm3
Quecksilber
13,6 g/cm3
Blei
11,3 g/cm3
Silber
10,5 g/cm3
Kupfer
8,9 g/cm3
Eisen
7,9 g/cm3
Zinn
7,3 g/cm3
Zink
7,1 g/cm3
Chrom
6,9 g/cm3
Kohlenstoff
3,5 g/cm3
Aluminium
2,7 g/cm3
Silizium
2,3 g/cm3
Schwefel
2,1 g/cm3
Phosphor
1,8 g/cm3
Magnesium
1,8 g/cm3
Sauerstoff
0,0014 g/cm3
(= 1,4 g/l)
Stickstoff
0,0012 g/cm3
(= 1,2 g/l)
Wasser
0,0010 g/cm3
(= 1,0 g/l)
Eis (bei 0 °C)
0,91 g/cm3
Kalium
0,86 g/cm3
Schaumstoff
0,035 g/cm3
Neon
0,00084 g/cm3
(= 0,84 g/l)
Alkohol
0,00079 g/cm3
(= 0,79 g/l)
Benzin
0,00068 g/cm3
(= 0,68 g/l)
Helium
0,00017 g/cm3
(= 0,17 g/l)
Luft
0,0012 g/cm3
(= 1,2 g/l)
Zusatzinformationen:
https://de.wikipedia.org/wiki/Liste_der_Dichte_fester_Stoffe
https://de.wikipedia.org/wiki/Liste_der_Dichte_von_Flüssigkeiten
https://de.wikipedia.org/wiki/Liste_der_Dichte_gasförmiger_Stoffe
Wiederholungsfragen Kapitel 1
- Nenne Unterschiede zwischen Chemie und anderen Naturwissenschaften.
- Nenne mindestens 10 Punkte der Laborordnung, die Deinem Schutz dienen.
- Erkläre, was nun eigentlich brennt, wenn du eine Kerze angezündet hast. Beschreibe, welche Aufgabe der Docht bei der Kerze hat.
- Die folgenden Sätze beschreiben, was beim Anzünden einer Kerze geschieht. Leider sind sie durcheinander geraten. Wie muss die richtige Reihenfolge lauten?
a) Am Docht befindet sich festes Wachs. Es brennt nicht.
b) Der Wachsdampf entzündet sich und beginnt zu brennen.
c) Das flüssige Wachs steigt im Docht nach oben (ähnlich wie Tinte im Löschpapier).
d) Der Wachsdampf erreicht seine Entzündungstemperatur.
e) Wenn man eine Streichholzflamme an den Docht hält, wird das Wachs erhitzt und schmilzt.
f) Das Wachs beginnt zu sieden und verdampft. - Nenne stichwortartig Eigenschaften der folgenden Elemente: Eisen, Schwefel, Kupfer, Zink, Kohlenstoff, Magnesium, Wasserstoff, Stickstoff, Sauerstoff und Aluminium
- Nenne für jedes der genannten Elemente der vorherigen Aufgabe mindestens einen Verwendungszweck.
- Bilde aus den Elementen der Aufgabe 5 zwei Gruppen und benenne diese.
- Beschreibe, wie man Metalle verzinken kann und beschreibe dann, wie man Messing herstellt.
- Nenne Punkte auf, die man beim Umgang mit Natronlauge beachten muss.
- Nenne Kennzeichen von chemischen Reaktionen.
- Vergleiche die Flammen von Brenner und Kerze. Nenne verschiedene Eigenschaften und die Gründe dafür.
- Wiederhole die Regeln zum Bestimmen der Dichte.
- Nenne die Einheit der Dichte. Gib sie immer bei allen Rechnungen mit an!
- Bestimme das Volumen von 1ml Wasser in cm3.
- Berechne die Dichte eines Kupferwürfels mit dem Volumen von 1,55ml. Wie schwer wäre ein vergleichbarer Bleiwürfel?
- Um welchen Faktor ist das Schwermetall Blei schwerer als das Leichtmetall Aluminium?
- Erstelle ein Experiment, wie man die mittlere Dichte Deines Körpers bestimmen kann. (Tipp: Am besten findest Du die Lösung in der Badewanne). :-)
- Autos enthalten große Anteile von Eisenblechen. Begründe, wie man umweltfreundlichere und vor allem sprittsparende Autos bauen kann.
