- Details
- Zugriffe: 4424
Wiederholungsfragen 4. Lernjahr Chemie - Einführung in die organische Chemie
50 richtig lustige Fragen zur Testvorbereitung
-
Vergleiche Diamant und Graphit hinsichtlich ihrer Eigenschaften und dem Aufbau.
-
Was versteht man unter der „Chemie des Kohlenstoffs“. Nenne den Begründer der organischen Chemie und welchen organischen Stoff er erstmalig im Labor herstellte.
-
Beschreibe die Verbrennung organischer Substanzen am Beispiel der Verbrennung von Benzin (zur Vereinfachung Oktan). Stelle eine Reaktionsgleichung auf und formuliere einen Merksatz, der dies für alle organischen Substanzen zusammenfasst. Zur Übung erstelle dann die Reaktionsgleichungen für die Verbrennung von Methan, Ethan und Propan auf.
-
Welche Konsequenzen ergeben sich aus den Produkten in Aufgabe 3 für unsere Umwelt?
-
Was ist die homologe Reihe der Alkane? Wie unterscheiden sich Alkane, Alkene und Alkine? Nenne je ein Beispiel sowie die allgemeine Formel.
-
Welchen Zusammenhang siehst du zwischen der Länge der Kohlenstoffkette und dem Litergewicht sowie der Siedetemperatur der homologen Reihe der Alkane.
-
Welche Summenformel haben a) Cyclo-Alkane b) Alkene mit zwei Doppelbindungen)?
-
Erkläre den Begriff „Isomer“ und stelle alle Isomere von Hexan auf.
-
Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel C4H9OH an!
-
Wiederhole die Regeln der Nomenklatur und benenne die folgenden Verbindungen:
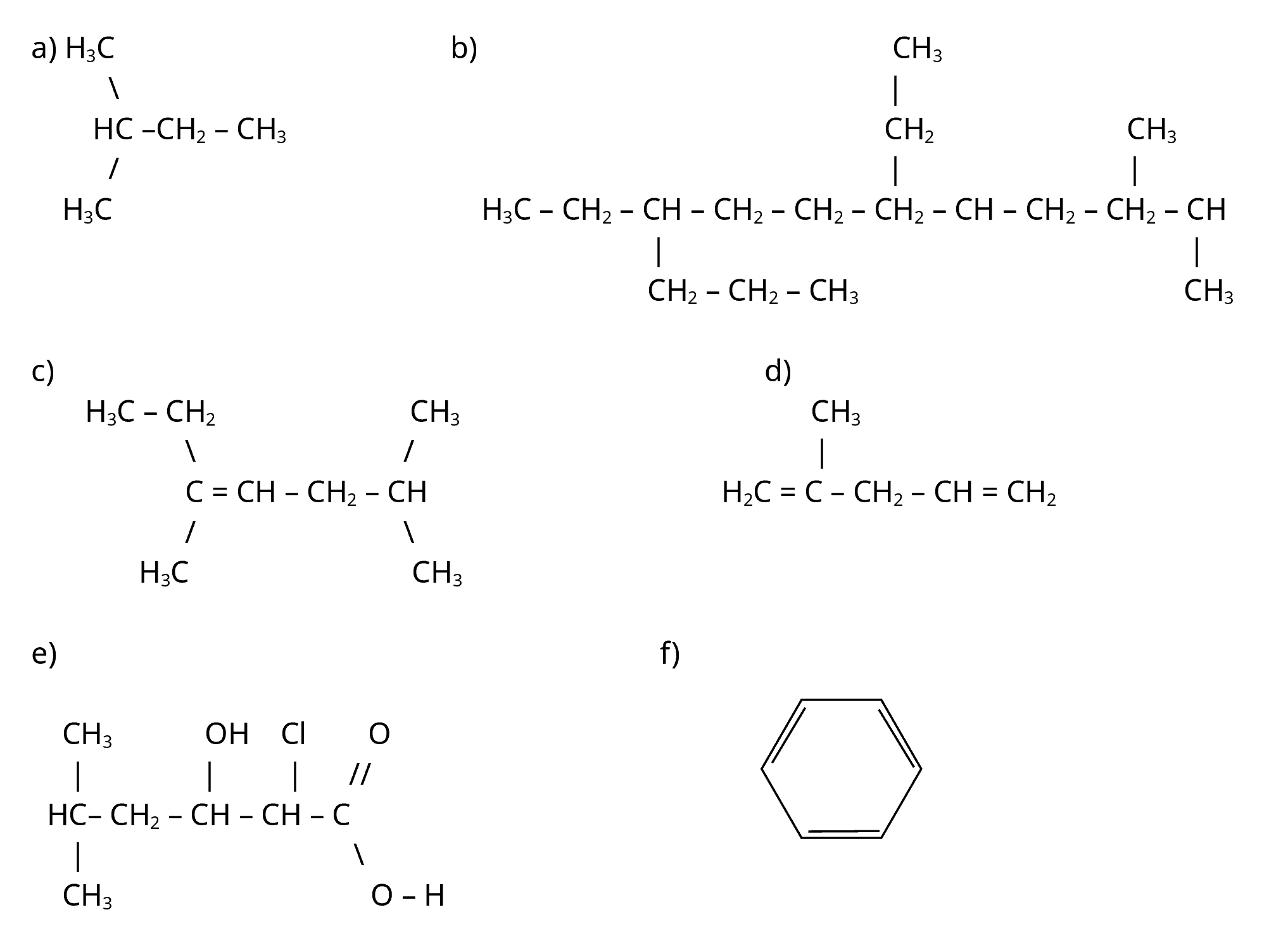
-
Zeichne die folgenden Strukturformeln und benenne die Substanzen:
a) CH3-CHCl2 b) C2H5OH c) CH3-CH3O d) C2H3Br e) C3H7Cl f) C6H6 g) C3H8 h) C3H5Cl
i) C3H3COOH j) C3H3O k) Butanal l) (CH3)3CCH3 m) CH2=C(CH3)CH2F n) H3C-CH2-Br
o) 1,5-Diiodpenta-1,4-dien p) 2-Fluor-3,4-dimethylhexen (3) q) 4,4-Dimethylheptan
r) 2,3,4 Trimethylpenten s) H3C-CH2-CH2-CH2-CH2 t) H3C-CH=CH-CH=CH-CH3 u) 2,2 Dimethylpropan -
Begründe, warum es in der organischen Chemie eine theoretisch unendliche Anzahl an Verbindungen gibt.
-
Begründe, warum Kohlenstoff vierbindig ist und warum Wasserstoff nur eine Bindung haben darf. Wie viele Bindungen hat Stickstoff? Wie sehen die typisch gebunden Sauerstoffe aus?
-
Nenne zehn Stoffe, in denen Kohlenstoff enthalten ist. Wie kann man Kohlenstoff in ihnen chemisch nachweisen? Beschreibe ein Experiment. (Wie kann man Halogene in Kohlenwasserstoffen nachweisen?)
-
Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.B. Benzin oder Alkohol) aus?
-
Stoffklasse
funktionelle Gruppe
Endung
Beispiel
Alkan
C-C
Alken
C=C
Alkin
Alkohol
Carbonsäure
Halogenalkane
Vervollständige die Tabelle:
-
Erstelle den genauen Mechanismus der Bildung von 1-Chlor-Hexan aus Hexan. Achte darauf, keine Fehler zu machen! Lerne an diesem Beispiel ordentlich und gewissenhaft zu zeichnen! Jede vergessene Bindung bedeutet ein Hanuta für den Nachbarn!
-
Gib eine Methode an, nach der aus 1-Butanol Buten entsteht.
-
Wie kann man Brombutan herstellen? Nenne verschiedene Wege.
-
Formuliere die Iodierung von Ethan. Nenne mindestens drei mögliche Abbruchreaktionen.
-
Formuliere einen chemischen Syntheseweg zur Herstellung von Ethanol. Wie wird Alkohol eigentlich üblicherweise hergestellt?
-
Nenne Verwendungszwecke von Carbonsäuren und Aldehyden.
-
Wozu wird Glycerin, Aceton, Ethanal, Ameisensäure und Octan verwendet?
-
Nenne eine Methode zur Darstellung von Ethan-1,2-diol (=Glycol).
-
Beschreibe den Reaktionsmechanismus und die Reaktionsbedingungen der folgenden Reaktion:
CH3 CH3
| |
H2C– CH2 – CH3 + ........ --> ...... --> H2C = C – CH3 + .....
|
Cl -
Vervollständige die Reaktionsgleichung (und gib Pfeile über die sich bewegenden Atome an und benennen Edukte und Produkte: (CH3)3C-OH + H2SO4 ---> ...
-
Nenne drei Dir bekannte zwischenmolekulare Kräfte. Beschreibe sie und ordne sie hinsichtlich ihrer zunehmenden Wirkungsstärke.
-
Erkläre das Zustandekommen von Dipol-Dipol-Kräften und von Van-Der-Waals-Kräften. Welchen Einfluss haben Sie und wie entstehen sie? Worin unterscheiden sie sich?
-
Vergleiche die zwischenmolekularen Kräfte von Methanol und Oktanol.
-
Ordne Wasser, Methanol und Diethylether nach Molekülmassen und vergleiche deren Siedepunkte. Kann man diesen Widerspruch erklären?
-
Beurteile die Löslichkeit folgender Substanzen in Wasser: Methansäure, 1-Octanol, Ethansäure-methylester, 2-Propansäure.
-
Was versteht man unter Viskosität? Erkläre und nenne Beispiele.
-
Inwiefern hat der räumliche Bau eines Moleküls Einfluss auf dessen polaren Charakter? Begründe am Beispiel von CCl4, CO2 und HF.
-
Welche Art von Bindung liegt im Chloroform-Molekül (HCCl3) vor?
-
Erkläre, warum sich Alkane nicht in Wasser, sehr wohl aber in Öl und Fett lösen. Benutze dazu die folgenden Begriffe: Hydrophob, hydrophil, lipophob, lipophil, Dipol-Dipol-Wechselwirkungen, räumlicher Bau und Abstoßung.
-
Erkläre das Zustandekommen von zwei Phasen beim Mischen von Alkanen mit Schwefelsäure.
-
Was erwartest Du, wenn man Kochsalz in Benzin gibt und kräftig rührt? Begründe.
-
„Die unterschiedliche Entzündbarkeit der flüssigen Alkane entspricht der homologen Reihe und ist von den Massen und den Van-der-Waals-Kräften abhängig“. Stimmt diese Aussage? Begründe!
-
Nenne und vergleiche die Eigenschaften von Alkanen, Alkinen und Alkenen erst allgemein und dann am Beispiel von Ethan, Ethen und Ethin.
-
Nenne gemeinsame Eigenschaften von Halogenalkanen. Beschreibe die Stoffklasse und nenne prominente Verbindungen.
-
Nenne die Summenformeln von Paraffin, Aceton, Ether (Diethylether), Glycerin.
-
Lerne die Formeln der Säuren „Chlorwasserstoff“, „Bromwasserstoff“, „Iodwasserstoff“ und „Schwefelwasserstoff“.
-
0,0396g einer unbekannten organischen Substanz verbrennen zu 0,0390g Wasser und 0,0469g Kohlenstoffdioxid. Wie lautet die Verhältnisformel der Verbindung?
-
Erkläre mit eigenen Worten, wie sich hydrophile von lipophilen Flüssigkeiten unterscheiden.
-
Wie erklärst Du Dir das „Nichtmischen“ und die Phasenbildung, wenn man versucht hydrophile von lipophilen Flüssigkeiten miteinander zu vermischen?
-
Erkläre genau, welche molekularen Grundlagen dazu führen, dass eine Verbindung, welche polare Bindungen hat (wie z.B. CCl4) dennoch apolar ist.
-
Hähnchen verschmierte Finger lassen sich kaum nur mit Wasser reinigen. Warum und wie kannst Du die fettigen „Hähnchen-Finger“ am besten reinigen?
-
Welche Faktoren bestimmen Smp. und Sdp.? Begründe mithilfe des Teilchenmodells und der Brownsch'schen Molekularbewegung. In welcher Form spielt die zugeführte Energie dabei eine Rolle?
-
Ein festes Alkan mit der Summenformel C18H38 ist Bestandteil von Wachs. Erklären Sie auf molekularer Ebene die Vorgänge beim Erhitzen der Substanz bis sie gasförmig wird und am Docht verbrennt.
-
Ordne die Verbindungen Tetrafluormethan, Ammoniak (NH3), Dimethylether (H3C-O-CH3) und Methan nach deren Siedepunkten und begründe Deine Einordnung. Schlage nun bei Wikipedia die tatsächlichen Siedepunkte nach.
- Details
- Zugriffe: 4294
Wiederholungsfragen 4. Lernjahr Chemie - Redoxreaktionen & Säure-Base-Chemie
1. Säure-Base-Reaktionen
-
Definiere die Begriffe „Säure“ und „Lauge“ und wiederhole alle Säuren und ihr Säurereste.
-
Was ist ein Indikator? Erkläre, welche positiven Eigenschaften ein Stoff haben muss, um ein Indikator zu sein und nenne Dir bekannte Indikatoren.
-
Beschreibe die Darstellung von Chlorwasserstoff im Labor darstellen? Wie Salzsäure?
-
Beschreibe die Darstellung von Schwefelsäure.
-
Definiere Protolyse und Autoprotolyse.
-
Definiere den Begriff Ampholyt und nenne fünf Beispiele.
-
Erkläre den Zusammenhang zwischen Säure, der Säurewirkung und Oxoniumionen (bzw. Protonen)?
-
Definiere Säure, Lauge/ Base nach Arrhenius und Brönstedt. Warum hat Brönstedt das System der Lauge erweitert? (Tipp: nenne zuerst 5 Laugen und 15 Basen!)
-
Warum spricht man bei Säure - Base Reaktionen auch vom „Donator-Akzeptor-Prinzip“
-
Begründe mit einer Reaktionsgleichung, warum auch NH3 alkalisch wirken kann und OH– freisetzt, obwohl es doch kein Hydroxid in der Formel enthält!
-
Nenne Stoffe, die durch Säure bzw. durch Laugen angegriffen werden.
-
Was versteht man unter dem „korrespondierenden Säure-Base Paar“? Nenne Beispiele.
-
Was versteht man unter dem pH-Wert? Definiere und erkläre den genauen Zusammenhang zwischen pH-Wert und der Konzentration.
-
Nenne 5 Dinge aus dem täglichen Leben, die eine Säure sind
-
Nenne die Formel zur Neutralisation.
-
Nenne die Formel zur Konzentrationsberechnung.
-
Bestimme die Konzentration einer Lösung, die 95ml Wasser und 1mol Salz enthält
-
Wie viel Wasser muss zu 0,121 mol Kochsalz zugegeben werden, damit eine Lösung mit c = 0,05 mol/l entsteht?
-
Berechne: Es sollen 10ml Salzsäure (c= 0,001 mol/l) mit Kalkwasser neutralisiert. Bestimme die notwendige Stoffmenge an Calciumhydroxid.
-
Berechne: Es sollen 10 ml Phosphorsäure (c= 0,001mol/l) neutralisiert werden. Berechne für Kaliumhydroxid und für Kalkwasser.
-
Definiere Lauge und Base und nenne dann Unterschiede und Gemeinsamkeiten der beiden Konzepte.
2. Redoxreaktionen und Metalle
-
Erläutere, wofür man Oxidationszahlen verwendet und wie man sie bestimmt. Schreibe dazu die wichtigsten Regeln nochmal auf.
-
Bestimme die Oxidationszahlen:
NaOH , H2O , K2MnO4 , Cl2O4 , HClO3, HBrO3, SnH4, CaB2O4, K2SnO3, (Cr2O7)2-, (AsO4)3-,
NH3, NH4+, Cl2, O2–, SO42–, CaO, AlBr3, S2O32–, H2CO3, NaNO3, K2Cr2O7, IO3–, LiH, KMnO4,
Al2O3, Mg, H2O, H2SO3, H2S, H3PO3, H2O2, S8, H2SO4, H3PO4, CaHPO4. -
Was ist eine Redoxreaktion? Erläutere anhand eines Beispiels und definiere dazu Redoxreaktion, Oxidation und Reduktion.
-
Erläutere das Don(at)or-Akzeptor-Prinzip. Wende es auf je ein Beispiel einer Redoxreaktion und einer Säure-Base-Reaktion an.
-
Nenne die nötigen Schritte, um eine Redoxreaktion zu lösen in der richtigen Reihenfolge
-
Erkläre die Begriffe: Ion, Atom, Element, Molekül, Anion, Kation? Nenne Beispiele!
-
Erkläre allgemein die Ionenbindung?
-
Erkläre die „Zusammensetzung der Salze“ mithilfe einer Definition und nenne dann Regeln, wie man Salzformeln bestimmt.
-
Begründe mithilfe von Oxidationszahlen, welche der folgenden Reaktionen Redoxreaktionen sind:
a) Zn (s) + 4HNO3 (aq) ---> Zn(NO3)2 (aq) + 2NO2 (g) + 2H2O (l)
b) Mg (s) + H2SO3 (aq) ---> MgSO3 (aq) + H2 (g)
c) H2SO4 (aq) + 2KCl (aq) ---> K2SO4 (aq) + 2HCl (aq)
d) Cu + 2H2SO4 ---> CuSO4 + 2H2O + SO2
e) 2NaOH + Cl2 ---> NaClO + NaCl + H2O
-
Wiederhole Dir bekannte Redoxreaktionen und erstelle die passenden Reaktionsgleichungen.
-
Erstelle die Gleichung der Zellatmung. Ist dies eine Redoxreaktion? Beweise es!
-
Löse folgende Reaktionsgleichungen:
FeSO4 + HIO3 + H2SO4 ---> I2 + Fe2(SO4)3
Zn + NO3– + H2O ---> Zn2+ + NH3 + OH- -
Wie kann man Metalle hinsichtlich ihres Oxidationsvermögens/ Reduktionsvermögens untersuchen (also ihres unedlen/ edlen Charakters)?
-
Nenne gute Reduktions- und gute Oxidationsmittel.
-
Löse die folgenden Redoxreaktionen:
MnO4- + NO2– ---> Mn2+ + NO3–
ClO- + CrO22– + OH- ---> Cl- + CrO42–
MnO2 +Cl– + H+ ---> Cl2 + Mn2+
MnO4- + C2O42– + H3O+ ---> Mn2+ + CO2
HBrO3 + Bi ---> HBrO2 + Bi2O3
Zn + NO3– ---> Zn2+ + NH3 + OH–
Ag + H2SO4 ---> Ag2SO4 + SO2
Al + H2SO4 ---> Al2(SO4)3 + SO2
Bi + HNO3 ---> Bi(NO3)3 + + NO
Cr2O72–+ H2S ---> Cr3+ + S + OH–
Cr3+ + H2O2 + OH– --->
Cu + HNO3 ---> 3 Cu(NO3)2 + NO
Fe3+ + S2– + H+--->
FeSO4 + HIO3 + H2SO4 ---> I2 + Fe2(SO4)3
P + HNO3 + ---> H3PO4 +NO
PbO2 + HCl ---> PbCl2 + Cl2
SbH3 + OH- ---> Sb(OH)4– + H2
Sn + HNO3 ---> SnO2 + NO2
SO2 + I2 + OH- ---> SO3 + 2I–
SO32– + Sn2+ +H3O+ ---> SnS2 + Sn4+
-
Erkläre die Begriffe Disproportionierung und Synproportionierung. Nenne Beispiele.
-
Erläutere die Metallbindung mithilfe einer Skizze
-
Nennen Grundtypen chemischer Reaktionen?
-
Nenne und beschreibe zwei Wege aus Eisenoxid das Element Eisen herzustellen.
-
Warum kann man weder Aluminium, Zink oder Eisen einfach elementar abbauen? Das würde doch viel Geld sparen!
-
Erläutere den Vorgang der Schmelzflusselektrolyse? Zeichne dazu schematisch den Aufbau einer Schmelzflusselektrolysezelle.
-
Nenne wichtige Eigenschaften von Kupfer und wofür es verwendet wird
-
Nenne wichtige Eigenschaften von Aluminium und wofür es verwendet wird
-
Nenne Produkte, bei denen besonders Aluminium eine Rolle spielt.
-
Definiere: Atom, Element, Molekül und Ion.
-
Erstelle eine Übersicht (mit Ionenladungen) der Säurereste
-
Nenne den Säurerest von Schwefelwasserstoff, Phosphoriger Säure. Nenne die Formel von Kalkwasser!
-
Ergänze:
-
Aluminiumfluorid
Calciumphosphat
Magnesiumphosphit
AgNO3
-
Definiere die Begriffe Säure und Lauge. Was sind Ampholyten?
-
Nenne die Formel von Oxoniumionen und von Hydroxidionen?
-
Wiederhole die Dissoziationsgleichungen der Säuren und Laugen
-
Nach welchen Kriterien kann man endotherme und exotherme Reaktionen unterscheiden?
-
Erkläre die Vorgänge beim Rosten von Eisen?
-
Beschreibe das Thermitverfahren mit Beobachtung, Schlussfolgerung und Reaktionsgleichung. Wofür wird es verwendet?
-
Nenne gemeinsame Eigenschaften von Metallen.
-
Was bedeutet „die Reaktion läuft im alkalischen Milieu ab“?
-
Was bedeuten die Vorsilben „penta“ und „hexa“ und wofür benutzt man sie?
-
Nenne die Formel von: Fluorid, Phosphat, Ammonium, Permanganat, Sulfat, Sulfid, Nitrat
-
Nenne alle Oxidationsstufen des Mangans und die dazugehörigen Farben.
3. Elektrochemie
-
Erkläre den Begriff „Lösungstension“ (=Lösungsdruck).
-
Wie kommt es durch die Lösungstension zu verschiedenen Spannungspotentialen bei Cu und Zn-Stäben?
-
Wie kann man ein Vergiften vermeiden?
-
Erkläre genau die Vorgänge an beiden Stäben mit Reaktionsgleichungen und einer Gesamtreaktionsgleichung.
-
Was sind Galvanische Elemente und was ist ein Daniell-Element? Erkläre mit einer beschrifteten Zeichnung. Wo finden Ox und Red statt? Erkläre genau!
-
Stelle die Reaktionsgleichung der elektrochemischen Reaktion des Daniell-Elementes auf.
-
Definiere: Anode, Kathode, Halbzelle, Normalpotential, elektrochemische Spannungsreihe.
-
Wie würde man eine Elektrolyse durchführen, bei der es zur Bildung eines unedlen Metalls, wie z.B. Natrium kommt?
-
Welche Unterschiede bestehen zwischen galvanischen Elementen und der Elektrolyse?
-
Wirkt Wasserstoffperoxid (H2O2) eher als Reduktions- oder als Oxidationsmittel? Wie kann man dies theoretisch und praktisch beweisen?
-
Wenn gelöster Schwefelwasserstoff an der Luft steht, wird die Lösung nach einiger Zeit gelb. Welche Reaktion läuft ab. Stelle dazu auch das Redoxpotential auf.
-
Im Labor sollen Hg2+-Ionen zu Hg+-Ionen reduziert werden, ohne dass dabei das leicht in die Gasphase übergehnde (und beim Einatmen giftige) metallisches Quecksilber (Hg) entsteht. Welches Redoxpotential muss das Reduktionsmittel haben? Begründe!
-
Wenn eine Lösung von Schwefelwasserstoff längere Zeit an der Luft steht, scheidet sich Schwefel ab, welcher darauf sichtbar schwimmt. Erkläre und formuliere die Reaktionsgleichung.
-
Die Metalle Silber, Zink, Kupfer und Blei werden jeweils in Silbernitrat-, Bleinitrat-, Zinksulfat-
und Kupfersulfat-Lösung gegeben. In welchen Fällen findet eine Reaktion statt? -
Nennen Sie drei Metalle, die trotz stark negativem Normalpotential gegenüber Wasser beständig sind.
-
Für einen Versuch benötigt man sehr reines Kupfer(II)-Chlorid. Ein unbedachter Praktikant entnahm das Salz mit einem Stahllöffel aus der Aufbewahrungsflasche. Warum war der Laborleiter, der alles beobachtet hatte, skeptisch in Bezug auf die Ergebnisse?
-
Bei der Kupfergewinnung kann man sich den besonderen Stoffwechsel von Bakterien zunutze machen. Erze mit geringem Kupferanteil werden dazu mit den Bakterien in Kontakt gebracht. Die Bakterien wandeln nun ebenfalls vorhandenes Fe2+ zu Fe3+ um. Das Produkt wandelt nun die Sulfidionen des Kupfersulfids in Sulfat um (Bildung von CuSO4). Kupfersulfat ist wasserlöslich, sodass das Kupfersalz nun einfach aus dem Gestein gelöst und anschließend elektrolytisch Kupfer gewonnen werden kann. Stelle die passende Redoxreaktion auf.
-
Erkläre den Aufbau eines Daniell-Elementes (mithilfe einer Zeichnung und den passenden Reaktionsgleichungen).
-
Welche unerwünschten Vorgänge finden in galvanischen Elementen statt, wenn sie nicht durch ein Diaphragma oder eine Salzbrücke in Halbzellen aufgetrennt sind? Gebe die Reaktionsgleichungen dazu an.
-
Zeichne ein galvanisches Element mit einer Silber- und einer Kupferelektrode. Bestimme die elektrischen Pole, Anode und Kathode sowie die Stromflussrichtung. Welche Spannung wird gemessen werden?
-
Berechne die Leerlaufspannung des Zn/Zn2+ // H+/H2
-
Wie lauten die genauen Standardbedingungen?
-
Berechnen die Spannungen der folgenden galvanischen Elemente bei Standardbedingungen:
a) Pb/Pb2+ // Pt/Pt2+
b) Al/Al3+ // Br2/Br-/Pt
c) Pb/Pb2+ // Fe2+/Fe3+/Pt
d) Ag/Ag+ // Au/Au3+ -
Definiere Oxidationsmittel und Reduktionsmittel. Welches Element ist das stärkste Oxidationsmittel?
-
Läuft die folgende Reaktion freiwillig ab? Berechne die EMK und stelle die Reaktionsgleichung auf.
a) Chlor und Iodid
b) Ein Zinkstab in einer Silberionenlösung
b) Silber und Säure
c) Eisen und Chlor
d) MnO4– -Ionen in saurer Lösung H2O2
e) Schwefelwasserstoff und Iod
f) Brom wird in eine NaCl-Lösung gegeben
g) Zinn wird in eine Eisen(II)-sulfatlösung gestellt
h) Kupfer reagiert mit einer Eisen(III)-sulfatlösung -
Warum kann man angelaufenes Silberbesteck in heißer Kochsalzlösung mit Aluminiumfolie „reinigen“?
-
a) Fertige eine beschriftete Skizze eines Bleiakkumulators an.
b) Formuliere die Gleichungen für die beim Entladen an Anode bzw. Kathode
ablaufenden Reaktionen.
c) Früher musste bei den Blei-Akkumulatoren von Zeit zu Zeit destilliertes Wasser nachgefüllt werden. -
Als Schutz vor Korrosion soll ein Eisenblech (Das Standardpotenzial von Eisen beträgt Eo= -0,44V ) mit einer metallischen Schutzschicht umgeben werden. Zur Verfügung stehen folgende Metalle:
Aluminium Eo= -1,67 V
Zink Eo= -0,76 V
Nickel Eo= -0,25 V
Blei Eo= -0,13 V
Welche Metalle eignen sich überhaupt nur, und bei welchen besteht auch nach einer möglichen Verletzung der Schutzschicht weiterhin Korrosionsschutz? Begründe ausführlich. -
Beschreibe die Herstellung von Aluminium aus Bauxit. Gehe dabei auf folgende Fragen ein:
a) Welche Rolle spielt Kryolith bei dem Prozess?
b) Warum muss alles wasserfrei ablaufen?
c) warum nennt man den Vorgang auch Schmelzflusselektrolyse?
d) warum ist die Aluminiumherstellung so teuer? -
Bei einem versehentlichen Biss mit einem Goldzahn auf ein Kaugummipapier (aus Aluminiumfolie) kommt es zu einem kurzen Schmerz im Zahn. Erkläre den Vorgang.
-
Kann man aus der Spannungsreihe Informationen über die Möglichkeit einer Elektrolyse gewinnen? Erkläre!
-
Erkläre die Begriffe Zersetzungsspannung und Überspannung.
-
Welche der folgenden Reaktion läuft ab? Begründe mithilfe der Spannungsreihe.
a) Zugabe von Kupfer zu einer Silbernitratlösung?
b) Zugabe von Silber zu einer Kupfersulfatlösung?
c) Ein Sulfid (aus Eiern) kommt in Kontakt mit Silber
d) Silberionen kommen in Kontakt mit Schwefel
- Details
- Zugriffe: 4403
Hier findet ihr Wiederholungsfragen für die Fächer Biologie und Chemie:
- Details
- Zugriffe: 6202
Testvorbereitung zum ersten Test in Klasse 7/8 (1. Lernjahr)
Testfragen: Kapitel 1 & 2 - Grundlagen
-
Wie unterscheidet sich Chemie von anderen Naturwissenschaften?
-
Nenne mindestens 10 Punkte der Laborordnung, die Deinem Schutz dienen.
-
Was brennt nun eigentlich, wenn du eine Kerze angezündet hast? Beschreibe auch, welche Aufgabe der Docht hat.
-
Die folgenden Sätze beschreiben, was beim Anzünden einer Kerze geschieht. Leider sind sie durcheinander geraten. Wie muss die richtige Reihenfolge lauten?
a) Am Docht befindet sich festes Wachs. Es brennt nicht.
b) Der Wachsdampf entzündet sich und beginnt zu brennen.
c) Das flüssige Wachs steigt im Docht nach oben (ähnlich wie Tinte im Löschpapier).
d) Der Wachsdampf erreicht seine Entzündungstemperatur.
e) Wenn man eine Streichholzflamme an den Docht hält, wird das Wachs erhitzt und schmilzt.
f) Das Wachs beginnt zu sieden und verdampft. -
Nenne stichwortartig Eigenschaften der folgenden Elemente: Eisen, Schwefel, Kupfer, Zink, Kohlenstoff, Magnesium, Wasserstoff, Stickstoff, Sauerstoff
-
In welche zwei Gruppen könnte man die Elemente aus Aufgabe 5 ordnen?
-
Beschreibe, wie man Metalle im Labor verzinken kann und beschreibe dann, wie man Messing herstellt.
-
Was muss man beachten, um sich vor Natronlauge zu schützen?
-
Nenne Kennzeichen von chemischen Reaktionen.
-
Vergleiche die Flammen von Brenner und Kerze. Nenne Unterschiede und die Gründe dafür.
-
Wiederhole die Regeln zum Bestimmen der Dichte.
-
Wie ist die Einheit der Dichte? (Vergiss nicht, sie immer bei allen Rechnungen mit anzugeben!)
-
Wie viel cm3 entsprechen einem 1ml Wasser?
-
Wie schwer ist ein Kupferwürfel mit dem Volumen von 1,55ml? Wie schwer ist ein vergleichbarer Bleiwürfel?
-
Um welchen Faktor ist das Schwermetall Blei schwerer als das Leichtmetall Aluminium?
-
Wie kann man die mittlere Dichte Deines Körpers bestimmen? Schlage ein Experiment vor (Tipp: Badewanne)
-
Aus welchen Materialien würdest Du umweltfreundlichere Autos bauen? Warum?
-
Entscheide anhand der Dir bekannten Merkmale von chemischen Reaktionen, ob in den Beispielen eine solche chemische Reaktion vorliegt:
a) Wäsche bei 40°C waschen
b) eine CD/DVD zerbrechen
c) eine CD/DVD schmelzen
d) Holz im Kamin entzünden
e) Schmelzen von Metall in der Bunsenbrennerflamme -
Erkläre die Begriffe Vereinigung und Zersetzung und nenne für beide Reaktionen je zwei Beispiele. Erstelle dann Reaktionsgleichungen in Wortform dazu!
-
Was ist der Unterschied zwischen einer Vereinigung (von z.B. Eisen und Schwefel) und dem Mischen (von z.B. Eisen und Schwefel)?
-
Was ist der Unterschied zwischen einer Zersetzung und dem Trennen?
-
Nenne Aussagen von Berzelius und wiederhole Dir bekannte Elementsymbole.
-
Vervollständige die Tabelle:
Gold
Sauerstoff
Kohlenstoff
Wasserstoff
Quecksilber
Blei
Silber
Magnesium
Phosphor
Stickstoff
Schwefel
Kupfer
Eisen
Aluminium
Zink
-
Erkläre mit Deinen Worten den Vorgang der Vereinigung.
-
Warum ist ein Gemisch nicht vereinigt?
-
Eine Testfrage lautete: Wie kann man feststellen, ob sich Silber und Schwefel in einer Reaktion tatsächlich vereinigt habe?
Ein Schüler schreibt dazu: „Wenn sich Silber und Schwefel zu Silbersulfid vereinigen, kann man es leicht zeigen, indem man beide Stoffe in Wasser gibt. Silber schwimmt nicht und Schwefel schwimmt. Durch diese Trennung ist beweisen, dass beide Stoffe in Silbersulfid enthalten sind.“
Wie viel Punkte würdest Du dem Schüler geben? Begründe Deine Meinung. -
Wasser ist kein Element, sondern eine…! Vervollständige den Satz und schlage ein Experiment zur Überprüfung vor.
-
In der Antike nannte man auch Erde und Feuer Elemente. Beides sind keine Elemente. Warum nicht?
-
Wie kann man das Element Sauerstoff nachweisen?
-
Wie kann man das Element Wasserstoff nachweisen?
-
Welche Eigenschaft in Bezug auf Flammen hat das Element Stickstoff?
-
Eine Frage, die einfach ist, wenn Du genau nachdenkst: Ist in Wasser grundsätzlich Wasserstoff und Sauerstoff enthalten?
Kapitel 3: Verbrennungen und Oxidationen
-
Was ist eine Oxidation? Was ist eine Verbrennung?
-
Welche Formen der Oxidation gibt es?
-
Es müssen drei Voraussetzungen erfüllt sein, damit etwas brennt. Schreibe sie auf.
-
Beim Gas genügt ein kleiner Funke, um es zu entzünden. Dazu reicht ein leeres Feuerzeug, welches selbst kein Gas mehr enthält. Könntest du auch eine Kerze mit einem leeren Feuerzeug entzünden? Begründe.
-
Manche Stoffe dürfen nur in einem heißen Wasserbad erhitzt werden. Welche Stoffe könnten das deiner Meinung nach sein? Begründe Deine Meinung
-
Stelle die Reaktionsgleichung der Verbrennung von a) Schwefel, b) Kohlenstoff, c) einem beliebigen Metall auf
-
Was ist eine Oxidation? Nenne die drei Formen der Oxidation? Kann man stille Oxidationen beobachten?
-
Was denkst Du, warum Explosionen im Chemieunterricht als sehr gefährlich betrachtet werden und warum alle explosiven Stoffe Sicherheitsschilder tragen müssen?
-
Der Verkauf von Silvesterknallern aus osteuropäischen Ländern ist zum Teil in Deutschland verboten, was meinst Du, warum das so ist?
-
Um welchen Faktor verbrennen Stoffe in reinem Sauerstoff schneller als in Luft? Nenne Beispiele aus dem Unterricht.
-
Erkläre den Begriff Nichtmetalloxid und ordne den 3 Aggregatzuständen Dir bekannte Nichtmetalloxide zu.
-
Informiere Dich über den Stoff Kohlenmonoxid und seine Gefahren.
-
Was ist der Unterschied zwischen Sauerstoff und Luft? Wie kann man entstehenden Sauerstoff nachweisen?
-
Ist Luft ein Element? Schlage einen Versuchsaufbau vor, mit dem dies gezeigt werden kann.
-
Verbrennt ein Stückchen Kohle schneller in Luft, Stickstoff oder reinem Sauerstoff?
-
Bei einem Waldbrand fliegen mit Wasser beladene Hubschrauber über das Feuer und werfen das Wasser ab. Was verspricht sich die Feuerwehr davon? Warum kann ein Wald, der auf solche Art gelöscht wurde, jederzeit wieder anfangen zu brennen? Welche Rolle spielt eigentlich Wind beim erneuten Entfachen eines Waldbrandes?
-
Was versteht man unter der Entzündungstemperatur? Nenne ein Beispiel, wo die Entzündungstemperatur eine wichtige Rolle spielt.
-
Welchem Einfluss hat die Form eines Holzstücks auf seine Entzündung am Lagerfeuer? (Vergleiche dazu einen Ast und einen Baumstamm).
-
Ein Schüler sagt: „eine Verbrennung ist eine Oxidation, aber nicht jede Oxidation ist eine Verbrennung“. Hat der Schüler damit recht?
-
Ordne die folgenden Stoffe nach ihrer Entzündungstemperatur: Streichholz, Benzindampf, Holzkohle, Stroh
-
Was ist ein Metalloxid? Erkläre und nenne drei Beispiele (Was ist ein Nichtmetalloxid?).
-
Wozu verwendet man Metalloxide?
-
Ist die Verbrennung von Kupfer eine Oxidation? Begründe Deine Meinung.
-
Erkläre den Unterschied zwischen Element und Verbindung
-
Erkläre die Vereinigung von Eisen und Schwefel und die Zersetzung von Quecksilberoxid.
-
Auf dem Herd hat eine Bratpfanne angefangen zu brennen. Was ist passiert? Wie kann sie gelöscht werden?
-
In einem Grill brennt Grillkohle. Liegt eine chemische Reaktion vor? Begründe Deine Meinung und stelle die Reaktionsgleichung auf.
-
In einem mit Wasser gefüllten Becherglas steht ein Reagenzglas mit der Öffnung
nach unten. Es enthält feuchte Eisenwolle. Lässt man den Versuch zwei Tage
stehen, steigt das Wasser im Reagenzglas an.
Erkläre, warum und um wie viel Prozent das Wasser steigt. -
Wozu dient Kalkwasser? Wie stellt man es her?
-
Schlage einen Versuchsaufbau vor, der beweist, dass man Kohlenstoffdioxid ausatmet.
- Details
- Zugriffe: 5322
Klausur- und Testvorbereitung zum ersten Test in Klasse 8/9 (2. Lernjahr)
Wenn Du Themen wie z.B. Radioaktivität, Isotope, Massenverhältnisse, die Säureformeln oder das Rechnen mit Massen noch nicht im Unterricht hattest, solltest Du diese Fragen überspringen!
Tipp: wenn Du noch kein Periodensystem hast, besorge Dir eines, (z.B. hier: https://hoffmeister.it/chemie/00-pse/PSE.pdf). In Tests und Arbeiten ist dies eine große Hilfe!
Kapitel 1-5: Fragen zum Wiederholen der bisherigen Kapitel
-
Stelle jeweils die Reaktionsgleichung der Verbrennung von Schwefel, Kohlenstoff und eines beliebigen Metalls auf.
-
Was ist eine Oxidation? Nenne auch die drei Formen der Oxidation.
-
Was ist der Unterschied zwischen Sauerstoff und Luft? Wie ist die Luft zusammengesetzt?
-
Verbrennt ein Stückchen Kohle schneller in Luft, Stickstoff oder reinem Sauerstoff?
-
Ein Schüler sagt: „Eine Verbrennung ist eine Oxidation, aber nicht jede Oxidation ist eine Verbrennung“. Hat der Schüler damit recht?
-
Was versteht man unter dem Begriff „Entzündungstemperatur“? Ordne dann die folgenden Stoffe nach ihrer Entzündungstemperatur: Streichholz, Benzindampf, Holzkohle, Stroh.
-
Welche drei Voraussetzungen müssen erfüllt sein, damit etwas brennt.
-
Wie kann man entstehenden Sauerstoff nachweisen?
-
Ist Luft ein Element? Begründe mit einem Vorschlag für einen Versuchsaufbau.
-
Ist Wasser ein Element? Begründe mit einem Vorschlag für einen Versuchsaufbau.
-
Was ist ein Metalloxid? Was ist ein Nichtmetalloxid?
-
Nenne zwei Metalloxide, nenne zwei Nichtmetalloxide.
-
Wie kann man Metallsulfide bilden? Nenne ein Beispiel.
-
Nenne die Formel für Sauerstoff, Wasserstoff und Stickstoff.
-
Nenne die Formel für Wasser und Kohlenstoffdioxid.
-
Erkläre: Element - Verbindung - Gemisch - Reinstoff.
-
Beschreibe einen Versuch zur Wasserzersetzung.
-
Beschreibe die Vereinigung von Kupfer und Schwefel.
-
Beschreibe die Reaktion von Magnesium mit Salzsäure.
-
Beschreibe, was man erhält, wenn man Säure und Lauge gleicher Konzentration mischt.
-
Nenne acht Säuren und drei Laugen mit Formel.
TIPP: Lerne nochmals alle Säuren, Laugen und die Säurereste auswendig!!!
Kapitel 6: Atombau und Elementarteilchen
-
Rutherford hat einen Versuch durchgeführt, der als Streuversuch bekannt wurde. Eines seiner Ergebnisse dabei war, dass Atome im Grunde leer sind. Erkläre den Versuchsaufbau mit einer Zeichnung.
-
Stelle Rutherfords Ergebnisse verständlich dar, indem Du seine drei wichtigsten Beobachtungen und Schlussfolgerungen nennst.
-
Nenne die Elementarteilchen und ordne ihnen ihre Masse und Ladung zu.
-
Erkläre ein Modell zum Aufenthaltsbereich der Elektronen.
-
Warum hat Rutherford als Strahlenquelle α-Strahlen (=Heliumkerne) verwendet? Zeichne einen solchen Heliumatomkern und vergleiche mit einem Goldatom. Begründe Deine Meinung.
-
Zeichne selbst den Aufbau der folgenden Atome: H, He, Li, Na, Mg, Ca, Ba, Al, I.
-
Welcher Zusammenhang besteht zwischen der Anzahl an Elektronenwolken und der Periodennummer?
-
Erkläre, nach welchen Kriterien das PSE aufgebaut ist.
-
Besteht ein Zusammenhang zwischen der Anzahl an Valenzelektronen und dem PSE?
-
Wie erklärst Du Dir, dass das Verhältnis von Protonen zu Neutronen bei Zunahme der Ordnungszahl kleiner wird (z.B. Kohlenstoff hat 6p+ und 6n => 1:1=1; Blei hat 82p+ und 126n => 82:126=0,65)?
-
Der russische Physiker Mendelejew hatte das PSE noch nach der Massenzahl geordnet. Finde im PSE Beweise, dass die Elemente heute nach ihrer Ordnungszahl und nicht nach der Massenzahl geordnet sind.
-
Was vermutest Du, war der Grund, warum es so lange gedauert hat, die Elemente sinnvoll anzuordnen?
-
Berechne den Anteil an metallischen Elementen im PSE.
-
Erkläre die Begriffe Hauptgruppe und Elementperiode.
-
Was sind Isotope? Nenne Beispiele und vervollständige dann die Tabelle:
|
1 H 1 |
2 H 1 |
3 H 1 |
12 C 6 |
14 C 6 |
|
|
Protonenzahl |
1 |
||||
|
Neutronenzahl |
0 |
||||
|
Elektronenzahl |
|
Wasserstoff |
Deuterium |
Tritium |
-
Erkläre die Begriffe „Ordnungszahl“, „Protonenzahl“, „Massenzahl“.
-
Warum sind bestimmte Kombinationen von Protonen und Neutronen bei einem Element häufiger zu finden als andere? Was vermutest Du, ist der Grund, dass es nicht von jedem Element Isotope gibt?
-
Nenne verschiedene die verschiedenen Typen radioaktiver Strahlung und zeige, wie sie entstehen (nur falls im Unterricht besprochen).
-
Erkläre das Prinzip der Radio-Karbon Methode (14C-Methode) zur Altersbestimmung (nur falls im Unterricht besprochen).
Kapitel 7: a) Unglaublich leichte Wiederholungsfragen
-
Wie viele Atome sind in Schwefelsäure (Phosphorsäure) miteinander vereinigt?
-
Was sagt der Massenerhaltungssatz aus? Was sagt der Energieerhaltungssatz aus?
-
Erkläre das Gesetz der vielfachen Massenverhältnisse.
-
Nenne Stationen in Daltons Leben und fasse seine Kernaussagen zusammen.
-
Worin liegt die Erweiterung des Gesetzes der vielfachen Massenverhältnisse im Vergleich zu dem der konstanten Massenverhältnisse?
-
Nenne die Formel für Sauerstoff, Wasserstoff und Stickstoff
-
Nenne die Formel für Wasser und Kohlenstoffdioxid
-
Stelle die Reaktionsgleichung der Bildung von Fe2O3 auf (SO2, SO3, CO2)
-
Welcher Stoff entsteht, wenn man Phosphoroxid und Wasser mischt?
-
Welcher Stoff entsteht, wenn man Stickoxid (NO2) und Wasser mischt?
-
Welcher Stoff entsteht, wenn man Kohlenstoffdioxid und Wasser mischt?
-
Wenn reiner Kohlenstoff in reinem Sauerstoff verbrennt, ist kein Produkt zu sehen. Kann man es dennoch beweisen?
b) Wertigkeiten:
-
Wiederhole die Regeln zur Bestimmung der Wertigkeit.
-
Stelle die Wertigkeiten für die folgenden Elemente und Verbindungen auf
Cu, NH4Cl, HBr, KBrO3, H2O, NaCl, H3PO4, Mg, I2, C6H12O6, CO2, HClO4, Al2(SO4)3, H2SO4, BaCl2,
AgCl, AgNO3, AlCl3, CaCO3, CaCl2, Br2, Fe2O3, FeCl3, KHSO4, SO2, N2, NaNO3, NH3, KI, HCl -
Bestimme die Formeln der folgenden Salze: Natriumchlorid, Kaliumsulfiud, Magnesiumfluorid, Aluminiumchlorid, Aluminiumoxid, Lithiumphosphat, Calciumnitrat, Bariumsulfat, Calciumphosphat, Aluminiumcarbonat.
-
Bearbeite so viele Reaktionsgleichungen von den Übungszetteln wie möglich.
c) Bestimmen von Massen und Massenverhältnissen:
-
a) Bei einem Versuch reagieren 140g Eisen mit 80g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Errechne dann, wie viel Schwefel man für 105g Eisen benötigt?
b) Bei einer anderen Vereinigung werden zu einem Eisenblech 200g Schwefel gegeben. Die Vereinigung verläuft vollständig. Wie schwer war das Eisenblech? -
a) Ein Kupferblech wiegt 400g. Es wird mit Schwefel vereinigt. Nach der Reaktion wiegt es 600g. Wie groß ist die Masse des Schwefels, der reagiert hat? Bestimme damit das Massenverhältnis.
b) Wie viel Gramm Schwefel braucht man für die Reaktion von 233g Cu? -
a) Auch Gase haben ein Gewicht: 8gWasserstoff und 64g Sauerstoff vereinigen sich beim Entzünden mit einem lauten Knall. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis.
b) Wie viel Gramm Wasserstoff braucht man für 12g Sauerstoff?
c) Bestimmen von Verbindungsformeln (und Massen). -
Eisen reagiert mit Schwefel unter hohem Druck im Massenverhältnis 14/12. Bestimme das Atomverhältnis (also die Formel der Verbindung).
-
Eisen (Fe) reagiert mit Schwefel (S) unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis.
-
Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis N:O = 7/8. Bestimme die Formel des entstehenden Gases.
-
Im Labor lässt sich Stickstoff aber auch in anderen Massenverhältnissen oxidieren. So reagieren 126g Stickstoff mit 288g Sauerstoff zu einem gelben Gas. Bestimme das Massenverhältnis und bestimme die Formel des gelben Gases.
-
Schwefel verbrennt an der Luft mit blassblauer Flamme, wenn der Schwefel in reinem Sauerstoff verbrennt, leuchtet er blau und es entsteht ein weißer Feststoff.
Stelle die zwei Reaktionsgleichungen auf und bestimme die Massenverhältnisse. -
Bei einem Versuch reagieren 21g Eisen mit 12g Schwefel.
a) Bestimme das Massenverhältnis und stelle die Reaktionsgleichung auf.
b) Wie viel Schwefel braucht man für 25g Eisen?
c) Anstelle der ursprünglichen Versuchsbedingungen wird jetzt der Druck erhöht. Als Folge vereinigen sich die Atome in einem anderen Massenverhältnis. 21g Eisen reagieren nun mit 18g Schwefel. Erstelle die neue Reaktionsgleichung und bestimme, wie groß wäre nun die Masse an Schwefel wäre, wenn 25g Eisen reagieren lässt. -
Erstelle eine Übersicht der chemischen Gesetze, indem Du das Gesetz jeweils formulierst und mindestens ein Beispiel findest.
-
Zwei Atome verbinden sich im Massenverhältnis 1: 19. Wie heißt die Verbindung? (Für Profis: 2: 16).
-
Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis
N:O = 7/16. Bestimme die Formel des entstehenden Gases. -
2,4g Magnesium und 7,0 g Chlor reagieren miteinander. Bestimme die Formel der Verbindung.
-
Eine Müllverbrennungsanlage verbrennt am Tag 1000kg Kunststoffe. Diese enthalten 950kg Kohlenstoff. 95% davon verbrennen vollständig zu Kohlenstoffdioxid. 5% verbrennen unvollständig zu Kohlenstoffmonoxid. Stelle beide Reaktionsgleichungen auf und bestimme die Massen der entstehenden Gase.
-
Im Labor lässt sich Stickstoff aber auch in anderen Massenverhältnissen oxidieren. So reagieren 126g Stickstoff mit 288g Sauerstoff zu einem gelben Gas. Bestimme das Massenverhältnis und bestimme die Formel des gelben Gases.
-
Im Dieselkraftstoff ist Schwefel enthalten. Es bildet sich bei der Verbrennung im Motor das Gas Schwefeldioxid.
a) Stelle die Reaktionsgleichung (mit „C“ als Dieselkraftstoff) auf.
b) Bestimme, wie viel Gramm Schwefeldioxid pro kg Sauerstoff entstehen
c) In einem Liter Dieselkraftstoff sind (ca.) 10g Schwefel enthalten. Bestimme die Masse an Schwefeldioxid, die bei einer Fahrstrecke von 100 km (Verbrauch 5l/ 100km) entsteht
Bei einem Versuch reagieren 21g Eisen mit 12g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Schwefel braucht man für 25g Eisen?
- Details
- Zugriffe: 4332
Klausur- und Testvorbereitung zum ersten Test in Klasse 8/9 (2. Lernjahr) II
Tipps:
- Wenn Du noch kein Periodensystem hast, besorge Dir eines, (z.B. hier: https://hoffmeister.it/chemie/00-pse/PSE.pdf). In Tests und Arbeiten ist dies eine große Hilfe!
- Schau Dir noch einmal gut alle Inhalte des ersten Halbjahres und des letzten Jahres an!
- Vor allem, wenn Du unsicher mit Reaktionsgleichungen bist, löse noch einmal einige Gleichungen von den drei Reaktionsgleichungs-Arbeitsblättern (=> https://hoffmeister.it/chemie/07-gesetzmaessigkeiten_chemischer_reaktionen.pdf)
Kapitel 1- 6: Verschwenderisch leichte Wiederholungsfragen zum Aufwärmen :-)
-
Wiederhole die Elementsymbole. Erstelle dann eine Übersicht mit den Formeln über alle Elemente, die auf „-stoff“ enden.
-
Falls im Unterricht behandelt: Beschreibe, was man erhält, wenn man Säure und Lauge gleicher Konzentration mischt. Wie nennt man diese Reaktion? Was ist bei deren Durchführung zu beachten?
-
Nenne sechs Säuren und drei Laugen mit Formel und falls im Unterricht behandelt auch deren Säurereste.
-
Falls im Unterricht behandelt: Was sagt der Massenerhaltungssatz aus? Was sagt der Energieerhaltungssatz aus?
-
Stelle die Reaktionsgleichung der Bildung folgender Stoffe auf: Fe2O3 ; Schwefeldioxid ; Schwefeltrioxid ; Phosphoroxid (=P4O10). Welcher Stoff entsteht, wenn man Phosphoroxid und Wasser mischt?
-
Welcher Stoff entsteht, wenn man Kohlenstoffdioxid und Wasser mischt?
-
Stickstoffdioxid reagiert mit Wasser zu Salpetersäure und Salpetriger Säure. Erstelle die Reaktionsgleichung.
-
Welche Aussagen treffen folgende Reaktionsgleichungen?
N2 + 3 H2 + E ---> 2 NH3
CH4 + 3 O2 ---> CO2 + 2 H2O + E
-
Falls im Unterricht behandelt: Was sagt das Gesetz der vielfachen Massenverhältnisse aus? Worin liegt die Erweiterung des Gesetzes der vielfachen Massenverhältnisse im Vergleich zu den konstanten Massenverhältnissen?
-
Was ist der Unterschied zwischen Sauerstoff und Luft?
-
Edelgase sind besonders reaktionsträge. Die liegt an ihrer besonderen Elektronenanordnung. Was versteht man unter Edelgaskonfiguration?
-
Was bedeutet 37Li?
-
Stelle die folgenden Reaktionsgleichungen auf:
-
Salzsäure
+
Calciumlauge
--->
Wasser
+
Calciumchlorid
+
E
Zink
+
Salzsäure
--->
Zinkchlorid
+
Wasserstoff
+
E
Magnesium
+
Salzsäure
--->
Magnesiumchlorid
+
Wasserstoff
+
E
Stickstoffdioxid
+
Wasser
--->
Salpetersäure
+
Stickstoffmonoxid
+
E
Kohlenstoffmonoxid
+
Wasserstoff
--->
Methan (CH4 )
+
Wasser
+
E
Benzin (C8H18)
+
Sauerstoff
--->
Wasser
+
Kohlenstoffdioxid
+
E
-
Schwefel verbrennt an der Luft mit blassblauer Flamme, wenn der Schwefel in reinem Sauerstoff verbrennt, leuchtet er blau und es entsteht ein weißer Feststoff. Stelle die zwei Reaktionsgleichungen auf und bestimme die Massenverhältnisse.
-
Die Gase Stickstoff und Sauerstoff verbinden sich im Automotor im Massenverhältnis N:O = 7/8. Bestimme die Formel des entstehenden Gases.
-
Auch Gase haben ein Gewicht. 2g Wasserstoff und 16g Sauerstoff vereinigen sich beim Entzünden mit einem lauten Knall. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Gramm Wasserstoff braucht man für 12g Sauerstoff?
-
Bei einem Versuch reagieren 140g Eisen mit 80g Schwefel. Stelle die Reaktionsgleichung auf und bestimme das Massenverhältnis. Wie viel Schwefel braucht man für 105g Eisen?
-
Eisen verbrennt mit Schwefel unter hohem Druck im Massenverhältnis 7/6. Bestimme das Atomverhältnis.
Kapitel 7: Aufbau der Atome (Kern-Hülle-Modell)
-
Rutherford hat einen Versuch durchgeführt, der als Streuversuch bekannt wurde. Eines seiner Ergebnisse dabei war, dass Atome im Grunde leer sind. Erkläre den Versuchsaufbau mit einer Zeichnung
-
Stelle Rutherfords Ergebnisse verständlich dar, indem Du seine drei wichtigsten Beobachtungen und Schlussfolgerungen nennst.
-
Nenne die Elementarteilchen und ordne ihnen ihre Masse und Ladung zu.
-
Erkläre ein Modell zum Aufenthaltsbereich der Elektronen.
-
Warum hat Rutherford als Strahlenquelle α-Strahlen (=Heliumkerne) verwendet? Zeichne einen solchen Helimatomkern und vergleiche mit einem Goldatom. Begründe Deine Meinung.
-
Zeichne selbst den Aufbau der folgenden Atome: H, He, Li, Na, Mg, Ca, Ba, Al, I.
-
Welcher Zusammenhang besteht zwischen der Anzahl an Elektronenwolken und der Periodennummer?
-
Nach welchen Kriterien ist das PSE aufgebaut?
-
Besteht ein Zusammenhang zischen der Anzahl an Valenzelektronen und dem PSE?
-
Der russische Physiker Mendelejew hatte das PSE noch nach der Massenzahl geordnet. Finde im PSE Beweise, dass die Elemente heute nach ihrer Ordnungszahl und nicht nach der Massenzahl geordnet sind.
-
Was vermutest Du, war der Grund, warum es so lange gedauert hat, die Elemente sinnvoll anzuordnen.
-
Berechne den Anteil an metallischen Elementen im PSE.
-
Erkläre die Begriffe Hauptgruppe und Elementperiode.
-
Erkläre die Begriffe „Ordnungszahl“, „Protonenzahl“, „Massenzahl“.
-
Warum sind bestimmte Kombinationen von Protonen und Neutronen bei einem Element häufiger zu finden als andere? Was vermutest Du, ist der Grund, dass es nicht von jedem Element Isotope gibt?
-
Nenne verschiedene die verschiedenen Typen radioaktiver Strahlung und zeige, wie sie entstehen (nur falls im Unterricht besprochen).
-
Erkläre das Prinzip der Radio-Karbon Methode (14C-Methode) zur Altersbestimmung (nur falls im UR besprochen).
Kapitel 9: Gruppen des PSE - (Tipp: Wiederhole das Arbeitsblatt: „das Periodensystem der Elemente“)
-
Wo befinden sich im PSE die Metalle bzw. die Nichtmetalle? Welches sind die Nichtmetalle?
-
Welche Elemente gehören zu den I) Alkalimetallen, II) Erdalkalimetallen, VII) Halogenen, VIII Edelgasen?
-
Beschreibe die im Unterricht durchgeführten Versuche mit Alkalimetallen. Erstelle dann eine Reihenfolge ihrer Reaktivität. Wie würde es innerhalb der Hauptgruppe weitergehen?
-
Kannst Du mit eignen Worten erklären, warum die Reaktivität zunimmt?
-
Wie reagieren Erdalkalimetalle mit Wasser und mit Sauerstoff?
-
Erstelle zu den ersten beiden Hauptgruppen jeweils eine Reaktionsgleichung für die Reaktion mit Wasser bzw. mit Sauerstoff.
-
Mit welchem Oberbegriff kann man die Verbrennungsprodukte der Alkalimetalle und der Erdalkalimetalle bezeichnen?
-
Warum verzögert sich der Reaktionsbeginn der Reaktion mit Wasser bei Calcium?
-
In welcher Form treten Verbindungen von Alkalimetallen und Erdalkalimetallen in der Natur auf? Nenne zu jedem Element zwei Beispiele und markiere dabei für menschliches Leben besonders wichtige.
-
Die 7. Hauptgruppe (Halogene) werden auch als „Horrorkabinet“ des PSE bezeichnet. Kannst Du Dir denken warum?
-
Nenne Eigenschaften & Besonderheiten zu den ersten vier Halogenen.
-
Wozu werden Halogene von Menschen verwendet? In welcher Form sind sie lebenswichtig?
-
Erstelle eine Übersicht mit gemeinsamen Eigenschaften der 7. Hauptgruppe.
-
Als Nichtmetalle bilden Halogene neben den Dir bereits bekannten auch sauerstoffhaltige Säuren. Ein typischer Vertreter ist die Chlorsäure (HClO3). Beschreibe seine Herstellung aus den Elementen.
-
Erstelle eine Übersicht über Eigenschaften und Verwendung der Edelgase.
-
Beschreibe mit Deinen Worten die folgenden „Tendenzen“ im PSE: Protonenzahl, Außenelektronen, Atomradius, Metallcharakter, Kernladung.
-
Ist Natrium ein Metall? Welche typischen Metalleigenschaften erfüllt es, welche nicht?
-
Ist die folgende Aussage richtig? „Die Alkalimetalle zeigen eine Abstufung der Eigenschaften“. Gilt diese Aussage auch für die Halogene?
Kapitel 10: Metalle und Redoxreaktionen& Energiediagramm (nur falls behandelt)
-
Ein Stück Natrium wird auf Wasser gelegt. Beschreibe die Reaktion. Stelle die Reaktionsgleichung auf. Liegt eine Redoxreaktion vor?
-
Die Reaktion von Kupferoxid mit Wasserstoff ist eine typische Redoxreaktion. Erkläre sie genau und definiere dann „Redoxreaktion“ und erkläre ihre Kennzeichen.
-
Vergleiche diese Kupferoxidreduktion mit der historischen Kupfergewinnung.
-
Was versteht man unter Oxidation, Reduktion und Redoxreaktion? Erkläre mit einem Beispiel.
-
Liegt bei dem Luftballon-Explosionsversuch eine Redoxreaktion vor? Begründe mit einer Reaktionsgleichung.
-
Nenne drei Wege (mit Reaktionsgleichung) aus CuO das metallische Element zu gewinnen.
-
Was ist der Hochofenprozess? Erkläre umfassend.
-
Beschreibe das Thermitverfahren.
-
Wie unterscheidet sich der Hochofenprozess vom Thermitverfahren, wo liegen Gemeinsamkeiten?
-
Wie kann aus Bleioxid (PbO) Sauerstoff und Blei gewonnen werden?
-
Ist die Zersetzung von Wasser eine Redoxreaktion? Wiederhole den Versuchsaufbau und begründe.
-
Kann man zu Kohlenstoffdioxid verbrannten Kohlenstoff wieder zurückgewinnen?
-
Zum Knobeln: Benzin (C8H18) verbrennt an der Luft zu Wasser und Kohlenstoffdioxid. Erstelle die Reaktionsgleichung und dass passende Energiediagramm. Liegt eine Redoxreaktion vor. Begründe.
-
Erkläre die Begriffe „endotherme Reaktion“ und „exotherme Reaktion“ mit je einer Beispielreaktion und zeichne das passende Energiediagramm. (Vergisst Du die Achsen zu beschriften, schreibe alle Fragen 17mal ab! *g*)
-
Entscheide bei folgenden Reaktionen, ob es sich um einen exo- oder endothermen Vorgang handelt!
a) Beim Entladungsvorgang einer Autobatterie werden Bleiverbindungen umgewandelt und elektrische Energie wird abgegeben.
b) Holz wird zum Heizen von Häusern verwendet.
c) Der Mensch und viele Wirbeltiere sind gleichwarm: Die Körpertemperatur bleibt aufgrund der chemischen Umsetzung von Nährstoffen (hauptsächlich Kohlenhydrate) und Sauerstoff bei der Atmung konstant.
d) Die Reaktion in Verbrennungsmotoren.
e) Bauxit der Ausgangsstoff der Aluminiumherstellung enthält einen großen Prozentsatz an Aluminiumoxid. Die Gewinnung von Aluminium wird stets dort durchgeführt, wo billige elektrische Energie zur Verfügung steht.
f) Quecksilberoxid lässt sich durch Erhitzen in Quecksilber und Sauerstoff zersetzen.
g) Pflanzen speichern bei der Photosynthese Sonnenenergie in chemischer Form in energiereichen Verbindungen (Traubenzucker, Sauerstoff).
h) Eine starke Säure einer Autobatterie wird zum Entsorgen neutralisiert. -
Was ist ein Katalysator? Nenne Aufgaben und beschreibe sein Verhalten z.B. bei der Verbrennung von Zucker. Erstelle die Reaktionsgleichung [Zucker: C6H12O6] und zeichne anschließend ein Energiediagramm der katalytischen Zuckerverbrennung.
-
Vergleiche das Thermitverfahren mit dem Hochofenverfahren.
-
Vergleiche Kupfer und Eisen hinlänglich ihrer Eigenschaften und Verwendung.
-
Nenne Eigenschaften von Aluminium? Wie wird es hergestellt?
-
Vergleiche die Reaktion von ZnO + Cu mit der Reaktion von CuO + Zn. Welches der beiden Metalle ist edler?
-
CuO reagiert mit Mg explosionsartig. Stelle eine Reihung (edel/ unedel) der Metalle Au, Ag, Cu, Mg, Na und Zn auf.
-
In der Natur kommen die meisten Metalle als Oxid vor (also nicht als Element). Gold, Silber und Kupfer hingegen auch in gediegener Form (= als Element). Was vermutest Du als Ursache?
-
Warum hat die „Erfindung“ der Eisenherstellung länger gedauert als die der Kupferherstellung?
-
Ist Bronze ein Element? Was weißt Du eigentlich über die Bronzezeit?
-
Beschreibe eine Möglichkeit, wie man Silber aus dem Erz gewinnt.
-
Nenne Eigenschaften von Wasserstoff und erkläre die Nachweisreaktion (Knallgasprobe). Ist es eine Redoxreaktion?
Kapitel 11: Ionen & Salze (nur falls behandelt)
-
Nenne typische Eigenschaften von Salzen.
-
Was ist ein Ion? Definiere!
-
Erkläre den Begriff Edelgaskonfiguration.
-
Nenne verschiedene Möglichkeiten Natriumchlorid zu bilden. Schlage jeweils einen geeigneten Versuchsaufbau vor.
-
Nenne die Regeln, nach denen man die Ionenladung eines Ions bestimmen kann.
-
Erkläre den Unterschied zwischen H2 und H+ sowie von Ca und Ca2+.
-
Bestimme die Ionenladung der folgenden Ionen und erstelle die Summenformel, welche sie im entsprechenden Salzkristall haben:
|
Cl |
Br |
O |
SO3 |
|
|
Li |
||||
|
Ba |
||||
|
Mg |
||||
|
Al |
-
Stelle die folgenden (sehr schweren) Reaktionsgleichungen auf, Kennzeichne dabei alle Ionen:
a) Ammoniumcarbonat reagiert zu Ammoniak (NH3), Kohlendioxid und Wasser.b) Ammoniumsulfat (NH4)2(SO4) zerfällt in Ammoniak, Schwefeldioxid und Wasser.
c) Reaktion von Natriumcarbonat mit Schwefelsäure. Es entstehen Kohlendioxid, Natriumsulfat und ein dritter, Dir bekannter Stoff.
d) Kaliumcarbonat wird durch Hitze zu Kohlendioxid, Wasser und einem dritten Stoff zersetzt.
e) Reaktion von FeS2 mit Sauerstoff zu Eisen(III)-oxid und Schwefeldioxid.
-
Beschreibe den Versuchsaufbau der Elektrolyse von Kupferchlorid. Welche Beobachtungen kann man machen? Erkläre diese.
-
Betrachte die Bildung von Natriumchlorid aus den Elementen. Ist diese Reaktion Endo- oder exotherm?
-
Warum hat Natriumchlorid die Summenformel NaCl? Im Kristall sind doch viel mehr Ionen enthalten, oder?
-
Was versteht man unter dem Begriff „Koordinationszahl“? Wovon hängt die Koordinationszahl ab?
-
Warum leiten Ionen den elektrischen Strom? Beschreibe einen entsprechenden Versuch.
-
Welche Ionen sind in Natriumchlorid zu finden? Welche in Berylliumsulfat?
-
Vervollständige: Ionen entstehen durch...
-
Vervollständige: Ionen unterscheiden sich von Atomen durch...
-
Beschreibe den allgemeinen Aufbau der Salze.
-
Welche Eigenschaften haben Ionen?
-
Wie bestimmt man die Ladung eines Säurerestes?
-
Welche Ladung hat der Säurerest der Chromsäure H2Cr2O7 und der der Kieselsäure H2SiO3?
-
Welche Voraussetzungen müssen gegeben sein, damit Ionen den Strom leiten?
-
Erkläre den Begriff Ionenbindung. Wodurch werden die Ionen zusammengehalten?
-
Erkläre den Vorgang des Schmelzens eines Salzes. Wovon ist der Schmelzpunkt abhängig?
-
Gönn' Dir eine Pause ;-)
- Details
- Zugriffe: 4756
Chemie - Testvorbereitung zum zweiten Test in Klasse 9/10 (3. Lernjahr)
Testfragen "Ionenlehre":
-
Nenne die Regeln, nach denen man die Ionenladung eines Ions bestimmen kann
-
Beschreibe den Aufbau aller Salze und bilde dann die folgenden Salze:
|
F |
S |
SO4 |
PO4 |
|
|
Na |
||||
|
Ca |
||||
|
Al |
-
Wie bestimmt man die Ladung eines Säurerestes? Welche Ladung hat der Säurerest der Chromsäure (H2Cr2O7) und welche der Kieselsäure H2SiO3?
-
Welche Voraussetzungen müssen gegeben sein, damit Ionen den Strom leiten?
-
Auf ein Filterpapier wird in die Mitte eine Linie gezeichnet und darauf blaue Cu2+-Lösung sowie violette (MnO4)--Lösung getropft. Was passiert, wenn man an die Enden (graue Flächen) eine Spannung von 25V anlegt?
-
Nenne mindestens 3 verschiedene chemische Möglichkeiten zur Salzbildung.
-
Was versteht man unter einem Ionengitter? Beschreibe den Aufbau am Beispiel von Kochsalz.
-
Erkläre die Begriffe Koordinationszahl, Ionenbindung und Summenformel.
-
Beim Lösen von Salzen in Wasser laufen verschieden Vorgänge ab. Erstelle eine Übersicht und erkläre mit dem „Teilchenmodell“ welche Vorgänge ablaufen.
-
Zeichne das Energiediagramm einer exothermen (sowie einer endothermen) Reaktion
-
Kann man eine Vorhersage treffen, ob sich ein bestimmtes Salz exotherm oder endotherm auflöst? Was ist bei schwerlöslichen Salzen?
-
Nenne schwerlösliche Salze und erstelle eine Übersicht, aus der hervorgeht, welche Ionenlösungen man z.B. zusammenkippen kann, um ein schwerlösliches Salz zu bilden.
-
Beschreibe die Verkupferung eines Schlüssels sowie wie man einen Eisennagel verchromt.
Testfragen "Atombindung":
-
Was versteht man unter einer Atombindung? Wie unterschiedet sie sich von einer Ionenbindung?
-
Was ist eine Lewis- bzw. Valenzstrichformel? Was sagt sie aus und wie erstellt man sie?
-
Bei Elektronenpaaren in Valenzstrichformeln gibt es zwei verschiedene Typen. Nenne sie und beschreibe ihre Unterschiede und Gemeinsamkeiten.
-
Wiederhole die Regeln zum Erstellen von Valenzstrichformeln und erstelle dann die Valenzstrichformeln der folgenden Verbindungen: H2, O2, HCl, CH4, H2O, CO2, PF3, SiH4, (ClO4)- sowie die aller Säuren und Säurereste.
-
Was versteht man unter einer Elektronenwolke (=Orbital)?
-
Wie kann ein Element Edelgaskonfiguration erreichen?
-
Wovon ist der räumliche Bau von Molekülen abhängig? Wiederhole die Regeln und bestimme den Bau der in Frage 17 genannten Verbindungen.
-
Im Tetraeder liegt ein Bindungswinkel von genau 109,5° vor. Den folgenden Verbindungen liegt ein Tetraeder zugrunde. Folgende Winkel wurden gemessen:
CH4 109,5°
NH3 106,8°
H2O 104,5°
Wieso werden die Bindungswinkel kleiner? -
Bestimme den räumlichen Bau von HClO, HClO2, HClO3, HClO4.
-
Was versteht man unter Elektronegativität? Erkläre und erläutere danach die folgenden Begriffe: polare Atombindung, Partialladung, Dipolmolekül.
-
Zwischen Atom- und Ionenbindung gibt es eine verbindende Beziehung. Erkläre den Zusammenhang und nenne auch eine mathematische Möglichkeit, den Bindungstyp einer Verbindung zu bestimmen.
-
Warum wird ein Wasserstrahl von einer geladenen Folie angezogen?
-
Trotz Partialladungen gibt es Verbindungen, wie z.B. CCl4 oder CO2, die keine Dipolmoleküle sind. Erkläre warum.
-
Welche weiteren Kräfte zwischen Molekülen kennst Du? Nenne sie nach abgestufter Stärke.
-
Bestimme die Bindungsart der folgenden Verbindungen. Bei welchen liegt ein Dipol vor?
CCl4; H2O, HCl; CO2; MgI2; IF6; CBr4; HBr, H2S, AlCl3. -
Welcher Zusammenhang besteht zwischen intermolekularen1 Kräften und Schmelz- und Siedepunkten?
-
Wie kann man Vorhersagen zu den chemischen und physikalischen Eigenschaften von Molekülen treffen?
Testfragen "Säure, Lauge, Base":
-
Definiere die Begriffe Säure und Lauge und wiederhole alle Säuren und ihre Säurereste.
-
Was ist ein Indikator? Erkläre, welche positiven Eigenschaften ein Stoff haben muss, um ein Indikator zu sein und nenne Dir bekannte Indikatoren.
-
Wie kann man Chlorwasserstoff im Labor darstellen? Wie Salzsäure?
-
Was versteht man unter Protolyse? (Autoprotolyse?)
-
Welcher Zusammenhang besteht zwischen Säuren, der Säurewirkung und Oxoniumionen (bzw. Protonen)?
-
Definiere Säure, Lauge/ Base nach Arrhenius und Brönstedt. Warum hat Brönstedt das System der Lauge erweitert? (Tipp: nenne zuerst 5 Laugen und 15 Basen!)
-
Warum spricht man bei Säure - Base Reaktionen auch vom „Donator-Akzeptor-Prinzip“
-
Begründe mit einer Reaktionsgleichung, warum auch NH3 alkalisch wirken kann und OH- freisetzt, obwohl es doch kein Hydroxid in der Formel enthält!
-
Welche Stoffe werden durch Säuren, welche durch Laugen angegriffen?
-
Was versteht man unter dem „korrespondierenden Säure-Base Paar“?
-
Was versteht man unter dem pH-Wert? Definiere und erkläre den genauen Zusammenhang zwischen pH-Wert und der Konzentration.
-
Nenne 5 Dinge aus dem täglichen Leben, die eine Säure sind
-
Mit welcher Formel kannst Du berechnen, wie viel Lauge zu einer bestimmten Menge Säure hinzugegeben werden muss.
-
Bestimme die Konzentration einer Lösung, die 95ml Wasser und 1mol Salz enthält
-
Wie viel Wasser muss zu 0,121 mol Kochsalz zugegeben werden, damit eine Lösung mit c = 0,05 mol/l entsteht?
-
Berechne: Es sollen 10ml Salzsäure (c= 0,001 mol/l) mit Kalkwasser neutralisiert. Bestimme die notwendige Stoffmenge an Calciumhydroxid.
-
Berechne: Es sollen 10 ml Phosphorsäure (c= 0,001mol/l) neutralisiert werden. Berechne für Kaliumhydroxid und für Kalkwasser.
-
Definiere Lauge und Base und nenne dann Unterschiede und Gemeinsamkeiten der beiden Konzepte.
-
Definiere den Begriff Ampholyt und nenne fünf Beispiele.
-
Schnapp Dir eine kalte Cola, ruf Deinen besten Freund an und entspanne Dich, das hast Du jetzt echt verdient ;-)
1 inter = zwischen, intra = innerhalb
- Details
- Zugriffe: 5504
Testvorbereitung zum ersten Test in Klasse 9/10 (3. Lernjahr)
Testfragen "Ionen & Salze"
-
Nenne typische Eigenschaften von Salzen.
-
Was ist ein Ion? Definiere!
-
Erkläre den Begriff Edelgaskonfiguration.
-
Nenne verschiedene Möglichkeiten Natriumchlorid zu bilden. Schlage jeweils einen geeigneten Versuchsaufbau vor.
-
Nenne die Regeln, nach denen man die Ionenladung eines Ions bestimmen kann.
-
(Falls im Unterricht behandelt: Beschreibe den Versuch zur Ionenwanderung. Welche Beobachtung kann man bei Kupfersalzen, bei Kaliumpermanganat und bei Kaliumdichromat machen. Erkläre diese Beobachtungen).
-
Bestimme die Ionenladung der folgenden Ionen und erstelle die Summenformel, welche sie im entsprechenden Salzkristall haben:
|
Cl |
Br |
O |
SO3 |
|
|
Li |
||||
|
Ba |
||||
|
Mg |
||||
|
Al |
-
Stelle die folgenden (recht schweren) Reaktionsgleichungen auf, Kennzeichne dabei alle Ionen:
a) Ammoniumcarbonat reagiert zu Ammoniak, Kohlendioxid und Wasserb) Ammoniumhydrogensulfit zerfällt in Ammoniak, Schwefeldioxid und Wasser (Tipp: Hydrogensulfit: (HSO3)―)
c) Reaktion von Natriumhydrogencarbonat mit Schwefelsäure. Es entstehen Kohlendioxid,
Natriumsulfat und ein dritter, Dir bekannter Stoff. (Tipp: Hydrogencarbonat: (HCO3)―)d) Kaliumhydrogencarbonat wird durch Hitze zu Kohlendioxid, Wasser und einem dritten Stoff zersetzt.
e) Reaktion von FeS2 mit Sauerstoff zu Eisen(III)-oxid und Schwefeldioxid.
-
Sind diese endo- oder exotherm? Versuche dies jeweils anhand einer Modellvorstellung zu erklären.
-
Warum hat Natriumchlorid die Summenformel NaCl? Im Kristall sind doch viel mehr Ionen zu finden, oder?
-
Warum leiten Ionen den elektrischen Strom? Beschreibe einen entsprechenden Versuch.
-
Welche Ionen sind in Natriumchlorid zu finden? Welche in Berylliumsulfat?
-
Ionen entstehen durch...
-
Ionen unterscheiden sich von Atomen durch...
-
Beschreibe den Aufbau der Salze. Nenne Möglichkeiten sie chemisch zu bilden.
-
Nenne Eigenschaften von Ionen.
-
Welche Voraussetzungen müssen gegeben sein, damit Ionen den Strom leiten?
-
Stelle die folgenden Reaktionsgleichungen auf: (Tipp: Bilde Ionen aus der Schwefelsäure)
a) Schwefelsäure + Wasser
b) Schwefelsäure + Magnesium -
Erkläre den Begriff Ionenbindung. Wodurch werden die Ionen im festen Aggregatzustand zusammengehalten?
-
Erkläre den Vorgang des Schmelzens eines Salzes. Wovon ist der Schmelzpunkt abhängig?
-
Wie bestimmt man die Ladung eines Säurerestes? Welche Ladung hat der Säurerest der Chromsäure „H2Cr2O7“ und welche der Kieselsäure H2SiO3?
-
Nenne mindestens 3 verschiedene chemische Möglichkeiten zur Salzbildung
-
Was versteht man unter einem Ionengitter? Beschreibe den Aufbau am Beispiel von Kochsalz.
-
Erkläre die Begriffe Koordinationszahl und Summenformel.
-
Wovon hängt die Koordinationszahl ab?
-
Zeichne das Energiediagramm einer exothermen (sowie einer endothermen) Reaktion
-
Kann man eine Vorhersage treffen, ob sich ein bestimmtes Salz exotherm oder endotherm auflöst? Was ist bei schwerlöslichen Salzen?
-
Vergleiche Cl2 und Cl- in der Valenzstrichformel.
-
Schüler verwechseln gerne Element, Ion, Molekül und Molekülion. Definiere diese Begriffe und nenne je ein Beispiel. Überlege Dir dann, was ein Elementmolekül ist.
-
Begründe jeweils, welche der abgebildeten Formen des Wasserstoff korrekt oder falsch ist: H, H2, H+, H2+, H2+, H2O, H2O2
Testfragen "Atombindung & Lewisformeln":
-
Was versteht man unter einer Atombindung? Wie unterscheidet sie sich von einer Ionenbindung?
-
Was ist eine Lewis- bzw. Valenzstrichformel? Was sagt sie aus und wie erstellt man sie?
-
Bei Elektronenpaaren in Valenzstrichformeln gibt es zwei verschiedene Typen. Nenne sie und beschreibe ihre Unterschiede und Gemeinsamkeiten.
-
Wiederhole die Regeln zum Erstellen von Valenzstrichformeln und erstelle dann die Valenzstrichformeln der folgenden Verbindungen: H2, O2, HCl, CH4, H2O, CO2, PF3, SiH4, (ClO4)- sowie die aller Säuren und Säurereste
-
Was versteht man unter einer Elektronenhülle?
-
Wie kann ein Element Edelgaskonfiguration erreichen?
-
Stelle eine Hypothese auf: Sind Moleküle energieärmer oder -reicher als die enthaltenden Elemente?
-
Wovon ist der räumliche Bau von Molekülen abhängig. Wiederhole die Regeln und bestimme den Bau der in Frage 4 genannten Verbindungen.
-
Im Tetraeder liegt ein Bindungswinkel von genau 109,5° vor. Den folgenden Verbindungen liegt ein Tetraeder zugrunde. Folgende Winkel wurden gemessen: CH4 109,5°, NH3 106,8°, H2O 104,5°. Wieso werden die Bindungswinkel kleiner?
-
Bestimme den räumlichen Bau von HClO, HClO2, HClO3, HClO4
-
Was versteht man unter Elektronegativität? Erkläre und erläutere danach die folgenden Begriffe: polare Atombindung, Partialladung, Dipolmolekül.
-
Es gibt Schwefeltrioxid und Sulfit. Beide haben vergleichbare Formeln. Zeichne von beiden die Valenzstrichformel und erkläre die genauen Unterschiede zwischen den beiden Stoffen. Ordne dann den beiden Stoffen die folgenden Begriffe zu: Molekül, Ion, Feststoff, Bestandteil von Salzen, Säurerest.
-
Zwischen Atom- und Ionenbindung gibt es eine verbindende Beziehung. Erkläre den Zusammenhang und nenne auch eine mathematische Möglichkeit, den Bindungstyp einer Verbindung zu bestimmen.
-
Warum wird ein Wasserstrahl von einem geladenen Stab angezogen?
-
Trotz Partialladungen gibt es Verbindungen, wie z.B. CCl4 oder CO2, die keine Dipolmoleküle sind. Erkläre warum.
-
Bestimme die Bindungsart der folgenden Verbindungen. Bei welchen liegt ein Dipol vor?
CCl4; H2O, HCl; CO2; MgI2; IF6; CBr4; HBr, H2S, AlCl3 -
Welche Schreibweisen sind für Wasser korrekt? H2O, H2O2―, H+2O2-, H-O-H, H2O
-
Definiere die folgenden Begriffe und nenne je ein Beispiel: Formalladung, Ionenladung, Partialladung, Dipol.
-
Erkläre, wie man bei einer Verbindung entscheiden kann, welche Art der Bindung vorliegt.
-
Definiere die folgenden Begriffe und nenne je ein Beispiel: Molekül, Ion, Ionenbindung, Salz, Element, unpolare Atombindung, polare Atombindung und Edelgaskonfiguration.
-
Überlege genau und entwickle eine Hypothese: Wie kann bei Salpetersäure aus der negativen Formalladung eine negative Ionenladung werden?
-
Welche weiteren Kräfte zwischen Molekülen kennst Du? Nenne sie nach abgestufter Stärke.
-
Welcher Zusammenhang besteht zwischen intermolekularen1 Kräften und Schmelz- und Siedepunkten?
-
Wie kann man Vorhersagen zu den chemischen und physikalischen Eigenschaften von Molekülen treffen? Nenne dazu die Regeln.
-
Bestimme mithilfe der Regeln die Aggregatzustände von SiO2, NH3, CH4, H3COH
1 inter = zwischen, intra = innerhalb
- Details
- Zugriffe: 5068
Testvorbereitung zum zweiten Test in Klasse 7/8 (1. Lernjahr)
Wiederhole vorher alle Inhalte und die Merksätze der ersten beiden Kapitel!
Kapitel 3: Verbrennungen und Oxidationen
-
Was brennt eigentlich, wenn du eine Kerze angezündet hast? Beschreibe, welche Aufgabe der Docht hat.
-
Die folgenden Sätze beschreiben, was beim Anzünden einer Kerze geschieht. Leider sind sie durcheinander geraten. Wie muss die richtige Reihenfolge lauten?
a) Am Docht befindet sich festes Wachs. Es brennt nicht.
b) Der Wachsdampf entzündet sich und beginnt zu brennen.
c) Das flüssige Wachs steigt im Docht nach oben (ähnlich wie Tinte im Löschpapier).
d) Der Wachsdampf erreicht seine Entzündungstemperatur.
e) Wenn man eine Streichholzflamme an den Docht hält, wird das Wachs erhitzt und schmilzt.
f) Das Wachs beginnt zu sieden und verdampft. -
Vergleiche die Flammen von Brenner und Kerze.
-
Es müssen drei Voraussetzungen erfüllt sein, damit etwas brennt. Schreibe sie auf.
-
Beim Gas genügt ein kleiner Funke, um es zu entzünden. Dazu reicht ein leeres Feuerzeug, welches selbst kein Gas mehr enthält. Könntest du auch eine Kerze mit einem leeren Feuerzeug entzünden? Begründe.
-
Manche Stoffe dürfen nur in einem heißen Wasserbad erhitzt werden. Welche Stoffe könnten das deiner Meinung nach sein? Begründe Deine Meinung.
-
Stelle die Reaktionsgleichung der Verbrennung von a) Schwefel, b) Kohlenstoff, c) einem beliebigen Metall auf
-
Wozu dient Kalkwasser? Wie stellt man es her?
-
Schlage einen Versuchsaufbau vor, der beweist, dass man Kohlenstoffdioxid ausatmet.
-
Was ist eine Oxidation? Nenne die drei Formen der Oxidation? Kann man stille Oxidationen beobachten?
-
Was denkst Du, warum Explosionen im Chemieunterricht als sehr gefährlich betrachtet werden und warum alle explosiven Stoffe Sicherheitsschilder tragen müssen?
-
Der Verkauf von Silvesterknaller aus osteuropäischen Ländern ist zum Teil in Deutschland verboten, was meinst Du, warum das so ist?
-
Informiere Dich zu den Konsequenzen der täglich millionenfachen Verbrennungen auf unserem Planeten. Gute Suchbegriffe sind: Luftverschmutzung, Treibhauseffekt, Ozonloch, Smog.
-
Um welchen Faktor verbrennen Stoffe in reinem Sauerstoff schneller als in Luft? Nenne Beispiele aus dem Unterricht.
-
Erkläre den Begriff Nichtmetalloxid und ordne den 3 Aggregatzuständen Dir bekannte Nichtmetalloxide zu
-
Informiere Dich über den Stoff Kohlenmonoxid und seine Gefahren.
-
Was ist der Unterschied zwischen Sauerstoff und Luft? Wie kann man entstehenden Sauerstoff nachweisen?
-
Ist Luft ein Element? Schlage einen Versuchsaufbau vor, mit dem dies gezeigt werden kann.
-
Verbrennt ein Stückchen Kohle schneller in Luft, Stickstoff oder reinem Sauerstoff?
-
Bei einem Waldbrand fliegen mit Wasser beladene Hubschrauber über das Feuer und werfen das Wasser ab. Was verspricht sich die Feuerwehr davon? Warum kann ein Wald, der auf solche Art gelöscht wurde, jederzeit wieder anfangen zu brennen? Welche Rolle spielt eigentlich Wind beim wieder Entfachen eines Waldbrandes?
-
Was versteht man unter der Entzündungstemperatur? Nenne ein Beispiel, wo die Entzündungstemperatur eine wichtige Rolle spielt.
-
Welchem Einfluss hat die Form eines Holzstücks auf seine Entzündung am Lagerfeuer? (Vergleiche dazu einen Ast und einen Baumstamm).
-
Ein Schüler sagt: „Eine Verbrennung ist eine Oxidation, aber nicht jede Oxidation ist eine Verbrennung“. Hat der Schüler damit recht?
-
Ordne die folgenden Stoffe nach ihrer Entzündungstemperatur: Streichholz, Benzindampf, Holzkohle, Stroh.
Was ist ein Metalloxid? Erkläre und nenne drei Beispiele (Was ist ein Nichtmetalloxid?) -
Wozu verwendet man Metalloxide?
-
Ist die Verbrennung von Kupfer eine Oxidation? Begründe Deine Meinung.
-
Erkläre den Unterschied zwischen Element und Verbindung.
-
Erkläre die Vereinigung von Eisen und Schwefel und die Zersetzung von Quecksilberoxid.
-
Auf dem Herd hat eine Bratpfanne angefangen zu brennen. Was ist passiert? Wie kann sie gelöscht werden?
-
In einem Grill brennt Grillkohle. Liegt eine chemische Reaktion vor? Begründe Deine Meinung und stelle die Reaktionsgleichung auf.
-
In einem mit Wasser gefüllten Becherglas steht ein Reagenzglas mit der Öffnung nach unten. Es
enthält feuchte Eisenwolle. Lässt man den Versuch zwei Tage stehen, steigt das Wasser im
Reagenzglas an. Erkläre, warum und um wie viel Prozent das Wasser steigt.
Kapitel 4: Säuren und Laugen
-
Nenne 5 Säuren und 3 Laugen mit ihrer Formel. Stelle dann die Reaktionsgleichung einer beliebigen Neutralisation auf.
-
a) In Cola ist viel Phosphorsäure enthalten. Wie kann eine Getränkefirma Phosphorsäure herstellen?
b) Stelle die Reaktionsgleichungen dazu auf
c) Wie kann diese Säure unschädlich gemacht werden? Beschreibe genau, wie man dazu vorgehen muss. -
Schwefeloxid wird mit Wasser vermischt. Stelle die Reaktionsgleichung auf.
-
a) Stelle die Reaktionsgleichung der Verbrennung von Magnesium auf.
b) Erkläre an diesem Beispiel die Begriffe Oxidation und Metalloxid.
c) Welche Farbe zeigt Universalindikator, wenn man das Produkt aus 3a) mit Wasser mischt? -
Wissenschaftler haben festgestellt, dass Regenwasser auch Säuren enthält. In den letzten Jahren hat man nun beobachtet, dass vor allem in Gebieten mit starkem Autoverkehr, der Regen besonders sauer ist.
Besteht da ein Zusammenhang? (Tipp: In Benzin sind Kohlenstoff und Schwefel enthalten). -
Was ist der pH-Wert?
-
Was vermutest Du, warum man den Säuregrad überhaupt messen muss? Reicht nicht eine Bezeichnung wie sauer oder neutral aus?
-
Warum kann eine starke Säure auch manchmal schwach wirken? Vergleiche mit einem starken Sportwagen, der in einer 30er-Zone fährt.
-
Warum sind Aquarienliebhaber so sehr am pH-Wert ihres Wassers interessiert?
-
Mit der wie vielfachen Menge Wasser muss man 1l Essig verdünnen, damit er nicht mehr sauer ist (pH =7)?
-
a) Was ist eine „Neutralisation“? Beschreibe eine Versuchsdurchführung und stelle Beobachtung und Schlussfolgerung auf (mit Reaktionsgleichung!).
b) Stelle die Reaktionsgleichung der Neutralisation von Phosphorsäure mit Kalilauge auf. -
Ein Bauarbeiter arbeitet beim Anrühren des Zementes ohne Handschuhe. Dazu verwendet er sogenannten „gebrannten Kalk“ (CaO). Nach einigen Wochen sind seine Hände stark angegriffen, eingerissen und rötlich. Finde eine Erklärung.
-
Erstelle die Reaktionsgleichungen der folgenden Neutralisationen:
Natronlauge + Schwefelsäure --->
Kalilauge + Phosphorsäure --->
Cacliumhydoxid (= Kalkwasser) + Phosphorsäure --->
Kapitel 5: Teilchentheorie, Löslichkeit und Lösungsmittel
-
Warum blubbert kochendes Wasser?
-
Kann man aus sprudelndem Mineralwasser eigentlich einen Tee kochen, der normal schmeckt? Erkläre an diesem Beispiel das Lösen von Gasen in Wasser.
-
Welches Gas ist eigentlich in Mineralwasser aufgelöst?
-
Warum trocknet eine gewischte Tafel eigentlich, sie ist doch kälter als der Siedepunkt von Wasser?
-
Wie kann es in einem heißen Sommer passieren, dass die Fische in kleineren Seen sterben? In welchen Jahreszeiten fühlen sich Fische demzufolge am wohlsten?
-
Beschreibe, was man beobachtet und was mit den Atomen passiert, wenn man Wasser kocht
-
Nenne drei Lösungsmittel und ordne ihnen Stoffe zu, die sich darin auflösen.
-
Warum kann sich Salz nicht in Waschbenzin auflösen? Welche Stoffe löst Waschbenzin besser? Nenne eine passende Regel.
-
In welcher Lösungsmittelgruppe lösen sich: Säuren, Laugen, Salze, Nagellack, Butter, Ölflecken,
-
Ein starker Raucher hat gelbe Finger und Zähne und in der Wohnung gelb-verschmutzte Gardinen. Nur mit Wasser bekommt er es nicht sauber. Was ist für die Verschmutzung verantwortlich und wie kann dem Raucher geholfen werden?
-
Erkläre, wie man eine übersättigte Salzlösung herstellen und wie man mit dieser einen Kristall züchten kann.
-
Beim Kochen einer gefrorenen Salzlösung kann man zwei interessante Beobachtungen machen. Erkläre sie
-
Erkläre die Wirkung von Streusalz
-
Warum wird in die Scheibenwaschanlage (im Winter) Alkohol zum Seifenwasser zugefügt?
-
Warum gefriert eine mit Alkohol enteiste Autoscheibe schneller wieder, als eine, die freigekratzt wurde?
-
Warum wird stark verschmutzte Wäsche bei 60°C und leicht verschmutzte Wäsche nur bei 40°C gewaschen?
-
Nenne zwei Methoden, wie man fettige Hände nach dem Essen eines Hähnchens reinigen kann.
-
Ein Schüler hatte einen Motorschaden mit seinem Mofa. Er vermutet, dass ihm jemand Zucker in den Tank getan hat.
a) Warum ist Zucker für den Motor gefährlich und wie wirkt er sich aus?
b) Kann man den Zucker noch nachweisen - und wie? -
Warum schwimmen die Fettaugen in der Suppe oben?
-
Beschreibe die chemische Verbindung H2O. Nenne Vorkommen, Eigenschaften und Bedeutung
-
Wie erklärst Du Dir den hohen Wasserverbrauch in Deutschland von bis zu 300l/ Tag und Person? (zum Vergleich: in einigen Entwicklungsländern liegt er bei 4l/ Tag und Person!)
-
Wie stellt man aus Wasser eigentlich Wasserstoff her? Kann man das auch „kostenlos“ machen?
-
Beschreibe Wasserstoff mit seinen Eigenschaften und Reaktionen
-
Nenne chemische Trennungsmethoden und ordne ihnen passende Stoffgemische zu
-
Wie funktioniert eigentlich eine Kläranlage?
-
Beschreibe die Extraktion von Erdnussöl
-
Wie trennt man ein Sand-Salzgemisch?
-
Vervollständige die allgemeinen Aussagen eines Diagramms:
Je ................ die Gerade, desto höher die Geschwindigkeit. Unterbrechungen hingegen sagen etwas über den .................................... aus. ................... die Kurve , wie gewohnt, danach weiter, so liegt ein ................................ vor, entsteht eine Stufe, so war vielleicht der ..................... aus. Fällt die .................................. , so wurde vielleicht kälteres Wasser zugefügt. -
Welche Messfehler kann man beim Messen einer Temperatur-Zeitkurve erhalten? Zähle auf.
-thumb.png)